3.阿伏加德罗常数:把6.02 X1023mol-1叫作阿伏加德罗常数。 4.物质的量 = 物质所含微粒数目/阿伏加德罗常数 n =N/NA
5.摩尔质量(M)(1) 定义:单位物质的量的物质所具有的质量叫摩尔质量.(2)单位:g/mol 或 g.mol-1(3) 数值:等于该粒子的相对原子质量或相对分子质量. 6.物质的量=物质的质量/摩尔质量 ( n = m/M ) 六、气体摩尔体积
1.气体摩尔体积(Vm)(1)定义:单位物质的量的气体所占的体积叫做气体摩尔体积.(2)单位:L/mol
2.物质的量=气体的体积/气体摩尔体积n=V/Vm 3.标准状况下, Vm = 22.4 L/mol 七、物质的量在化学实验中的应用 1.物质的量浓度.
(1)定义:以单位体积溶液里所含溶质B的物质的量来表示溶液组成的物理量,叫做溶质B的物质的浓度。(2)单位:mol/L(3)物质的量浓度 = 溶质的物质的量/溶液的体积 CB = nB/V
(1)基本原理:根据欲配制溶液的体积和溶质的物质的量浓度,用有关物质的量浓度计算的方法,求出所需溶质的质量或体积,在容器内将溶质用溶剂稀释为规定的体积,就得欲配制得溶液. (2)主要操作
a.检验是否漏水.b.配制溶液 1计算.2称量.3溶解.4转移.5洗涤.6定容.7摇匀8贮存溶液. 注意事项:A 选用与欲配制溶液体积相同的容量瓶. B 使用前必须检查是否漏水. C 不能在容量瓶内直接溶解. D 溶解完的溶液等冷却至室温时再转移. E 定容时,当液面离刻度线1-2cm时改用滴管,以平视法观察加水至液面最低处与刻度相切为止. 3.溶液稀释:C(浓溶液)× V(浓溶液) =C(稀溶液) ×V(稀溶液)
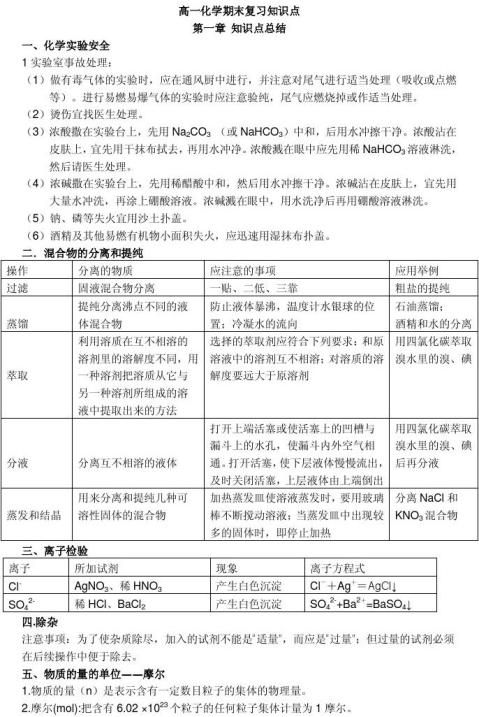
第二章知识点总结
一、物质的分类
分散系:把一种(或多种)物质分散在另一种(或多种)物质中所得到的体系。 分散质:被分散的物质称作分散质(可以是气体、液体、固体)。
分散剂:起容纳分散质作用的物质称作分散剂(可以是气体、液体、固体)。
溶液、胶体、浊液三种分散系的比较
分散系 溶液 胶体 浊液
分散质粒子大小/nm <1 1-100 >100
均匀、透明、稳定 均匀、有的透明、较稳定 不均匀、不透明、不稳定
外观特征
能否通能 能 不能
能否通过 丁达尔
效应 没有 有 没有
蔗糖溶液
不能 不能
Fe(OH)3胶体 泥水
胶体的性质:布朗运动,电泳,聚沉,丁达尔效应(特性) 二、物质的化学变化
1、物质之间可以发生各种各样的化学变化,依据一定的标准可以对化学变化进行分类。 (1)根据反应物和生成物的类别以及反应前后物质种类的多少可以分为:
能
实例
过滤纸 半透膜
A、化合反应(A+B=AB) B、分解反应(AB=A+B)
C、置换反应(A+BC=AC+B) D、复分解反应(AB+CD=AD+CB)
(2)根据反应中是否有离子参加可将反应分为:
A、离子反应:有离子参加的一类反应。
B、分子反应(非离子反应)
(3)根据反应中是否有电子转移可将反应分为:
A、氧化还原反应:反应中有电子转移(得失或偏移)的反应
实质:有电子转移(得失或偏移)

第三章重要化学方程式
1.金属钠的化学性质:
钠露置空气中变暗:4Na+O2=2Na2O(白色)
钠的燃烧:2Na+O2Na2O2(淡黄色)
钠投入水中:2Na+2H2O=2NaOH+H2↑ 2Na+2H2O=2Na++2OH–+H2↑ (现象:浮、融、游、响、红)
钠与盐酸(先酸后水):2Na+ 2HCl===2NaCl+H2↑ 2Na+ 2H+===2Na++H2↑
钠与硫酸铜溶液(先水后盐):
2Na+2H2O=2NaOH+H2↑ 2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
2Na+2H2O+CuSO4=Na2SO4+Cu(OH)2↓+H2↑(总式)
2.氧化钠的化学性质:
氧化钠与水:Na2O+H2O=2NaOH Na2O+H2O=2Na++2OH– 氧化钠与二氧化碳:Na2O+CO2=Na2CO3
氧化钠与盐酸:Na2O+2HCl=2NaCl+H2O Na2O+2H+=2Na++H2O
3.过氧化钠的化学性质(漂白性、强氧化性):
过氧化钠与水:2Na2O2+2H2O=4NaOH+O2↑ 2Na2O2+2H2O=4Na++4OH–+O2 过氧化钠与二氧化碳:2Na2O2+2CO2=2Na2CO3+O2
4.碳酸钠与碳酸氢钠的化学性质:
溶解性的的比较:Na2CO3>NaHCO3
碱性的比较:Na2CO3> NaHCO3
热稳定性的比较:Na2CO3>NaHCO3
Na2CO3+H2O+CO2↑ 碳酸氢钠受热分解:2NaHCO3
碳酸钠与酸的反应:Na2CO3+HCl =NaCl+ NaHCO3 CO32–+ H+= HCO3-
Na2CO3+2HCl =2NaCl+H2O+CO2↑ CO32–+ 2H+=CO2↑+H2O
碳酸氢钠与酸的反应:NaHCO3+HCl=NaCl+H2O+CO2↑ HCO3-+H+=CO2↑+H2O 碳酸钠转换成碳酸氢钠(Na2CO3→NaHCO3):
通入CO2:Na2CO3+H2O+CO2=2NaHCO3 CO32–+H2O+CO2=2HCO3- 加入适量稀盐酸:Na2CO3+HCl =NaCl+ NaHCO3 CO32–+ H+= HCO3- 碳酸氢钠转换成碳酸钠(NaHCO3→Na2CO3):
碳酸氢钠受热分解:2NaHCO3Na2CO3+H2O+CO2↑(除去NaHCO3最佳方法)
加入适量氢氧化钠:NaHCO3+NaOH= Na2CO3 + H2O HCO3-+OH-=CO32–+H2O
5.金属铝的化学性质:
铝在空气中常温或加热条件下都生成致密的氧化膜: 4Al+3O2=2Al2O3 铝与稀盐酸的反应:2Al+6HCl===2AlCl3+3H2↑ 2Al+6H+=2Al3++3H2↑ 铝与氢氧化钠的反应: 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ 2Al+2OH–+2H2O=2AlO2–+3H2↑
注意:1.等质量的或等物质的量的铝与足量稀盐酸或氢氧化钠反应产生的氢气的量是相等的。2.反应刚开始比较慢,是因为铝表面致密的氧化膜(Al2O3) 3.因为铝既可与盐酸反应又可与氢氧化钠反应生成盐和氢气,所以我们说Al是两性金属。
6.氧化铝的化学性质:(物理性质:难溶于水,熔点高,硬度大)
氧化铝与稀盐酸的反应: Al2O3+6HCl=2AlCl3+3H2O Al2O3+6H+=2Al3++3H2O 氧化铝与氢氧化钠的反应:Al2O3+2NaOH=2NaAlO2+H2O Al2O3+2OH–=2AlO2―+H2O 注意:因为氧化铝既可与盐酸反应生成盐和水,又可与氢氧化钠反应生成盐和水,所以我们说Al2O3是两性氧化物。
7.氢氧化铝的化学性质:
氢氧化铝的制取:AlCl3+3NH3·H2O=Al(OH)3↓+3NH4Cl Al3++3NH3·H2O=Al(OH)3↓+3NH4+ Al2(SO4)3+6NH3·H2O=2Al(OH)3↓+3(NH4 )2SO4 Al3++3NH3·H2O=Al(OH)3↓+3NH4+ 氢氧化铝与HCl的反应:Al(OH)3+3HCl=AlCl3+3H2O Al(OH)3+3H+=Al3++3H2O 氢氧化铝与NaOH的反应:Al(OH)3+ NaOH =NaAlO2+2H2O Al(OH)3+ OH– =AlO2–+2H2O 注意:因为氢氧化铝既可与盐酸反应生成盐和水,又可与氢氧化钠反应生成盐和水,所以我们说Al(OH)3是两性氢氧化物。
氢氧化铝溶解性差,热稳定性也不好,受热易分解:2Al(OH)3Al2O3+3H2O
8.金属铁的化学性质:
铁与水蒸气在加热条件的反应:3Fe+4H2O(g)
铁在氧气中燃烧:3Fe+ 2O2Fe3O4 Fe3O4+4H2
铁与酸的反应:Fe+2HCl = FeCl2+H2↑ Fe+2H+= Fe 2++H2↑
铁的还原:Fe2O3+3CO=2Fe+3CO2(条件是高温)
铁与盐的反应:Fe+CuSO4=FeSO4+Cu Fe+Cu2+=Fe2++Cu
9.铁的氧化物的化学性质:
常见的铁的氧化物有:氧化亚铁(FeO)、氧化铁(Fe2O3)、四氧化三铁(Fe3O4) 氧化亚铁与盐酸的反应:FeO+2HCl=FeCl2+H2O FeO+2H+=Fe2++H2O 氧化铁与盐酸的反应:Fe2O3+6HCl=2FeCl3+3H2O Fe2O3+6H+=2Fe3++3H2O 四氧化三铁与盐酸的反应:Fe3O4+8HCl=FeCl2+2FeCl3+4H2O Fe3O4+8H+=2Fe3++Fe2++4H2O
10.铁的氢氧化物的化学性质:
—氢氧化亚铁的制取:FeSO4 + 2NaOH = Fe(OH)2↓+ Na2SO4 Fe2+ + 2OH = Fe(OH)2↓ 现象:先有白色沉淀,沉淀迅速变成灰绿色,最后变成红褐色。
Fe(OH)2—氢氧化铁的制取:FeCl3 + 3NaOH = Fe(OH)3↓+ 3NaCl Fe3+ + 3OH = Fe(OH)3↓
现象:迅速产生红褐色沉淀。
氢氧化亚铁与酸的反应:Fe(OH)2 + 2HCl = FeCl2 + 2H2O Fe(OH)2 + 2H+= Fe2+ + 2H2O 氢氧化铁与酸的反应: Fe(OH)3 + 3HCl = FeCl3 + 3H2O

Fe(OH)3 + 3H+= Fe3+ + 3H2O
11.Fe2+ 与Fe3+之间的相互转化与鉴定:
(Fe3+)的鉴定:往溶液中滴入几滴KSCN溶液,溶液迅速变成红色;而二价铁(Fe2+)则
无任何现象,所涉及的方程式(了解):Fe3+ + 3SCN- =Fe(SCN)3
(Fe3 →+Fe2+):三价铁自身是强氧化剂,遇较强还原剂会被还原成二价铁。
氯化铁与铜的反应:FeCl3+Cu=2FeCl2+CuCl2 (用于溶解铜线路版) 3+2+2+ 氯化铁与铁粉的反应:FeCl3+Fe=3FeCl2 3+2+
(Fe2+ →Fe3+):二价铁自身是强还原剂,遇较强氧化剂会被氧化成三价铁。
氯化亚铁溶液中通入氯气:2FeCl2+Cl2=2FeCl3 2+3+-
所以Fe2+ 、Fe3+在一定条件下是可以相互转化的。
12.重点:过量问题
二氧化碳与氢氧化钠的反应:
CO2+2NaOH(过量)=Na2CO3+H2O ① 2OH–+CO2=CO32–+H2O
Na2CO3+H2O+CO2=2NaHCO3 ②中间反应 CO32–+H2O+CO2=2HCO3 -
CO2(过量)+NaOH=NaHCO3 (①式+②式) OH–+CO2=HCO3–
二氧化碳与氢氧化钙的反应:先生成沉淀,后沉淀消失。
CO2+Ca(OH)2(过量)=CaCO3↓+H2O① Ca2++2 OH–+CO2=CaCO3↓+H2O CaCO3+CO2+ H2O=Ca(HCO3)2②中间反应 CaCO3+CO2+ H2O=Ca2++2HCO3– 2CO2(过量)+ Ca(OH)2=Ca(HCO3)2(①式+②式) OH–+CO2=HCO3–
碳酸钠与酸的反应:
Na2CO3(过量)+HCl =NaCl+ NaHCO3 CO32–+ H+= HCO3-
Na2CO3+2HCl(过量) =2NaCl+H2O+CO2↑ CO32–+ 2H+=CO2↑+H2O
氯化铝与氢氧化钠的反应:先生成沉淀,后沉淀消失。
3NaOH+AlCl3(过量) =Al(OH)3↓+3NaCl ① 3OH–+Al3+=Al(OH)3↓ NaOH+Al(OH)3=NaAlO2+2H2O ②中间反应 OH–+Al(OH)3=AlO2–+2H2O 4NaOH(过量)+AlCl3 =NaAlO2+2H2O+3NaCl(①式+②式) 4OH–+Al3+=AlO2–+2H2O 偏铝酸钠与盐酸的反应:先生成沉淀,后沉淀消失。
NaAlO2(过量)+HCl+H2O = Al(OH)3↓+NaCl ① AlO2–+H++H2O=Al(OH)3↓
Al(OH)3+3HCl=AlCl3+3H2O②中间反应 Al(OH)3+3H+=Al3++3H2O NaAlO2+4HCl(过量) =AlCl3+NaCl +2H2O(①式+②式) AlO2–+4H+=Al3++2H2O 二氧化碳与偏铝酸钠的反应:
CO2(不足)+2NaAlO2+3H2O=2Al(OH)3↓+Na2CO3 CO2+3H2O+2AlO2–=2Al(OH)3↓+CO32– CO2(足量)+NaAlO2+2H2O=Al(OH)3↓+NaHCO3 CO2+2H2O+AlO2–=Al(OH)3↓+HCO3– 氯化铝与偏铝酸钠的双水解反应:

-3+
第四章 非金属硅及氯的化学方程式总结
一、硅及其化合物
1、硅单质
物理性质:有金属光泽的灰黑色固体,熔点高,硬度大,质地脆,导电性介于导体和绝缘体之间。
化学性质:
–硅与强碱的反应:Si+2NaOH+H2O =Na2SiO3+2H2↑ OH-+ Si+H2O =SiO32+H2↑
硅与氢氟酸反应:4HF+Si=SiF4↑+2H2↑
常温下化学性质稳定 硅的还原性:Si(粉)+O2SiO2
粗硅的制取:2C+SiO2=Si+2CO(制得粗硅)
粗硅的提纯:Si(粗)+2Cl2=SiCl4 SiCl4+2H2=Si(纯)+4HCl
硅的用途:硅可制造集成路、电子芯片、太阳能电池板等。
2、二氧化硅及硅酸
存在:结晶形和无定形。通称硅石。
化学性质稳定,除氢氟酸外,一般不与其他酸反应,可以与强碱、碱性氧化物发生反应,属酸性氧化物。
用途:SiO2是光导纤维的主要原料,以SiO2为主要原料的物质大多都有石英某某、水晶某某;玛瑙某某。
与碱性氧化物反应: SiO2+CaO=CaSiO3
–与碱的反应: SiO2+2NaOH=Na2SiO3+H2O OH-+SiO2=SiO32+H2O
硅酸盐与酸生成硅酸的反应:
Na2SiO3+2HCl=H2SiO3(胶体)+NaCl SiO32-+2H+=H2SiO3(胶体)
Na2SiO3+CO2+2H2O=H2SiO3↓+Na2CO3 SiO32-+CO2+H2O=H2SiO3↓+CO32-
与氢氟酸反应:SiO2+4HF =SiF4↑+2H2O
硅酸易受热分解:H2SiO3 = SiO2↓+H2O
3、硅酸盐
硅酸盐是由硅、氧和金属组成的化合物的总称,在自然界分布极广,种类极多,是一类结构复杂的固体物质,大多不溶于水,化学性质很稳定。
硅酸钠:(最简单的硅酸盐) 可溶于水,其水溶液俗称水玻璃,可做粘合剂和防火剂,是制备硅胶和木材防火剂等的原料。
– 制备途径:SiO2+2NaOH=Na2SiO3+H2O OH-+SiO2=SiO32+H2O(贮存NaOH溶液的试剂
瓶要用橡胶塞)
常见的硅酸盐产品:
二、氯及其化合物
1、氯气(Cl2)
Cl2的制取:
–原理:4HCl(浓)+MnO2MnCl2+Cl2↑+2H2O 4H++2Cl+MnO2Mn2++Cl2↑+2H2O
发生装置:固液加热型
气体收集装置:向上排空气法(或排饱和食盐水法)
尾气处理装置:用碱液(NaOH)吸收
氯气物理性质:
①黄绿色 ②气体 ③有刺激性气味 ④有毒 ⑤密度比空气大 ⑥2:1体积溶于水 ⑦易液化 化学性质:
—a、与水(H2O)的反应:Cl2 + H2O = HCl + HClO Cl2 + H2O = H++Cl+ HCl
用途:可用于自来水的杀菌、消毒
新制氯水中的粒子:Cl2;H2O;HClO;H+;Cl-;ClO-;OH-(少量)
久置氯水中的粒子:H+;Cl-;H2O;OH-(少量)
b、与碱反应:
–––与NaOH反应:Cl2+2NaOH=NaCl+NaClO+H2O Cl2+2OH=Cl+ClO+H2O
(产物NaClO:漂白液的主要成分)
–与Ca(OH)2反应:Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O Cl2+2OH-=Cl-+Cl+H2O
(产物Ca(ClO)2:漂白粉、漂白精的主要成分)
注:漂白粉产生作用的原因:Ca(ClO)2+CO2+H2O= 2HClO +CaCO3↓
且次氯酸易分解:2HClO2HCl+O2↑
c、与金属的反应:
与Na的反应:2Na+ Cl22NaCl 现象:有黄光,燃烧,产生白烟
与Fe的反应:3Cl2

+2Fe2FeCl3 现象:燃烧,产生棕黄色的烟
与Cu的反应:Cu + Cl2CuCl2 现象:燃烧,产生棕黄色的烟
d、与非金属的反应:
与H2的反应:H2+Cl2

2HCl 现象:H2在Cl2中燃烧,产生苍白色火焰 ,在集气瓶口有白雾生成
2、氯离子(Cl-)的检验 原理:Ag++Cl-

= AgCl
试剂:AgNO3溶液和稀硝酸(HNO3)
操作:(加稀硝酸的作用是除去干扰离子:CO32-)
方法一:在被检验的溶液中加入稀硝酸酸化,再滴入AgNO3溶液,若产生白色沉淀,则被检液中含有Cl-。
方法二:在被检验的溶液中滴入AgNO3溶液,若产生白色沉淀,再加入稀硝酸,沉淀不溶,则被检液中含有Cl-。
3、氯气的强氧化性:
氯气将非金属最低价离子氧化为单质
氯气与溴化钠反应:Cl2+2NaBr=2NaCl+Br2 Cl2+2Br-=2Cl-+Br2
氯气与碘化钾反应:Cl2+2KI=2KCl+I2 Cl2+2I-=2Cl-+I2
––氯气与硫化钠反应:Cl2+Na2S=2NaCl+S↓ Cl2+S2=2Cl+S↓
–氯气与硫化氢反应:Cl2+H2S=2HCl+S↓ Cl2+H2S=2H++2Cl+S↓
