 有机化学基础方程式总结
有机化学基础方程式总结
一、脂肪烃
1.烷烃
化学性质:不与强酸、强碱、强氧化剂和强还原剂反应,不能使溴的四氯化碳溶液或酸性高锰酸钾溶液褪色。
(1)取代反应 CH3CH3 + Cl2 →
(2)氧化反应—可燃性 CnH2n+2 + O2 →
2.烯烃
(1)烯烃通入酸性高锰酸钾溶液或溴水中会使溶液褪色
(2)可燃性 烯烃燃烧火焰明亮,伴有黑烟
CnH2n + O2 →
(3)烯烃与H2、X2、HX、H2O发生加成反应
1溴水 卤素单质(X2)
CH2==CH2 + Br2 → 常温下使溴水褪色
2氢气(H2) CH2==CH2 + H2 →
3水 CH2==CH2 + H—OH →
4氯化氢 CH2==CH2 + HCl →
3.炔烃
物理性质:无色无味,密度比空气略小,微溶于水,易溶于有机溶剂.有特殊难闻臭味.
化学性质:能发生加成反应、氧化反应和聚合反应。但比烯烃困难。
(1)乙炔的制取 CaC2 (俗名电石)+ H2O → 收集方法:排水集气法
(2)使酸性高锰酸钾溶液褪色
(3)可燃性 C2H2 + O2 → 现象:
(4)加成反应
氢气:HC≡CH + H2 →
卤素:HC≡CH + Br2 →
(5)加聚反应 HC≡CH→
二、卤代烃
1.物理性质
(1)气味:具有一种令人不愉快的气味且蒸汽有毒。
(2)沸点
1卤原子种类及个数相同时,卤代烃的沸点随碳原子数增加而升高
2卤代烃的同分异构体的沸点随烃基中支链的增加而降低
3同一烃基的不同卤代烃的沸点,随卤素原子的相对原子质量的增大而升高
(3)溶解性
难溶于水,易溶于有机溶剂,有些卤代烃本身就是良好的有机溶剂,如四氯化碳等。
2.化学性质
(1)水解反应(取代反应)CH3CH2Br +NaOH →
(2)消去反应
CH3—CH2Br + NaOH →
补充:发生消去反应的条件:
三、醇
1.醇的化学性质
(1)消去反应
CH3—CH2OH → 浓硫酸作用:催化剂,脱水剂
(2)脱水反应 C2H5—OH + HO—C2H5 →
(3)取代反应 C2H5—OH + H—Br →
(4)氧化反应 乙醇使酸性KMnO4,K2Cr2O7溶液褪色
CH3CH2OH → CH3CHO → CH3COOH(乙酸)
在Cu作催化剂时醇被氧化为醛或酮
实验现象:
化学反应式:
醇发生催化氧化的条件:
四、芳香烃
1.取代反应 
 + Br2 →
+ Br2 →

 + Cl2 →
+ Cl2 →
2.加成反应  + H2 →
+ H2 →
3.氧化反应
(1).不能被酸性KMnO4溶液氧化
(2).可燃性 C6H6 + O2 → 现象:
五、苯酚
1.物理性质
a.无色有特殊气味的晶体,长时间放置易被氧化,呈粉红色,在水中溶解度9.3g,当温度高于65℃,能与水任意比互溶;易溶于有机溶剂。有毒,对皮肤有腐蚀性。
b.苯酚不慎沾在皮肤上,应先用酒精洗涤再用水洗涤,不可直接用热水或NaOH溶液洗涤
c.较多苯酚溶于水形成浑浊液,加热至65℃以上变澄清,再冷却又浑浊。
2.化学性质
(1)苯环弱酸性
(2)取代反应
(3)氧化反应
1苯酚→(空气)粉红色物质
2苯酚使酸性KMnO4褪色
 3
3 OH + 7O2 → 6CO2 + 3H2O
OH + 7O2 → 6CO2 + 3H2O
3.用途
杀菌,止痛。
六、醛
1.氧化反应
(1)银镜反应
CH3CHO + Ag(NH3)2OH → (加热,用于检验醛基)
注意:a.试管必须洁净;b.水浴加热,使其受热均匀;c.实验完毕后,用稀HNO3清洗试管
(2)与新制氢氧化铜反应(用于检验醛基)
CH3CHO + Cu(OH)2 + NaOH →
(3)与空气氧化 CH3CHO + O2 →
2.加成反应 CH3CHO + H2 →
七、羧酸
1.酯化反应
CH3COOH + C2H5OH →
酸脱羟基醇脱氢
八、酯
1.水解反应
CH3COOC2H5 + H2O →
CH3COOC2H5 + NaOH →
2.制取乙酸乙酯
注意事项:a.浓硫酸作催化剂和脱水剂
b.导管不可伸入液面以下,目的是为了防止倒吸
c.饱和Na2CO3溶液作用是吸收乙酸,溶解乙醇,冷凝酯蒸汽且减小酯在水中的溶解度
d.不可用NaOH溶液代替饱和Na2CO3溶液,因乙酸乙酯在NaOH存在时易水解,几乎得不到乙酸乙酯。
第二篇:高中有机化学方程式总结1
有机化学方程式总结

甲烷的燃烧:CH4+2O2 CO2+2H2O

一氯甲烷:CH4+Cl2 CH3Cl+HCl

二氯甲烷:CH3Cl+Cl2 CH2Cl2+HCl

三氯甲烷:CH2Cl2+Cl2 CHCl3+HCl(CHCl3又叫氯仿)

四氯化碳:CHCl3+Cl2 CCl4+HCl

乙烯的燃烧:H2C=CH2+3O2 2CO2+2H2O

与溴水加成:H2C=CH2+Br2 CH2Br—CH2Br

与氢气加成:H2C=CH2+H2 CH3CH3

与氯化氢加成:H2C=CH2+HCl CH3CH2Cl

与水加成:H2C=CH2+H2O CH3CH2OH


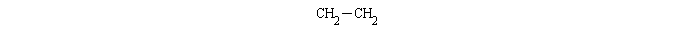 乙烯加聚:
n H
2C=CH
2 n
乙烯加聚:
n H
2C=CH
2 n

苯的燃烧:2C6H6+15O2 12CO2+6H2O
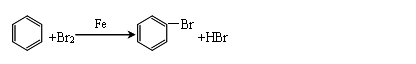
苯与溴反应:

苯的硝化反应 +HO—NO2 +H2O

苯与氢气加成
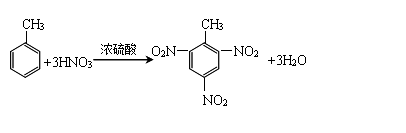
甲苯与硝酸反应制取TNT

溴乙烷的水解:C2H5—Br+ NaOH C2H5—OH+HBr

溴乙烷消去反应:CH3CH2Br+NaOH CH2=CH2↑+NaBr+H2O
 乙醇的催化氧化:2CH3CH2OH+O2 2CH3CHO+2H2O (乙醛)
乙醇的催化氧化:2CH3CH2OH+O2 2CH3CHO+2H2O (乙醛)
乙醇消去反应: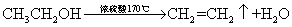

乙醇与浓硫酸在140℃时发生的反应 2C2H5OH C2H5—O—C2H5+H2O (乙醚)

苯酚与氢氧化钠

苯酚钠与盐酸的反应: + HCl +NaCl


 苯酚钠与CO2反应: +CO2+H2O +NaHCO3
苯酚钠与CO2反应: +CO2+H2O +NaHCO3
苯酚与溴水 +3Br2 ↓+3HBr
(

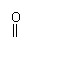 乙醛与氢气反应:CH3—C—H+H2 CH3CH2OH
乙醛与氢气反应:CH3—C—H+H2 CH3CH2OH

乙醛与氧气反应:2CH3—C—H+O2 2CH3COOH (乙酸)
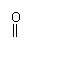
 乙醛的银镜反应:
乙醛的银镜反应:
CH3CHO +2Ag(NH3)2OH CH3COONH4+2Ag+3NH3+H2O (乙酸铵)

乙醛还原氢氧化铜:CH3CHO+2Cu(OH)2 CH3COOH+Cu2O↓+2H2O

乙醇与钠反应:2CH3CH2OH+2Na 2CH3CH2ONa+H2↑(乙醇钠)

乙酸与钠反应:CH3COOH+Na CH3COONa +H2
 乙酸与碳酸钠反应:CH3COOH+Na2CO3 CH3COONa +H2O+ CO2
乙酸与碳酸钠反应:CH3COOH+Na2CO3 CH3COONa +H2O+ CO2
乙酸与乙醇发生酯化反应
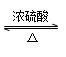 CH3—C—OH+C2H5—OH CH3—C—OC2H5+H2O (乙酸乙酯)
CH3—C—OH+C2H5—OH CH3—C—OC2H5+H2O (乙酸乙酯)
乙酸乙酯酸性条件水解反应

CH3COOC2H5+H2O CH3COOH+C2H5OH
乙酸乙酯碱性条件水解反应

CH3COOC2H5+NaOH CH3COONa+C2H5OH
