鲁科版化学必修1
一、 钠及其化合物的性质:
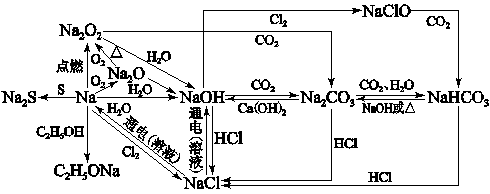
钠Na
1.钠与空气反应
①钠在空气中缓慢氧化:4Na+O2==2Na2O
②钠在空气中燃烧:2Na+O2Na2O2
2.钠与水反应
2Na+2H2O=2NaOH+H2↑ (反应物系数为2)
现象:①钠浮在水面上;②熔化为银白色小球;③在水面上四处游动;
④伴有嗞嗞响声;⑤滴有酚酞的水变红色。
过氧化钠Na2O2
1.过氧化钠与水反应:2Na2O2+2H2O=4NaOH+O2↑(反应物系数为2)
2.过氧化钠与二氧化碳反应:2Na2O2+2CO2=2Na2CO3+O2(反应物系数为2)
碳酸钠和碳酸氢钠NaHCO3和Na2CO3
1.在碳酸钠溶液中滴加稀盐酸:Na2CO3+ HCl = NaCl+NaHCO3 (先无明显现象)
NaHCO3+ HCl = NaCl+H2O+CO2↑(后产生大量气体 较快)
在盐酸中加入碳酸钠溶液:Na2CO3+ 2HCl = 2NaCl+H2O+CO2↑(产生大量气体 较慢)
2.在碳酸钠溶液中通入二氧化碳:Na2CO3+CO2+H2O=2NaHCO3
3.碳酸氢钠受热分解:2NaHCO3Na2CO3+H2O+CO2↑
4.氢氧化钠与碳酸氢钠反应:NaOH+NaHCO3=Na2CO3+H2O
二、 氯及其化合物的性质
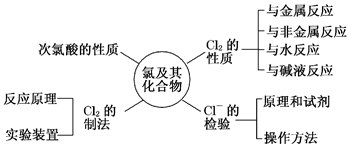
氯元素单质及其化合物间的转化关系
氯气Cl2
1.与金属单质
铁丝在氯气中燃烧:2Fe+3Cl22FeCl3 (剧烈燃烧 红棕色烟)
铜丝在氯气中燃烧:Cu+Cl2CuCl2(剧烈燃烧 棕黄色烟)
2.与非金属单质
氢气在氯气中燃烧:H2+Cl22HCl (苍白色火焰 产生白雾)
3.氯气与水的反应
Cl2+H2O=HClO+HCl
4.氯气与氢氧化钠的反应
Cl2+2NaOH=NaCl+NaClO+H2O(氯气的尾气处理)
5.制取漂白粉(氯气能通入石灰浆)
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O CaCl2和Ca(ClO)2叫漂白粉
漂白粉在空气中变质:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
三、 以物质的量为中心的物理量关系
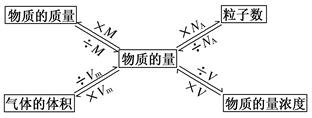
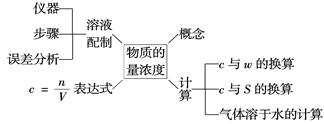
1.物理量-物质的量 单位-摩尔(mol)
①n= N/NA
N代表微粒个数 NA阿伏加德罗常数 NA≈6.02×1023 mol-1
2.物质的摩尔质量M
②n= m/M
M代表物质质量 M为摩尔质量,数值上等于该物质的相对原子质量或相对分子质量,单位g?mol-1
3.气体的摩尔体积Vm
③n=V/Vm
V为气体体积,单位是升(L) Vm是气体摩尔体积,标准状况下,1 mol气体为22.4 L
Vm温度、压强一定时为定值,Vm单位为L?mol -1
4.溶液中溶质的物质的量浓度c
④n=cV
C为溶液中溶质的物质的量浓度,单位为mol? L -1 V为溶液体积,单位是升(L)
四、 胶体:
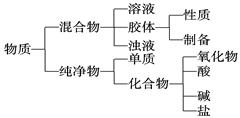
1. 定义:分散质粒子直径介于1-100nm之间的分散系。
2. 胶体性质: ① 丁达尔现象 ② 聚沉 ③ 电泳
3. 胶体提纯:渗析
五、 电解质和非电解质

1.电解质定义:
①条件:水溶液或熔融状态;②性质:能否导电;③物质类别:化合物。
2.强电解质:强酸、强碱、大多数盐;
弱电解质:弱酸、弱碱、水等。
3.离子方程式的书写:
① 写:写出化学方程式
② 拆:将易溶、易电离的物质改写成离子形式,其它以化学式形式出现。
下列情况不拆:难溶物质、难电离物质(弱酸、弱碱、水等)、氧化物、HCO3-等。
③ 删:将反应前后没有变化的离子符号删去。
④ 查:检查元素是否守恒、电荷是否守恒。
4.离子反应、离子共存问题:下列离子不能共存在同一溶液中:
① 生成难溶物质的离子:如Ba2+与SO42-;Ag+与Cl-等
② 生成气体或易挥发物质:如H+与CO32-、HCO3-、SO32-、S2-等;OH-与NH4+等。
③ 生成难电离的物质(弱电解质)
④ 发生氧化还原反应:如:MnO4-与I-;H+、NO3-与Fe2+等
六、 氧化还原反应
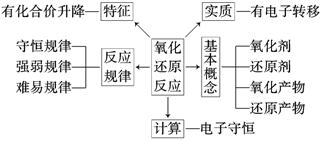
1.(某元素)降价—得电子—被还原—作氧化剂—产物为还原产物 (升、失、氧)
2.(某元素)升价—失电子—被氧化—作还原剂—产物为氧化产物 (降、得、还)
3.氧化性:氧化剂>氧化产物
还原性:还原剂>还原产物
 七、 铁及其化合物性质
七、 铁及其化合物性质
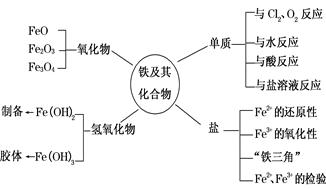
1.Fe2+及Fe3+离子的检验:
① Fe2+的检验:(浅绿色溶液)
a) 加氢氧化钠溶液,产生白色沉淀Fe(OH)2,继而变灰绿色,最后变红褐色Fe(OH)3。
b) 加KSCN溶液,不显红色,再滴加氯水,溶液显血红色。
② Fe3+的检验:(黄色溶液)
a) 加氢氧化钠溶液,产生红褐色沉淀Fe(OH)3。
b) 加KSCN溶液,溶液显血红色。
2.主要反应的化学方程式:
① 铁与盐酸的反应:Fe+2HCl=FeCl2+H2↑
② 铁与硫酸铜反应(湿法炼铜):Fe+CuSO4=FeSO4+Cu
③ 在氯化亚铁溶液中滴加氯水:(除去氯化铁中的氯化亚铁杂质)3FeCl2+Cl2=2FeCl3
④ 氢氧化亚铁在空气中变质:4 Fe(OH)2+O2+2H2O=4 Fe(OH)3
⑤ 在氯化铁溶液中加入铁粉:2FeCl3+Fe=3FeCl2
⑥ 铜与氯化铁反应(用氯化铁腐蚀铜电路板):2FeCl3+Cu=2FeCl2+CuCl2
⑦ 少量锌与氯化铁反应:Zn+2FeCl3=2FeCl2+ZnCl2
八、 氮及其化合物的性质
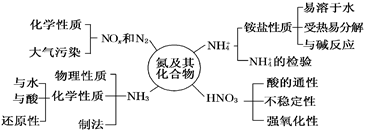
氮及其重要化合物的转化关系
1.“雷雨发庄稼”涉及反应原理:
① N2+O2放电放电2NO ② 2NO+O2=2NO2 ③ 3NO2+H2O=2HNO3+NO
2.氨的工业制法:N2+3H2 2NH3
2NH3
3.氨的实验室制法:
① 原理:2NH4Cl+Ca(OH)22NH3↑+CaCl2+2H2O
② 装置:与制O2相同
③ 收集方法:向下排空气法
④ 检验方法:
a) 用湿润的红色石蕊试纸试验,会变蓝色。
b) 用沾有浓盐酸的玻璃棒靠近瓶口,有大量白烟产生。NH3+HCl=NH4Cl
⑤ 干燥方法:可用碱石灰或氧化钙、氢氧化钠,不能用浓硫酸。
氨气
1.氨极易溶于水---氨与水的反应:NH3+H2O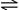 NH3?H2O
NH3?H2O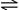 NH4++OH- (氨气极易溶于水1:700)
NH4++OH- (氨气极易溶于水1:700)
2.氨显碱性---氨气与浓盐酸反应: NH3+HCl= NH4Cl (现象:产生白烟)
3.氨的还原性---氨的催化氧化:4NH3+5O2催化剂△4NO+6H2O(制取硝酸的第一步)
铵盐
1.铵盐的不稳定性
氯化铵受热分解:NH4ClNH3↑+HCl↑
碳酸氢铵受热分解:NH4HCO3NH3↑+H2O+CO2↑
2.铵根阳离子(NH4+)的检验:
NH4++OH- NH3↑+ H2O (加入强碱并加热产生能使湿润的红色石蕊试纸变蓝色的无色气体,气体是NH3)
硝酸
1.浓硝酸的不稳定性:4HNO34NO2↑+O2↑+2H2O (浓硝酸因溶有NO2而显黄色)
2.浓硝酸的强氧化性:
①常温下,浓硫酸、浓硝酸能使铁、铝发生钝化。
②铜与浓硝酸反应:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O 浓硝14棕
铜与稀硝酸反应:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O 稀硝38无
③碳与浓硝酸反应:C+4HNO3(浓)CO2↑+4NO2↑+2H2O
九、 硫及其化合物的性质
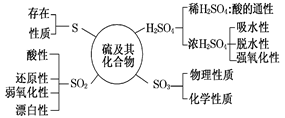
硫及其重要化合物间的转化关系
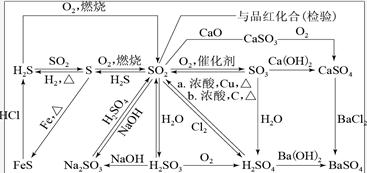
硫
1. 铁与硫蒸气反应:Fe+SFeS
铜与硫蒸气反应:2Cu+SCu2S (氧化性:Cl2> S)
2. 硫在空气中燃烧:O2+SSO2
二氧化硫
1.酸性 使紫色石蕊变红色
二氧化硫与氢氧化钠反应:SO2+2NaOH=Na2SO3+H2O
2.漂白性 使品红退色,加热后恢复原色
3.氧化性
①.二氧化硫的催化氧化:2SO2+O2催化剂△2SO3
②.二氧化硫与硫化氢反应:SO2+2H2S=3S↓+2H2O
4.还原性
3.二氧化硫与氯水的反应:SO2+Cl2+2H2O=H2SO4+2HCl
硫酸
1.浓硫酸吸水性---浓硫酸做干燥剂,不能干燥氨气(NH3)、硫化氢(H2S)等气体
2.浓硫酸脱水性---脱水炭化
3.浓硫酸的强氧化性
①.硫与浓硫酸反应:C+2H2SO4(浓)2SO2↑+CO2↑+2H2O
②.铜与浓硫酸反应:Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O
十、 镁及其化合物的性质---“国防金属”
1. 镁的燃烧
①在空气:2Mg+O22MgO 3Mg+N2Mg3N2 2Mg+CO22MgO+C
②在氯气中:Mg+Cl2MgCl2
2. 镁的置换反应
①镁和热水反应:Mg+2H2OMg(OH)2+ H2↑
②镁和盐酸反应:Mg+2HCl=MgCl2+ H2↑
3.海水中提取镁涉及反应:
① 贝壳煅烧制取熟石灰:CaCO3CaO+CO2↑ CaO+H2O=Ca(OH)2
② 产生氢氧化镁沉淀:Mg2++2OH-=Mg(OH)2↓
③ 氢氧化镁转化为氯化镁:Mg(OH)2+2HCl=MgCl2+2H2O
④ 电解熔融氯化镁:MgCl2Mg+Cl2↑
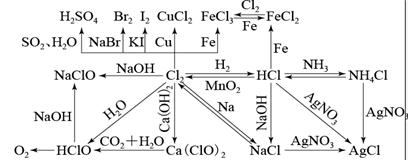
十一、 Cl-、Br-、I-离子鉴别:
1.分别滴加AgNO3和稀硝酸,产生白色沉淀的为Cl-;产生浅黄色沉淀的为Br-;产生黄色沉淀的为I-
2.分别滴加氯水,再加入少量四氯化碳,振荡,下层溶液为无色的是Cl-;下层溶液为橙红色的为Br-;下层溶液为紫红色的为I-。
3.溴Br2单质:深红棕色液体,易挥发。
碘I2单质:紫黑色固体,易升华,遇淀粉变成蓝色
4.氧化性的强弱顺序:Cl2>Br2>I2
Cl2+2NaBr=2NaCl+Br2 Cl2+2KI=2KCl+I2 Br2+2KI=2KBr+I2
Cl2能将Br-、I-置换出来生成Br2和I2 ,而Br2只能将I-置换出来生成I2 。
十二、 常见物质俗名
①苏打、纯碱:Na2CO3;②小苏打:NaHCO3;③熟石灰:Ca(OH)2;④生石灰:CaO;⑤绿矾:FeSO4?7H2O;⑥硫磺:S;⑦大理石、石灰石主要成分:CaCO3;⑧胆矾:CuSO4?5H2O;⑨石膏:CaSO4?2H2O;⑩明矾:KAl(SO4)2?12H2O 11.王水:浓硝酸:浓盐酸=1:3 混合物 ;12.国防金属:Mg ;12.海洋元素:Br 。
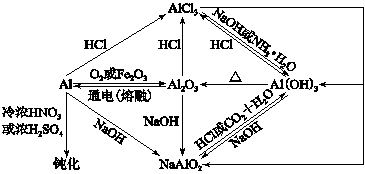
十三、 铝及其化合物的性质
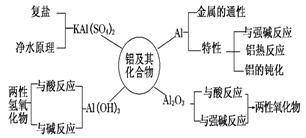
铝(Al)
1.铝与盐酸的反应:2Al+6HCl=2AlCl3+3H2↑
2.铝与强碱的反应:2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑
3.铝在空气中氧化:4Al+3O2==2Al2O3
氧化铝(Al2O3)
1.氧化铝与酸反应:Al2O3+6HCl=2AlCl3+3H2O
2.氧化铝与强碱反应:Al2O3+2NaOH+3H2O=2Na[Al(OH)4]
氧化铝(Al(OH3)
1.氢氧化铝与强酸反应:Al(OH)3+3HCl=AlCl3+3H2O
2.氢氧化铝与强碱反应:Al(OH)3+NaOH=Na[Al(OH)4]
3.实验室制取氢氧化铝沉淀:Al3++3NH3?H2O=Al(OH)3↓+3NH4+
十四、 硅及及其化合物性质
碳、硅及其重要化合物间的转化关系

1. 硅与氢氧化钠反应:Si+2NaOH+H2O=Na2SiO3+2H2↑
2. 硅与氢氟酸反应:Si+4HF=SiF4↑+H2↑
3. 二氧化硅与氢氧化钠反应:SiO2+2NaOH=Na2SiO3+H2O
4. 二氧化硅与氢氟酸反应:SiO2+4HF=SiF4↑+2H2O
5. 制造玻璃主要反应:SiO2+CaCO3CaSiO3+CO2↑
SiO2+Na2CO3Na2SiO3+CO2↑
第二篇:鲁科版高中化学必修一知识点总结
高一化学模块I主要知识及化学方程式
一、 研究物质性质的方法和程序
1. 基本方法:观察法、实验法、分类法、比较法
2. 基本程序:
第三步:用比较的方法对观察到的现象进行分析、综合、推论,概括出结论。
二、 钠及其化合物的性质:
1. 钠在空气中缓慢氧化:4Na+O2==2Na2O
2. 钠在空气中燃烧:2Na+O2点燃====Na2O2
3. 钠与水反应:2Na+2H2O=2NaOH+H2↑
现象:①钠浮在水面上;②熔化为银白色小球;③在水面上四处游动;④伴有嗞嗞响声;⑤滴有酚酞的水变红色。
4. 过氧化钠与水反应:2Na2O2+2H2O=4NaOH+O2↑
5. 过氧化钠与二氧化碳反应:2Na2O2+2CO2=2Na2CO3+O2
6. 碳酸氢钠受热分解:2NaHCO3△==Na2CO3+H2O+CO2↑
7. 氢氧化钠与碳酸氢钠反应:NaOH+NaHCO3=Na2CO3+H2O
8. 在碳酸钠溶液中通入二氧化碳:Na2CO3+CO2+H2O=2NaHCO3
三、 氯及其化合物的性质
1. 氯气与氢氧化钠的反应:Cl2+2NaOH=NaCl+NaClO+H2O
2. 铁丝在氯气中燃烧:2Fe+3Cl2点燃===2FeCl3
3. 制取漂白粉(氯气能通入石灰浆)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
4. 氯气与水的反应:Cl2+H2O=HClO+HCl
5. 次氯酸钠在空气中变质:NaClO+CO2+H2O=NaHCO3+HClO
6. 次氯酸钙在空气中变质:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
四、 以物质的量为中心的物理量关系
1. 物质的量n(mol)= N/N(A)
2. 物质的量n(mol)= m/M
3. 标准状况下气体物质的量n(mol)= V/V(m)
4. 溶液中溶质的物质的量n(mol)=cV
五、 胶体:
1. 定义:分散质粒子直径介于1~100nm之间的分散系。
2. 胶体性质:
① 丁达尔现象
② 聚沉
③ 电泳
④ 布朗运动
3. 胶体提纯:渗析
六、 电解质和非电解质
1. 定义:①条件:水溶液或熔融状态;②性质:能否导电;③物质类别:化合物。
2. 强电解质:强酸、强碱、大多数盐;弱电解质:弱酸、弱碱、水等。
3. 离子方程式的书写:
① 写:写出化学方程式
② 拆:将易溶、易电离的物质改写成离子形式,其它以化学式形式出现。
下列情况不拆:难溶物质、难电离物质(弱酸、弱碱、水等)、氧化物、HCO3-等。 ③ 删:将反应前后没有变化的离子符号删去。
④ 查:检查元素是否守恒、电荷是否守恒。
4. 离子反应、离子共存问题:下列离子不能共存在同一溶液中:
① 生成难溶物质的离子:如Ba2+与SO42-;Ag+与Cl-等
② 生成气体或易挥发物质:如H+与CO32-、HCO3-、SO32-、S2-等;OH-与NH4+等。 ③ 生成难电离的物质(弱电解质)
④ 发生氧化还原反应:如:MnO4-与I-;H+、NO3-与Fe2+等
七、 氧化还原反应
1. (某元素)降价——得到电子——被还原——作氧化剂——产物为还原产物
2. (某元素)升价——失去电子——被氧化——作还原剂——产物为氧化产物
3. 氧化性:氧化剂>氧化产物
还原性:还原剂>还原产物
八、 铁及其化合物性质
1. Fe2+及Fe3+离子的检验:
① Fe2+的检验:(浅绿色溶液)
a) 加氢氧化钠溶液,产生白色沉淀,继而变灰绿色,最后变红褐色。
b) 加KSCN溶液,不显红色,再滴加氯水,溶液显红色。
② Fe3+的检验:(黄色溶液)
a) 加氢氧化钠溶液,产生红褐色沉淀。
b) 加KSCN溶液,溶液显红色。
2. 主要反应的化学方程式:
① 铁与盐酸的反应:Fe+2HCl=FeCl2+H2↑
② 铁与硫酸铜反应(湿法炼铜):Fe+CuSO4=FeSO4+Cu
③ 在氯化亚铁溶液中滴加氯水:(除去氯化铁中的氯化亚铁杂质)3FeCl2+Cl2=2FeCl3 ④ 氢氧化亚铁在空气中变质:4Fe(OH)2+O2+2H2O=4Fe(OH)3
⑤ 在氯化铁溶液中加入铁粉:2FeCl3+Fe=3FeCl2
⑥ 铜与氯化铁反应(用氯化铁腐蚀铜电路板):2FeCl3+Cu=2FeCl2+CuCl2
⑦ 少量锌与氯化铁反应:Zn+2FeCl3=2FeCl2+ZnCl2
⑧ 足量锌与氯化铁反应:3Zn+2FeCl3=2Fe+3ZnCl2
九、 氮及其化合物的性质
1. “雷雨发庄稼”涉及反应原理:
① N2+O2放电===2NO
② 2NO+O2=2NO2
③ 3NO2+H2O=2HNO3+NO
2. 氨的工业制法:N2+3H2 2NH3
3. 氨的实验室制法:
① 原理:2NH4Cl+Ca(OH)2△==2NH3↑+CaCl2+2H2O
② 装置:与制O2相同
③ 收集方法:向下排空气法
④ 检验方法:
a) 用湿润的红色石蕊试纸试验,会变蓝色。
b) 用沾有浓盐酸的玻璃棒靠近瓶口,有大量白烟产生。NH3+HCl=NH4Cl ⑤ 干燥方法:可用碱石灰或氧化钙、氢氧化钠,不能用浓硫酸。
4. 氨与水的反应:NH3+H2O=NH3?H2O NH3?H2O NH4++OH-
5. 氨的催化氧化:4NH3+5O2 4NO+6H2O(制取硝酸的第一步)
6. 碳酸氢铵受热分解:NH4HCO3 NH3↑+H2O+CO2↑
7. 铜与浓硝酸反应:Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O
8. 铜与稀硝酸反应:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
9. 碳与浓硝酸反应:C+4HNO3=CO2↑+4NO2↑+2H2O
10. 氯化铵受热分解:NH4Cl NH3↑+HCl↑
十、 硫及其化合物的性质
1. 铁与硫蒸气反应:Fe+S△==FeS
2. 铜与硫蒸气反应:2Cu+S△==Cu2S
3. 硫与浓硫酸反应:S+2H2SO4(浓)△==3SO2↑+2H2O
4. 二氧化硫与硫化氢反应:SO2+2H2S=3S↓+2H2O
5. 铜与浓硫酸反应:Cu+2H2SO4△==CuSO4+SO2↑+2H2O
6. 二氧化硫的催化氧化:2SO2+O2 2SO3
7. 二氧化硫与氯水的反应:SO2+Cl2+2H2O=H2SO4+2HCl
8. 二氧化硫与氢氧化钠反应:SO2+2NaOH=Na2SO3+H2O
9. 硫化氢在充足的氧气中燃烧:2H2S+3O2点燃===2SO2+2H2O
10. 硫化氢在不充足的氧气中燃烧:2H2S+O2点燃===2S+2H2O
十一、 镁及其化合物的性质
1. 在空气中点燃镁条:2Mg+O2点燃===2MgO
2. 在氮气中点燃镁条:3Mg+N2点燃===Mg3N2
3. 在二氧化碳中点燃镁条:2Mg+CO2点燃===2MgO+C
4. 在氯气中点燃镁条:Mg+Cl2点燃===MgCl2
5. 海水中提取镁涉及反应:
① 贝壳煅烧制取熟石灰:CaCO3高温===CaO+CO2↑ CaO+H2O=Ca(OH)2 ② 产生氢氧化镁沉淀:Mg2++2OH-=Mg(OH)2↓
③ 氢氧化镁转化为氯化镁:Mg(OH)2+2HCl=MgCl2+2H2O
④ 电解熔融氯化镁:MgCl2通电===Mg+Cl2↑
十二、 Cl-、Br-、I-离子鉴别:
1. 分别滴加AgNO3和稀硝酸,产生白色沉淀的为Cl-;产生浅黄色沉淀的为Br-;产生黄色沉淀的为I-
2. 分别滴加氯水,再加入少量四氯化碳,振荡,下层溶液为无色的是Cl-;下层溶液为橙红色的为Br-;下层溶液为紫红色的为I-。
十三、 常见物质俗名
①苏打、纯碱:Na2CO3;②小苏打:NaHCO3;③熟石灰:Ca(OH)2;④生石灰:CaO;⑤绿矾:FeSO4?7H2O;⑥硫磺:S;⑦大理石、石灰石主要成分:CaCO3;⑧胆矾:CuSO4?5H2O;⑨石膏:CaSO4?2H2O;⑩明矾:KAl(SO4)2?12H2O
十四、 铝及其化合物的性质
1. 铝与盐酸的反应:2Al+6HCl=2AlCl3+3H2↑
2. 铝与强碱的反应:2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑
3. 铝在空气中氧化:4Al+3O2==2Al2O3
4. 氧化铝与酸反应:Al2O3+6HCl=2AlCl3+3H2O
5. 氧化铝与强碱反应:Al2O3+2NaOH+3H2O=2Na[Al(OH)4]
6. 氢氧化铝与强酸反应:Al(OH)3+3HCl=AlCl3+3H2O
7. 氢氧化铝与强碱反应:Al(OH)3+NaOH=Na[Al(OH)4]
8. 实验室制取氢氧化铝沉淀:Al3++3NH3?H2O=Al(OH)3↓+3NH4+
十五、 硅及及其化合物性质
1. 硅与氢氧化钠反应:Si+2NaOH+H2O=Na2SiO3+2H2↑
2. 硅与氢氟酸反应:Si+4HF=SiF4+H2↑
3. 二氧化硅与氢氧化钠反应:SiO2+2NaOH=Na2SiO3+H2O
4. 二氧化硅与氢氟酸反应:SiO2+4HF=SiF4↑+2H2O
5. 制造玻璃主要反应:SiO2+CaCO3高温===CaSiO3+CO2↑ SiO2+Na2CO3高温===Na2SiO3+CO2↑
