初三化学酸碱盐知识点大全
在初三的化学学习之中,酸、碱、盐部分的学习可谓是重中之重,在中考中有着举足轻重的地位,但是由于此部分知识涉及到的内容既繁琐又有一定的深度,所以学生掌握起来有一定的困难,在此,我把有关这部分内容需要掌握的知识点进行一下简单的总结:
一、 有关物质颜色的记忆
在这一章中出现了许多带有颜色的物质或溶液。按照规律,可归纳如下:
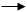
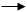
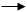
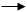
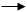 Cu CuO Cu2(OH)2CO3 CuSO4 Cu(OH)2 CuSO4溶液
Cu CuO Cu2(OH)2CO3 CuSO4 Cu(OH)2 CuSO4溶液
红色 黑色 绿色 蓝色 蓝色 蓝色
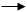
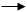
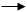
 Fe Fe2O3 Fe3O4 Fe2+溶液 Fe3+溶液 Fe(OH)3
Fe Fe2O3 Fe3O4 Fe2+溶液 Fe3+溶液 Fe(OH)3
银白色 红色 黑色 浅绿色 黄色 红褐色
二、 有关沉淀的记忆
在初三阶段,接触最多的沉淀可以总结为“六白”“一蓝”“一红褐”
“六白”CaCO3 Ag2 CO3 BaCO3 BaSO4 AgCl Mg(OH)2

可溶于稀硝酸,且产生气体 不溶于稀硝酸 可溶于稀硝酸,不产生气体
“一蓝” Cu(OH)2 “一红褐” Fe(OH)3
三、 有关一些特征离子的记忆
这些特征离子在做除杂题或鉴别题时起到了至关重要的地位。
例:若除去NaCl中混有的Na2CO3,选择加入的试剂。
思路:在些题当中就涉及到特征离子CO32-,如想除去CO32-,应首先想到H+
CO32- 可以与H+反应生成水和二氧化碳,所以可以选用稀盐酸。
 方程式表示为:Na2CO3+2HCl=2 NaCl+H2O+CO2
方程式表示为:Na2CO3+2HCl=2 NaCl+H2O+CO2
另外,CO32-还可以与Ca2+反应生成CaCO3的沉淀,所以也可以选用CaCl2溶液
 除去CO32-,方程式表示为:Na2CO3+ CaCl2= CaCO3 +2 NaCl
除去CO32-,方程式表示为:Na2CO3+ CaCl2= CaCO3 +2 NaCl
所以,在这里,把用到最多的特征离子总结如下:




 CO32- H+ Cl- Ag+ OH- Cu2+
CO32- H+ Cl- Ag+ OH- Cu2+
 Ba2+
Ba2+ 、Ca2+ SO42- Ba2+ Fe3+
、Ca2+ SO42- Ba2+ Fe3+
Mg2+
这些离子之间的互相应用,可以使很多题都得到简化。
四、 有关物质反应规律的记忆
在酸、碱、盐的学习中,我们可以总结出物质之间相互反应的八条规律:
1.  金属+酸——盐+氢气
金属+酸——盐+氢气
2. 金属+盐——新金属+新盐 置换反应
3.  酸+碱性氧化物——盐+水
酸+碱性氧化物——盐+水
4. 酸+碱——盐+水
5. 酸+盐——新酸+新盐 复分解反应
6. 碱+盐——新碱+新盐
7. 盐+盐——新盐+新盐’
8. 碱+酸性氧化物——盐+水
以上规律,对于我们有关这部分内容的学习起到了相当重要的作用,因为只有知道了物质间的反应规律,我们才能对于解题有一个清楚完整的思路。
例:用五种方法制取MgCl2。
思路:因为MgCl2在物质的分类中属于盐类,所以我们可以通过以上八条规律看一下生成盐的途径有几条,这样就能一一求解了。
 方法:1.Mg+2HCl= MgCl2+H2
方法:1.Mg+2HCl= MgCl2+H2
2.MgO+2HCl= MgCl2+H2O
 3.MgCO3+2HCl= MgCl2+H2O+ CO2
3.MgCO3+2HCl= MgCl2+H2O+ CO2
4.Mg(OH)2 +2HCl= MgCl2+2H2O
 5.Mg SO4+Ba Cl2= BaSO4 +2HCl
5.Mg SO4+Ba Cl2= BaSO4 +2HCl
五、 有关置换反应,复分解反应条件的记忆
在第四点中总结出的规律中,并不是简单的就能进行,往往是需要一定的条件。这里,把需要掌握的条件进行说明。
1.置换反应:
a. 金属+酸——盐+氢气
条件:1.金属必须为氢前金属
2.酸通常为稀盐酸或稀硫酸。硝酸和浓硫酸不能产生氢气。
b. 金属+盐——新金属+新盐
条件:1.只有在活动性顺序表中排在前面的金属才能置换后面的金属。
2.盐必须是可溶于水的盐溶液。
3.K、Ca、Na通常不用在这样的置换反应中。
c. 酸+盐——新酸+新盐
条件:生成物中必须有沉淀、气体、水三者之一生成。
d. 碱+盐——新碱+新盐 盐+盐——新盐+新盐’
条件:1.反应物都溶于水
2.生成物中有沉淀、气体、水三者之一生成。
以上总结出的条件可以明确的判断出各物质之间是否能发生反应,从而进一步成为牢固掌握酸、碱、盐中各物质之间联系的基础。
六.有关物质水溶性的记忆
物质是否溶于水,这在些部分学习中可以说是最基础的问题了,但有关酸、碱、盐知识中涉及到的物质很多,让学生一个个物质去背去记恐怕很难达到。所以在这里对于酸、碱、盐的水溶性有一个口诀可以让学生加强记忆。口诀内容为:
钾、钠、硝酸溶;铵盐也相同;
钾、钠、钙、钡、氨;溶碱有五种;
硫酸除铅、钡;氯除银、亚汞;
碳酸和磷酸;钾、钠、铵才溶。
通过口诀,学生就能很快把这些物质的水溶性熟记于心了。
以上的内容是对于酸、碱、盐有关知识的一个简单总结,在这里与大家进行交流,希望会对初三有关这部分内容的学习有所帮助。
第二篇:初三化学《酸碱盐》知识点总结
初三化学《酸-碱-盐》知识点总结
一、酸、碱、盐的组成
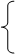 酸是由氢元素和酸根组成的化合物 如:硫酸(H2SO4)、盐酸(HCl)、硝酸(HNO3)
酸是由氢元素和酸根组成的化合物 如:硫酸(H2SO4)、盐酸(HCl)、硝酸(HNO3)
碱是由金属元素和氢氧根组成的化合物 如:氢氧化钠、氢氧化钙、氨水(NH3·H2O)
盐是由金属元素元素(或铵根)和酸根组成的化合物 如:氯化钠、碳酸钠
酸、碱、盐的水溶液可以导电(原因:溶于水时离解形成自由移动的阴、阳离子)
二、酸
1、浓盐酸、浓硫酸的物理性质、特性、用途
2、酸的通性(具有通性的原因:酸离解时所生成的阳离子全部是H+)
(1)与酸碱指示剂的反应: 使紫色石蕊试液变红色,不能使无色酚酞试液变色
(2)金属 + 酸 → 盐 + 氢气
(3)碱性氧化物 + 酸 → 盐 + 水
(4)碱 + 酸 → 盐 + 水
(5)盐 + 酸 → 另一种盐 + 另一种酸(产物符合复分解条件)
3、离子的检验

三、碱
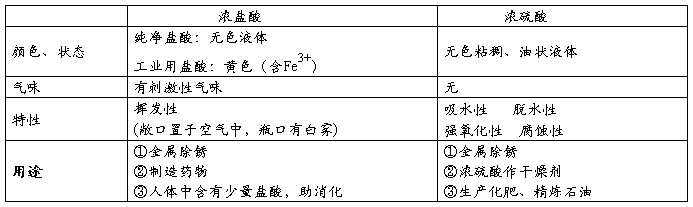
1、氢氧化钠、氢氧化钙的物理性质、用途
2、碱的通性(具有通性的原因:离解时所生成的阴离子全部是OH-)
(1)碱溶液与酸碱指示剂的反应: 使紫色石蕊试液变蓝色,使无色酚酞试液变红色
(2)酸性氧化物+碱 → 盐+水
(3)酸+碱 → 盐+水
(4)盐+碱 → 另一种盐+另一种碱(反应物均可溶,产物符合复分解条件)
注:①难溶性碱受热易分解(不属于碱的通性)
如Cu(OH)2 ΔCuO +H2O
2Fe(OH)3 ΔFe2O3+3H2O
②常见沉淀:AgCl↓ BaSO4↓ Cu(OH)2↓ F e(OH)3↓ Mg(OH)2↓ BaCO3↓ CaCO3↓
③复分解反应的条件:当两种化合物互相交换成分,生成物中有沉淀或有气体或有水生成时,复分解反应才可以发生。
五、酸性氧化物与碱性氧化物

四、中和反应 溶液酸碱度的表示法——pH
1、定义:酸与碱作用生成盐和水的反应
2、应用:
(1)改变土壤的酸碱性
(2)处理工厂的废水
(3)用于医药
3、溶液酸碱度的表示法——pH
(1)0 7 14

酸性增强 中性 碱性增强
(2)pH的测定:最简单的方法是使用pH试纸
用玻璃棒(或滴管)蘸取待测试液少许,滴在pH试纸上,显色后与标准比色卡对照,读出溶液的pH(读数为整数)
(3)酸雨:正常雨水的pH约为5.6(因为溶有CO2)
pH<5.6的雨水为酸雨
第十一单元 《盐 化肥》知识点
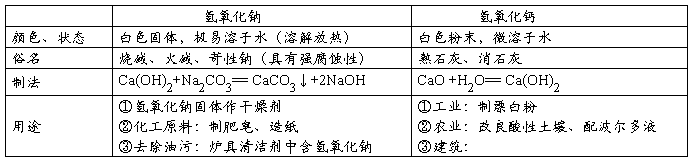
一、常见的盐 定义:能解离出金属离子(或NH4+)和酸根离子的化合物
二、粗盐提纯——去除不溶性杂质,得到的精盐中还含有氯化镁、氯化钙等可溶性杂质。
1、实验步骤:溶解、过滤、蒸发
2、实验仪器

三、盐的化学性质
1、盐(可溶)+ 金属1 → 金属2 + 新盐(金属1比金属2活泼,K、Ca、Na除外)
2、盐 + 酸 → 新盐 + 新酸
3、盐 + 碱 → 新盐 + 新碱(反应物需都可溶,且满足复分解反应的条件)
4、盐 + 盐 → 两种新盐(反应物需都可溶,且满足复分解反应的条件)
四、酸、碱、盐的溶解性
1、酸:大多数都可溶(除硅酸H2SiO3不溶)
2、碱:只有氨水、氢氧化钠、氢氧化钾、氢氧化钡和氢氧化钙可溶于水,其余均为沉淀
3、盐:钾盐、钠盐、铵盐、硝酸盐都可溶;
氯化物除AgCl难溶外,其余多数均可溶;
硫酸盐除BaSO4难溶,Ag2SO4、CaSO4微溶外,其余多数可溶;
碳酸盐除碳酸钾、碳酸钠、碳酸铵可溶,其余都难溶。
注:BaSO4、、AgCl 不溶于水,也不溶于酸
五、化学肥料
1、
农家肥料:营养元素含量少,肥效慢而持久、价廉、能改良土壤结构
2、化学肥料 (氮肥、钾肥、磷肥)
(
1)氮肥 作用:促进植物茎、叶生长茂盛、叶色浓绿(促苗)。 缺氮:叶黄
a、常用氮肥
尿素CO(NH2)2:含氮量最高的氮肥(有机物)46.7%

b、NH4+的检验
试剂:碱(NaOH、Ca(OH)2等)、湿润的红色石蕊试纸
NH4NO3 + NaOH=NaNO3 +NH3 ↑+H2O
c、生物固氮:豆科植物的根瘤菌将氮气转化为含氮的化合物而吸收
(2)钾肥 作用:促使作物生长健壮、茎杆粗硬,抗倒伏(壮秆)。 缺钾:叶尖发黄
 常用钾肥 KCl
常用钾肥 KCl
草木灰:农村最常用钾肥(主要成分为K2CO3), 呈碱性
K2SO4:长期使用会使土壤酸化、板结
(3)磷肥 作用:促进植物根系发达,穗粒增多,饱满(催果)
缺磷:生长迟缓,产量降低,根系不发达
 常用磷肥 磷矿粉 Ca3(PO4)2
常用磷肥 磷矿粉 Ca3(PO4)2
钙镁磷肥(钙和镁的磷酸盐)
过磷酸钙 Ca(H2PO4)2和CaSO4 不能与碱性物质混合施用。
重过磷酸钙 Ca(H2PO4)2 如草木灰、熟石灰
4、复合肥:含N、P、K中的两种或三种
KNO3 NH4H2PO4 (NH4)2HPO4 不能与碱性物质混合施用
三、使用化肥、农药对环境的影响
1、土壤污染:重金属元素、有毒有机物、放射性物质
2、大气污染:N20、 NH3 、 H2S
3、引起水体污染 :N、P过多,导致水体富营养化,赤潮、水华等现象
四、合理使用化肥
1、
根据土壤情况和农作物种类选择化肥 2、农家肥和化肥合理配用
1、
五、氮、磷、钾三种化肥的区别方法

