第二周周末作业
第二周周末作业
班级 姓名 编写:黄蒲生
1.化学与人类生活、社会可持续发展密切相关。下列措施有利于节能减排、保护环境的是( )
①加快化石燃料的开采与使用; ②研发易降解的生物农药;③应用高效洁净的能源转化技术;④田间焚烧秸秆;⑤推广使用节能环保材料。
A.①③⑤ B.②③⑤ C.①②④ D.②④⑤
2、下列说法正确的是 ( )
A.需要加热的化学反应都是吸热反应 B.中和反应都是放热反应
C.原电池是将电能转化为化学能的一种装置 D.水力发电是将化学能转化为电能的过程
3、下列与化学反应能量变化相关的叙述中正确的是 ( )
A.已知CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-802 kJ/mol,甲烷的燃烧热为802 kJ/mol
B.等量H2在O2中完全燃烧,生成H2O(g)比生成H2O(l)放出的热量多
C.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同
D.由石墨比金刚石稳定可知:C(金刚石, s)=C(石墨, s) ΔH<0
4、下列说法正确的是 ( )
A.某反应的生成物的总焓大于反应物的总焓时,反应吸热,ΔH>0
B.化学反应过程中,发生物质变化的同时不一定发生能量变化
C.SO2能溶于水,所得溶液能导电,所以SO2是电解质
D.计算某反应的反应热可用生成物的键能总和减去反应物的键能总和
5、下列有关热化学方程式的叙述中,正确的是 ( )
A.含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则表示该反应中和热的热
化学方程式为 NaOH(aq)+HCl(aq) = NaCl(aq)+H2O(l) ΔH=+57.4 kJ/mol
B.已知C(石墨,s) = C(金刚石,s) ΔH>0,则金刚石比石墨稳定
C.已知2H2(g)+O2(g) =2H2O(g) ΔH=-483.6 kJ/mol,则H2燃烧热为241.8 kJ/mol
D.已知2C(s)+2O2(g) ==2CO2(g) ΔH1,;2C(s)+O2(g) = 2CO(g) ΔH2;则ΔH1<ΔH2
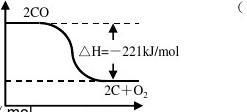
6已知:2CO(g)+O2(g)=2CO2(g) ΔH = —566 kJ/mol
Na2O2(s)+CO2(g) = Na2CO3(s)+1/2 O2(g) ΔH=—226 kJ/mol
根据以上热化学方程式判断,下列说法正确的是 ( )
A.CO的燃烧热为283 kJ
B.上图可表示由CO生成CO2的反应过程和能量关系
C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) H>-452 kJ/mol
D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
7、已知反应:①101kPa时,2C(s) +O2(g)==2CO(g);ΔH=-221 kJ/mol
②稀溶液中,H+(aq)+OHˉ(aq)==H2O(l);ΔH=-57.3 kJ/mol。下列结论正确的是 ( )
A.碳的燃烧热小于110.5 kJ/mol
B.①的反应热为221 kJ/mol
第1页
第二周周末作业
C.稀硫酸与稀NaOH溶液反应的中和热为-57.3 kJ/mol
D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出的热量小于57.3 kJ
8、已知反应:① 2C(s)+O2(g)=2CO(g) ΔH=-221 kJ/mol
② 稀溶液中,H(aq)+OH(aq)=H2O(l) ΔH=-57.3 kJ/mol
下列结论正确的是


)
+-
A.碳的燃烧热大于110.5 kJ/mol
B.右图可表示①的反应过程和能量关系
C.稀硫酸与稀NaOH溶液反应的中和热为57.3 kJD.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ 的热量
9、甲醇是新型的汽车动力燃料。工业上可通过H2和CO化合制备甲醇,该反应的热化学方程式为: 2H2(g)+CO(g)CH3OH(g) ? 1??116kJ?mol?1H
1?1(1)已知:CO(g)?O2(g)?CO2(g) ?H2??283kJ?mol 2
H2(g)?1O2(g)?H2O(g) ?H3??242kJ?mo1?1 2
1 mol甲醇燃烧生成CO2和水蒸气放出 kJ的热量。
10、工业上可用下列两种反应制备甲醇:
CO(g) + 2H2(g)
CO2(g) + 3H2(g) CH3OH(g) ΔH1 CH3OH(g) + H2O(g) ΔH2
已知:2H2(g)+ O2(g) = 2H2O(g) ΔH3 。
则2CO(g)+O2(g) = 2CO2(g) 的反应热
ΔH=ΔH1、ΔH2、ΔH3表示)。
11、现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)= 2Fe(s)+3CO2(g) △H1= ―24.8kJ/mol 3Fe2O3(s)+ CO(g)=2Fe3O4(s)+ CO2(g) △H2= ―47.2kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H3= +640.5kJ/mol
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:
12、NO2和CO反应生成CO2和NO过程中能量变化示意图,
请写出NO2和CO反应的热化学方程式:
。
在反应体系中加入催化剂,E1和E2的变化是:
E1_________,E2________(填“增大”、“减小”或“不变”),
对反应热是否有影响?_______________,
第2页
第二篇:人教版化学选修4课后强化作业-3-3-2
第三章 第三节 第二课时

一、选择题(每小题有1个或2个选项符合题意)
---
1.在0.1 mol·L1Na2CO3溶液中,欲使CO2L1,则应向溶液3的浓度尽量接近0.1 mol·中加
( )
A.HCl B.Na2CO3 C.NaCl D.KOH
----
【解析】 在Na2CO3溶液中存在水解:CO2HCO3+OH、HCO3+3+H2
O
--2-
H2OH2CO3+OH;向溶液中加入KOH可以抑制CO23的水解,使CO3的浓度尽量接
-
近0.1 mol·L1
【答案】 D
+
2.为了除去MgCl2酸性溶液中的Fe3,可在加热搅拌的条件下加入一种试剂,过滤后,再加入适量的HCl,这种试剂是
( )
A.NH3·H2O B.NaOH C.Na2CO3 D.MgCO3
【解析】 物质除杂的原则是:被除杂的物质尽量不要减少,不得引入新的杂质,并且
++
易于分离复原。加入NH3·H2O或NaOH或Na2CO3时,均能引入杂质离子NH4或Na,不
+++
符合题意。因为原溶液中Fe3水解:Fe3+3H2OFe(OH)3+3H,当加入MgCO3后,有
+++
MgCO3+3H=Mg2+CO2↑+H2O反应,消耗了H,使平衡向右移动,生成的Fe(OH)3
+
在加热搅拌条件下发生聚沉,最后可将Fe3除去。加入MgO、Mg(OH)2、MgS也能达到同样的效果。
【答案】 D
3.在CH3COONa溶液中各离子的浓度由大到小排列顺序正确的是
( )
+--+
A.c(Na)>c(CH3COO)>c(OH)>c(H)
-+-+
B.c(CH3COO)>c(Na)>c(OH)>c(H)
+-+-
C.c(Na)>c(CH3COO)>c(H)>c(OH)
+--+
D.c(Na)>c(OH)>c(CH3COO)>c(H)
-+-
【解析】 在CH3COONa溶液中由于CH3COO的水解,使得c(Na)>c(CH3COO);
-+
并且由于水解,使溶液显碱性,故c(OH)>c(H);由于盐的水解程度比较小,所以c(CH3COO--
)>c(OH),即A项正确。 【答案】 A
++-
4.在FeCl3和Fe2(SO4)3的混合溶液中,若不计Fe3的水解,当溶液中c(Fe3)=c(SO24)时,下列判断正确的是
( )
-3+
A.c(Fe)>c(CI)
--
B.c(SO24)>c(Cl)
--
C.c(SO24)<c(Cl)
D.FeCl3和Fe2(SO4)3的物质的量相等
+--3+
【解析】 根据溶液中电荷守恒可得:3c(Fe3)=2c(SO24)+c(Cl);由于c(Fe)=---2-3+2-
c(SO24),代入得c(SO4)=c(Fe)=c(Cl),故A、B、C项错;根据c(SO4)=c(Cl),可得FeCl3和Fe2(SO4)3的物质的量相等,故D项正确。
【答案】 D
--
5.把0.02 mol·L1CH3COOH溶液与0.01 mol·L1NaOH溶液等体积混合,则混合液中
微粒浓度关系正确的是
( )
A.c(CH3COO)>c(Na)
-B.c(CH3COOH)>c(CH3COO)
+-C.2c(H)=c(CH3COO)-c(CH3COOH)
--D.c(CH3COOH)+c(CH3COO)=0.01 mol·L1
【解析】 CH3COOH溶液与NaOH溶液混合后,发生反应:CH3COOH+NaOH=CH3COONa+H2O,并且生成的CH3COONa和剩余的CH3COOH浓度相等。若不考虑
-+-CH3COOH的电离和CH3COO的水解,则c(CH3COOH)=c(Na)=c(CH3COO),但由于
--+CH3COOH的电离程度大于CH3COO的水解程度,所以c(CH3COO)>c(Na)>c(CH3COOH),
即A项正确。根据碳原子守恒,可知D项正确。
【答案】 AD
-6.草酸是二元弱酸,草酸氢钾溶液呈酸性。在0.1 mol·L1KHC2O4溶液中,下列关系
正确的是
( )
++--2-A.c(K)+c(H)=c(HC2O4)+c(OH)+c(C2O4)
---B.c(HC2O4)+c(C2O2L1 4)=0.1 mol·
-C.c(C2O24)>c(H2C2O4)
+--D.c(K)=c(H2C2O4)+c(HC2O4)+c(C2O24)
-+--【解析】 在KHC2O4溶液中存在两个平衡:HC2O4H+C2O2HC2O44(电离平衡)、
-++--+H2OH2C2O4+OH(水解平衡)。电荷守恒关系式为c(K)+c(H)=c(HC2O4)+c(OH)
-+--+2c(C2O2因此A错误;物料守恒关系式为c(K)=c(H2C2O4)+c(HC2O4)+c(C2O24),4)=0.1 -mol·L1,因此B错误、D正确;溶液呈酸性说明电离程度比水解程度大,因此C正确。
【答案】 CD
7.要求设计实验证明:某种盐的水解是吸热的。有四位同学分别设计如下方案,其中不正确的是
( )
A.甲同学:将硝酸铵晶体溶于水,若水温下降,说明硝酸铵水解是吸热的
++B.乙同学:用加热的方法可除去KNO3溶液中混有的Fe3,说明含Fe3的盐水解是吸
热的
C.丙同学:通过实验发现同浓度的热的纯碱溶液比冷的纯碱溶液去油污效果好,说明碳酸钠水解是吸热的
D.丁同学:在醋酸钠溶液中滴入酚酞试液,加热(不考虑水蒸气)后若红色加深,说明醋酸钠水解是吸热的
【解析】 本题考查设计实验能力。验证盐类水解是吸热的,必须利用水解平衡移动原理,而不能根据盐溶液酸碱性判断。A项,硝酸铵溶于水,温度下降,说明反应物能量低,产物能量高,但不能证明硝酸铵水解是吸热或放热。B项,硝酸钾不水解,铁盐能水解,将
+铁离子转化成氢氧化铁,Fe3+3H2OFe(OH)3+3HCl,加热能除去,说明加热水解平衡
向生成氢氧化铁的方向移动,根据平衡移动原理,能证明铁盐水解的正反应是吸热的。C项,
--2-油污在碱中溶解转化成可溶物而除去,碱性越强越易除去。CO3+H2OHCO3+OH,
热纯碱溶液碱性强些,说明碱酸钠溶液受热水解程度大,证明水解的正反应是吸热反应。D项,盐溶液中加入酚酞试液,溶液红色深浅能说明溶液碱性强弱。醋酸钠溶液中加酚酞试液,CH3COONa+H2OCH3COOH+NaOH,加热溶液红色加深,说明碱性增强。证明了平衡向生成氢氧化钠方向移动,水解正反应是吸热的。
【答案】 A
-+8.某酸式盐NaHY的水溶液c(OH)>c(H),下列叙述正确的是
( )
+2-A.H2Y的电离方程式:H2Y2H+Y
--+-B.HY的水解方程式:HY+H2OH3O+Y2
+--+C.该酸式盐溶液中离子浓度关系:c(Na)>c(HY)>c(OH)>c(H)
+---+D.该酸式盐溶液中离子浓度关系:c(Na)>c(Y2)>c(HY)>c(OH)>c(H) -+
【解析】 H2Y是弱酸,分步电离,所以A项一步电离是错误的;依题意,它的酸式
---钠盐溶液呈碱性,说明HY以水解为主,HY+H2OH2Y+OH,B项不正确;溶液中
+---+--存在:NaHY=Na+HY,HY+H2OH2Y+OH,c(Na)>c(HY)>c(OH)>c(H2Y)>c(H
+-+),C项正确;D项,根据HY水解程度大于电离程度,离子浓度大小有:c(Na)>c(HY--)>c(H2Y)>c(Y2)。
【答案】 C
9.关于小苏打水溶液的表述正确的是
( )
+-2-A.c(Na)=c(HCO3)+c(CO3)+c(H2CO3)
++---B.c(Na)+c(H)=c(HCO3)+c(CO23)+c(OH)
--C.HCO3的电离程度大于HCO3的水解程度
+--+-+-D.存在的电离有:NaHCO3=Na+HCO3,HCO3H+CO2H+OH 3,H2O
【解析】 小苏打即NaHCO3,其溶液中各离子存在着以下几种关系:
++---①电荷守恒:c(Na)+c(H)=c(OH)+c(HCO3)+2c(CO23);
+--②物料守恒:c(Na)=c(H2CO3)+c(HCO3)+c(CO23);
+--③由上述两式衍生的第三式即c(H)=c(CO23)-c(H2CO3)+c(OH),所以A正确,B
错误,由溶液显碱性知其水解大于电离,C错;D正确。
【答案】 AD
++10.在一定浓度的FeCl3溶液中,存在如下水解平衡:Fe3+3H2OFe(OH)3+3H,
在此溶液中滴入饱和的FeCl3溶液,下列哪个变化的说法正确
( )
A.水解平衡向正反应方向移动
B.水解平衡向逆反应方向移动
+C.溶液中H浓度增大
+D.Fe3的水解程度增大
+【解析】 滴入饱和的FeCl3溶液,则溶液中c(Fe3),增大,使平衡向右移动,溶液中
n(FeCl,已水解)+c(H)增大;但FeCl3,由于FeCl3的增n(FeCl3,总)
多,使水解程度减小。
【答案】 AC
11.相同温度下,等物质的量浓度的下列溶液:a.(NH4)2SO4;b.(NH4)2CO3;
+c.(NH4)2Fe(SO4)2中c(NH4)大小判断正确的是
( )
A.a=b=c B.a>b>c
C.a>c>b D.c>a>b
【解析】 本题考查根据水解平衡原理判断离子浓度大小。三种溶液中存在共同离子++++---NH4的水解:NH4+H2ONH3·H2O+H,c(NH4)相等;CO2CO2HCO33水解:3+H2O
-+++++OH,Fe2水解:Fe2+2H2OFe(OH)2+2H,所以,c中亚铁离子水解抑制了NH4水
--++解,而b中CO23水解产生OH,中和H促进NH4水解。
【答案】 D
12.(2008·全国高考Ⅰ卷)已知乙酸(HA)的酸性比甲酸(HB)弱,在物质的量浓度均为0.1 -1mol·L的NaA和NaB混合溶液中,下列排序正确的是
( )
-+A.c(OH)>c(HA)>c(HB)>c(H)
---+B.c(OH)>c(A)>c(B)>c(H)
---+C.c(OH)>c(B)>c(A)>c(H)
-+D.c(OH)>c(HB)>c(HA)>c(H)
【解析】 根据“越弱越水解”的原则,NaA的水解比NaB水解程度大,所以溶液中
---+的c(HA)>c(HB),c(A)<c(B);再根据“谁强显谁性”可知溶液中的c(OH)>c(H);由于
---溶液中离子的水解毕竟是微弱的,所以c(OH)<c(A)和c(B)。
【答案】 A
13.在25 mL 0.1 mol·L1NaOH溶液中逐滴加入0.2 mol·L
有关粒子浓度关系比较正确的是 --1醋酸溶液,曲线如下图所示,
(
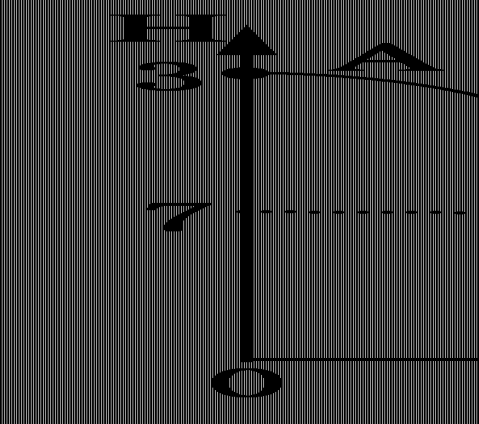
)
--+A.在A、B间任一点,溶液中一定都有c(Na)>c(CH3COO)>c(OH)>c(H)
+--+B.在B点,a>12.5,且有c(Na)=c(CH3COO)=c(OH)=c(H)
-++-C.在C点,c(CH3COO)>c(Na)>c(H)>c(OH)
-+D.在D点,c(CH3COO)+c(CH3COOH)=2C(Na)
【解析】 对于选项A,找一个特殊点,当NaOH溶液中只滴入少量醋酸时,碱远远
+--+过量,溶液中只有少量的CH3COONa,因此有关系式c(Na)>c(OH)>c(CH3COO)>c(H),
+选项A错。对于选项B,在B点时,溶液的pH恰好为7,则根据电荷守恒应有:c(Na)=
--+c(CH3COO)>c(OH)=c(H),选项B也错。
【答案】 CD
14.为了同时对某农作物施用分别含有N、P、K三种元素的化肥,对于给定的化肥:①K2CO3、②KCl、③Ca(H2PO4)2、④(NH4)2SO4、⑤氨水,最适合的组合是
( )
A.①③④ B.②③④
C.①③⑤ D.②③⑤
---+【解析】 K2CO3水解呈碱性:CO2HCO3+OH,铵态氮肥中的NH4遇3+H2O
-+---OH逸出NH3使氮元素损失,造成肥效降低:NH4+OH=NH3↑+H2O;OH与H2PO4作
--2+用生成的PO34与Ca反应生成Ca3(PO4)2沉淀,不能被作物吸收;氨水电离出的OH也会
发生上述反应生成不溶性Ca3(PO4)2。
【答案】 B
15.恒温条件下,在CH3COONa稀溶液中分别加入少量下列物质:①固体NaOH;②
-固体KOH;③固体NaHSO4;④固体CH3COONa;⑤冰醋酸。其中一定可使c(CH3COO)/c(Na
+)比值增大的是
( )
A.①② B.②⑤ C.①⑤ D.②④⑤
【答案】 B
16.有①Na2CO3溶液;②CH3COONa溶液;③NaOH溶液各25 mL,物质的量浓度均
-为0.1 mol·L1,下列说法正确的是
( )
A.3种溶液pH的大小顺序是③>②>①
B.若将3种溶液稀释相同倍数,pH变化最大的是②
-C.若分别加入25 mL 0.1 mol·L1盐酸后,pH最大的是①
D.若3种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>②
【答案】 C
+-17.(2008·豫南七校高二检测)能使电离平衡H2OH+OH向右移动,且使溶液呈
酸性的是
( )
A.向水中加入少量硫酸氢钠固体
B.向水中加入少量硫酸铝固体
C.向水中加入少量碳酸钠固体
D.将水加热到100℃,使水的pH=6
【答案】 B
18.(2008·潍坊高二检测)正常人胃液的pH在0.3~1.2之间,胃酸(一般以盐酸表示)多+
了需要治疗。某些用以治疗胃酸过多的药物中含MgCO3、NaHCO3,也有用酒石酸钠来治疗的。这说明
( )
A.碳酸、酒石酸都不是强酸
B.对人而言,酒石酸是营养品
C.MgCO3、NaHCO3与胃酸作用产生CO2,在服药后有喝汽水的舒服感
D.酒石酸钠水解显酸性
【答案】 A
19.下列关于FeCl3水解的说法错误的是
( )
A.水解达到平衡时(不饱和),加氯化铁达饱和溶液,溶液的酸性会增强
+B.浓度为5 mol/L和0.5 mol/L的两种FeCl3溶液,其他条件相同时,Fe3的水解程度
前者比后者小
+C.有50℃和20℃的同浓度的两种FeCl3稀溶液,其他条件相同时,Fe3的水解程度前
者比后者小
+D.为抑制Fe3的水解,较好地保存FeCl3溶液,应加少量盐酸
【答案】 C
-20.将物质的量浓度都是0.1 mol·L1的某弱酸HX溶液与NaX溶液等体积混合,下列
说法错误的是
( )
+--A.若混合后溶液中c(Na)>c(X),说明HX的电离程度弱于X的水解程度
-++-B.若混合溶液呈酸性,则c(X)>c(Na)>c(HX)>c(H)>c(OH)
--C.混合溶液中c(HX)+c(X)=0.2 mol·L1
++-D.混合溶液中c(HX)+c(H)=c(Na)+c(OH)
+-+-【解析】 A项若混合溶液中c(Na)>c(X),由电荷守恒知c(H)<c(OH),所以HX
--电离程度弱于X的水解程度;B项若混合溶液呈酸性,说明HX电离程度大于X水解程度,
-++--所以c(X)>c(Na)>c(HX),溶液呈酸性c(H)>c(OH)且HX电离程度与X水解程度都很弱,+---所以c(H)、c(OH)都很小。C项忽略了溶液体积的变化,c(HX)+c(X)=0.1 mol·L1。D
++---项由电荷守恒关系式:c(H)+c(Na)=c(OH)+c(X)和物料守恒关系式c(HX)+c(X)=
+2c(Na)推出D项正确。
【答案】 C
二、非选择题
21.(2009·许昌高二检测)现有下列溶液:①20 mL 0.1 mol/LH2SO4溶液;②40 mL 0.1 mol/L CH3COOH溶液;③40 mL 0.1 mol/L HCl溶液;④40 mL 0.1 mol/L NaOH溶液;⑤20 mL 0.1 mol/L Ba(OH)2溶液,其中:
+(1)c(H)最小的是__________________。
(2)任取2份溶液混合,混合溶液的pH为7(或接近7),有__________种取法。
(3)②④混合后,溶液的pH__________7(填“大于”、“小于”或“等于”)。
(4)混合后出现白色沉淀的两种溶液是__________。
【答案】 (1)⑤ (2)4 (3)大于 (4)①⑤
22.pH=2的某酸HnA(A为酸根)与pH=12的某碱B(OH)m等体积混合,混合液的pH变为6。
(1)写出生成的正盐的分子式:__________。
(2)该盐中存在着一定水解的离子,该离子的水解方程式为____________。
(3)简述该混合液呈酸性的原因:__________________。
【解析】
+-(1)正盐即酸中的H与碱中的OH完全反应生成的盐,A显-n价,B显+m价,所以
正盐为BnAm。
(2)若为强酸强碱,两者恰好反应生成的盐不水解,溶液呈中性,不符合;若为弱碱强酸,则等体积混合时,碱过量较多,混合液应呈碱性,不符合,所以应为弱酸强碱混合,--An水解,注意An分步水解,可只写第一步:
An+H2OHA(n-1)+OH。
+(3)弱酸过量,电离出H
【答案】 (1)BnAm
---(2)An+H2OHA(n-1)+OH
+(3)过量的弱酸进一步电离出H
23.(2009·豫南七校高二检测)(1)常温下,有A、B、C、D四种无色溶液,它们分别是CH3COONa溶液、NH4Cl溶液,盐酸和NaNO3溶液中的一种。已知A、B的水溶液中水的电离程度相同,A、C溶液的pH值相同。
则:①B是__________溶液,C是__________。
-+②常温下若B溶液中c(OH)与C溶液中的c(H)相同,B溶液的pH用PHb表示,C溶
液的pH用pHc表示,则pHb+pHc=__________(填某个数)。
-++-(2)已知某溶液中只存在OH、H、NH4、Cl四种离子,某同学推测其离子浓度大小
顺序有以下几种
-++-①c(Cl)>c(NH4)>c(H)>c(OH)
-+-+②c(Cl)>c(NH4)>c(OH)>c(H)
+--+③c(NH4)>c(Cl)>c(OH)>c(H)
-++-④c(Cl)>c(H)>c(NH4)>c(OH)
则:
(Ⅰ)上述关系一定不正确的是__________(填序号)。
(Ⅱ)若溶液中只有一种溶质,则该溶液中离子浓度的大小关系为__________________(填序号)。
+-(Ⅲ)若四种离子浓度关系有c(NH4)=c(Cl),则该溶液显__________(填“酸性”、“碱
性”或“中性”)。
【解析】 (1)CH3COONa溶液中水的电离受到促进,溶液显碱性;NH4Cl溶液中水的电离受到促进,溶液显酸性;盐酸中水的电离受到抑制,溶液显酸性;NaNO3溶液中水的电离不受影响,溶液显中性。所以A、B、C、D分别为NH4Cl、CH3COONa、盐酸、NaNO3。
-++常温下若CH3COONa溶液中c(OH)与盐酸溶液中的c(H)相同,则有pHb=14-logc(H),
+C溶液pHc=logc(H),则pHb+pHc=14。
-++--+-+(2)溶液中只存在OH、H、NH4、Cl四种离子时,c(Cl)>c(NH4)>c(OH)>c(H)一定
不存在,因为此时溶液中正负电荷的总数不相等;若溶液中只有一种溶质,则为NH4Cl溶
-++-液,该溶液中离子浓度的大小关系为c(Cl)>c(NH4)>c(H)>c(OH);若四种离子浓度关系有
+--+c(NH4)=c(Cl),根据溶液的电中性原理,有c(OH)=c(H),则该溶液显中性。
【答案】 (1)①CH3COONa 盐酸 ②14
(2)(Ⅰ)② (Ⅱ)① (Ⅲ)中性
+--24.某二元酸(化学式用H2A表示)在水中的电离方程式是:H2A=H+HA HAH
+2-+A
试完成下列问题:
(1)Na2A溶液显__________(填“酸性”、“中性”或“碱性”)。
理由是__________________(用离子方程式表示)。
-(2)在0.1 mol·L1的Na2A溶液中,下列离子浓度关系不正确的是__________。
---A.c(A2)+c(HA)=0.1 mol·L1
+--B.c(H)=c(OH)+c(HA)
++---C.c(Na)+c(H)=c(OH)+c(HA)+c(A2)
+--D.c(Na)=2c(A2)+2c(HA)
--(3)已知0.1 mol·L1 NaHA溶液的pH=2,则0.1 mol·L1 H2A溶液中氢离子的物质的量
-浓度可能是__________________0.11 mol·1(填“<”、“>”或“=”),理由是
__________________。
-(4)0.1 mol·L1 NaHA溶液中各种离子浓度由大到小的顺序是__________________。
【答案】 (1)碱性
---A2+H2OHA+OH
(2)B、C ---
(3)< H2A第一步电离出的H抑制了HA的电离
+-+--(4)c(Na)>c(HA)>c(H)>c(A2)>c(OH)
+-
