化工专业实验报告
实验名称:二元气液平衡数据的测定
实验人员:
同组人:
实验地点:
实验时间:
班级:
学号:
指导教师:
实验成绩:
二元气液平衡数据的测定
一、 实验目的
1. 测定苯—正庚烷二元体系在常压下的气液平衡数据
2. 通过实验了平衡釜的结构,掌握气液平衡数据的测定方法和技能
3. 应用Wilson方程关联实验数据
二、 实验原理
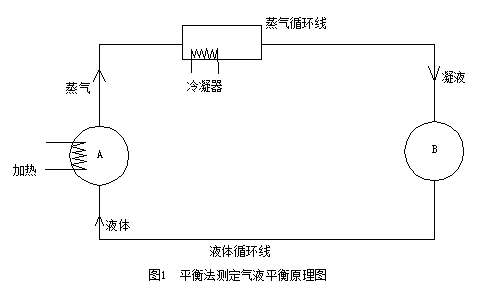
与循环法测定气液平衡数据的平衡釜基本原理相同,如下图所示,体系达到平衡时,两个容器的组成不随时间变化,这时从A和B 两容器中取样分析,可得到一组平衡数据。
当达到平衡时,除了两相的压力和温度分别相等外,每一组分的化学位也相等,即逸度相等,其热力学基本关系为:
fiL=fiV……………………………………….(1)
φipyi=γifi0xi
常压下,气相可视为理想气体,再忽略压力对液体逸度的影响,fi=pi0从而得出低压下气液平衡关系为:
pyi=γipi0xi…………………………………(2)
式中,p——体系压力(总压);
pi0——纯组分I在平衡温度下饱和蒸汽压,可用安托尼(Antoine)公式计算;
xi、yi——分别为组分I在液相和气相中的摩尔分率;
γi——组分i的活度系数。
由实验测得等压下气液平衡数据,则可用
 ………………………………..(3)
………………………………..(3)
计算出不同组成下的活度系数。
本实验中活度系数和组成关系采用Wilson方程关联。Wilson方程为:
lnγ1=-ln
 ………(4)
………(4)
lnγ2=-ln ………(5)
………(5)
Wilson方程二元配偶参数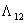 和
和 采用非线形最小二乘法,由二元气液平衡数据回归而得。
采用非线形最小二乘法,由二元气液平衡数据回归而得。
目标函数选为气相组成误差的平方和,即
F= (y1实-y1计)2j+(y2实-y2计)2j…………………………………(6)
(y1实-y1计)2j+(y2实-y2计)2j…………………………………(6)
三、实验装置和试剂
1. 平衡釜一台(平衡釜的选择原则:易于建立平衡、样品用量少、平衡温度测定准确、气相中不夹带液滴、液相不返混及不易暴沸等。本实验采用气液双循环的小平衡釜,其结构如图2所示)
2. 阿贝折射仪一台
3. 超级恒温槽一台
4. 50-100十分之一的标准温度计一支、0-50十分之一的标准温度计一支
5. 所用试剂(苯、正庚烷)为优级品。
6. 1ml注射器十支、5ml注射器三支。

四、实验步骤
1. 开启超级恒温槽,调温度至测定折射率所需温度25℃或30℃
2. 测温套管中倒入甘油,将标准温度计插入套管中,并在其露出部分中间固定一支温度计,对温度进行校正
3. 查整个系统的气密性,以保证实验装置具有良好的气密性,将气压球与三通管连接好,与大气相通,用手压瘪气压球,然后开启气压球所连小阀直通系统,抽气使设备处于负压状态,U型管压力计的液面升起,在一定值下停止。注意操作不能过快,以免将U型管液体抽入系统。关闭气压球所连小阀,停10分钟,U型管内液体位差不下降为合格。开启气压球所连小阀[j1] ,使系统直通大气。
4. 于实验测定的是常压下的气液平衡数据,读取当天实验室的大气压值。
5. 平衡釜内加入一定浓度的苯—正庚烷混合液约20—30毫升,打开冷却水,安放好加热器,接通电源。开始时加热电流给到0.1A加热,5分钟后给到0.2A,再等5分钟后慢慢调到0.25A左右即可,以平衡釜内液体能沸腾为准。冷凝回流液控制在每秒2—3滴,稳定回流15分钟左右,以建立平衡状态。
6. 到平衡后,需要记录下两个温度计的读数,并用微量注射器分别取两相样品2毫升,用阿贝折射仪测定其折射率,并在本实验给定的苯的组成—折射率曲线上确定样品的组成。关掉电源,拿下加热器,釜液停止沸腾。
7. 注射器从釜中取出2~5毫升的混合液,然后加入同量的一种纯物质,重新加热建立平衡。加入那种物质,可以依据你上一次的平衡温度而定,以免实验点分布不均。本实验是降温操作,取出的混和液5毫升,加入苯7毫升,实验重复5次。
8. 实验完毕,关掉电源和水源,处理实验数据。
五、实验数据处理及结论
(一)实验条件及给定数据
①实验条件
实验温度:25.5℃ 大气压:101.19Kpa
②纯组分在常压下的沸点
苯:80.4 ℃ 正庚烷:98.4℃
③水银温度计检定结果
表1:水银温度计显示值及修正值对应表(实验给定)

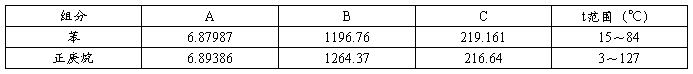
④苯和正庚烷纯物料的Antoine常数
表2:纯物料的安托尼常数
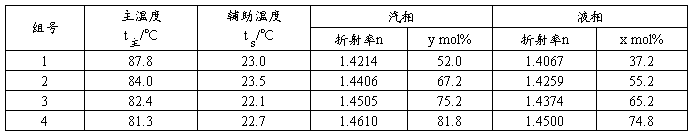
(二)苯—正庚烷混合液气液平衡数据的测定实验原始数据
表3 苯—正庚烷混合液测定实验沸点温度,以及气(苯含量)液平衡组成
(三)平衡温度计算
平衡温度的计算方法如下:
t实际=t主+t修正+t校正值
t修正:通过精查温度计的修正值得到,见表1
t校正值:t校正值=kn(t主-ts)
k——水银在玻璃中间的膨胀系数取0.00016;
n——露出部分的温度系数取60
t主——在介质中的温度;
ts——露出水银柱的平均温度(即辅助温度计的读数)
平衡温度计算结果见表4
表4 苯—正庚烷混合液测定实验实际温度计算结果
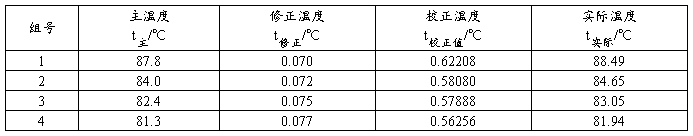
表4注:表中修正温度由主温度在表1所给温度修正值在三次样条插值而得,最终实际温度计算结果保留一位小数,是因为主温度测定的精度决定的。
附:修正水银温度计时所用三次样条插值程序(用matlab编写)
t0=[87.8 84.0 82.4 81.3]
x=[50 55 60 65 70 75 80 85 90 95 100]
y=[0.01 0.07 0.10 0.12 0.09 0.05 0.08 0.07 0.07 0.09 0.08]
yy=spline(x,y,t0)
ts=[26.0 26.0 25.0 25.0 25.0];
tj=0.00016 * 60 .*(t0-ts);
t=t0+tx+tj
运行结果:
t = 88.49 84.65 83.05 81.94
(四) 苯和正庚烷纯组分在本实验不同温度下的饱和蒸汽压的计算
由Antoine(安托尼)公式:
lgPi0=Ai – Bi/(Ci+t)
式中:
t—温度,℃(即计算所得的实际温度) P0—饱和蒸汽压,mmHg
所以可得到:
Pi0=10(Ai-Bi/(Ci+t))
纯物料的Antoine常数见表2
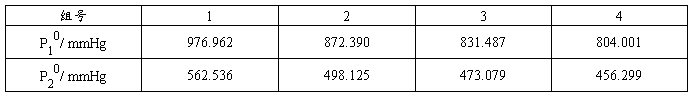
纯组分饱和蒸汽计算结果见表5
表5:纯组分饱和蒸汽在实验温度下计算结果
(五)用非线形最小二乘法回归配偶参数Λ12、Λ21并求液相组成
①活度系数和组成关系采用Wilson方程关联
lnγ1=-ln

lnγ2=-ln
目标函数选为气相组成误差的平方和,即
F= (y1实-y1计)2j+(y2实-y2计)2j
(y1实-y1计)2j+(y2实-y2计)2j
用非线性最小二乘法拟合:matlab拟合程序见下
主程序:
bb0=[1,1]
[bb,resnorm]=lsqnonlin('qiye',bb0)
子程序:
function F=qiye(bb)
x1=0.01*[37.2 55.2 65.2 74.8];
x2=1-x1;
y1=0.01*[52.0 67.2 75.2 81.8];
y2=1-y1;
Pa0 =[976.962 872.390 831.487 804.001];
Pb0 =[562.536 498.125 473.079 456.299];
for i=1:4
F(i)=y1(i)-Pa0(i)*x1(i)/760*exp(-log(x1(i)+bb(1)*x2(i))+x2(i)*(bb(1)/(x1(i)+bb(1)*x2(i))-bb(2)/(x2(i)+bb(2)*x1(i))))
end
for i=5:8
j=i-4
F(i)=y2(j)-Pb0(j)*x2(j)/760*exp(-log(x2(j)+bb(2)*x1(j))+x1(j)*(bb(2)/(x2(j)+bb(2)*x1(j))-bb(1)/(x1(j)+bb(1)*x2(j))))
End
拟合结果为:
bb = 1.0361 0.7112
resnorm = 6.2948e-004
也就是:
Λ12= 1.0361
Λ21= 0.7112
resnorm= 6.2948e-004
(六)求气相组成:
由matlab算出y实测-y计算程序如下:
bb =[1.0361 0.7112];
x1=0.01*[37.2 55.2 65.2 74.8];
x2=1-x1;
y1=0.01*[52.0 67.2 75.2 81.8];
y2=1-y1;
Pa0 =[976.962 872.390 831.487 804.001];
Pb0 =[562.536 498.125 473.079 456.299];
for i=1:4
F(i)=y1(i)-Pa0(i)*x1(i)/760*exp(-log(x1(i)+bb(1)*x2(i))+x2(i)*(bb(1)/(x1(i)+bb(1)*x2(i))-bb(2)/(x2(i)+bb(2)*x1(i))));
end
for i=5:8
j=i-4
F(i)=y2(j)-Pb0(j)*x2(j)/760*exp(-log(x2(j)+bb(2)*x1(j))+x1(j)*(bb(2)/(x2(j)+bb(2)*x1(j))-bb(1)/(x1(j)+bb(1)*x2(j))));
end
F
得到
F = -0.0156 -0.0020 0.0105 0.0098 -0.0005 0.0106 0.0055 0.0055

F= (y1实-y1计)2j+(y2实-y2计)2j=(-0.0156)2+(-0.0020)2+…+0.00552+0.00552=0.000627
(y1实-y1计)2j+(y2实-y2计)2j=(-0.0156)2+(-0.0020)2+…+0.00552+0.00552=0.000627
与程序拟和的结果参数一致。
(七)用实验值和计算值作温度组成图(t—x—y)
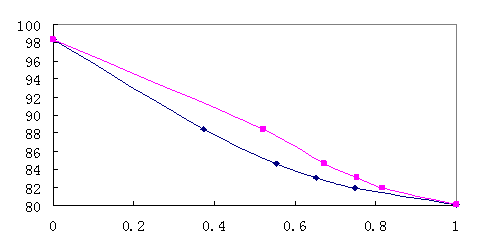
图3 苯的气液平衡图
(八) 实验结果讨论及误差分析
(1)实验结果讨论
从实验的结果的相图和气相组成的实验值和计算值的比较来看,本次实验测得以及回归所得实验数据可靠,误差均在实验允许范围内。从相图可以看出,本实验数据很好的体现了常规二元气液平衡相图规律。应用Wilson方程关联实验数据,并采用非线性最小二乘法进行回归处理,得出配偶参数,再求出气相组成,所得气相组成误差平方和为0.00627。即计算值和实验值的误差非常小,可以用关联得到的Wilson方程计算该物系的组成。
(2)实验误差分析
由于本次实验只是降温操作,每次均是取出混和液,加入纯苯,所以整个实验过程测定的温度是逐渐下降的,而且实验测定的气液相平衡组成是采集的数据点也不是十分的充足,以致相点分布欠佳。在使用阿贝折射仪测定折射率的时候存在读数误差,以及由折射率在折射率—组成的工作曲线上读取气液相组成时候存在误差。读取温度计的温度的时候存在估读误差。对计算结果回造成影响。取样的时候是否平衡釜已经达到气液平衡,且平衡釜上方汽相贮液槽内液体组成是否已经等于平衡气相组成,会对测定产生很大影响。
六、思考题
(1)实验中怎样判断气液两相已达到平衡?
答:实验中采用对比法来判断气液两相是否达到平衡。即先记录下来一个体系的温度,然后每隔2至3分钟读一次温度,如果相邻两次温度读数不再发生变化,则可判定气液两相达到平衡。
(2)影响气液平衡测定准确度的原因有那些?
答:①装置的气密性;②平衡温度的读取;③由阿贝折射仪读取混和液折射率的误差;④在阿贝折射仪工作曲线上由折射率读取气液相组成存在读数误差;⑤取样时气液是否达到平衡;⑥是否选取了合理的取样点。
(3)为什么要确定模型参数,对实际工作有何作用?
答:由于温度变化,但参数不会变,确定模型参数后,对于同样的物系,都可以使用,省去了实验的时间,直接计算就可,获得数据更快速、更方便。模型参数对于实际工作中有着很好的指导作用,而且Wilson方程有了二元参数后,可以用来预测多元混合物的性质。
[j1]调节三通阀
第二篇:二元系统气液平衡数据的测定

室温 ℃大气压 氢氧化钠浓度 (1).实验室温度记录
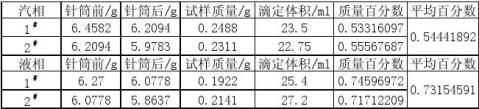
(2).汽、液相组成数据
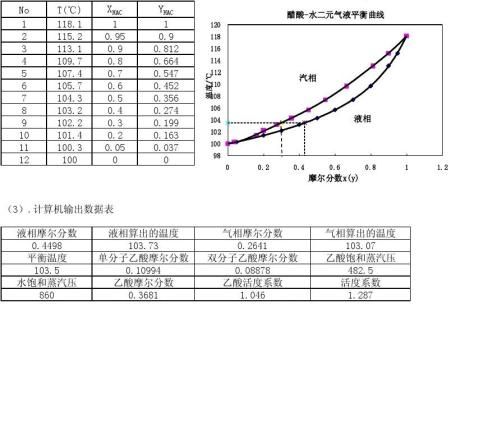
0.2637480.44959
00.4300910.2992620.2992620.430091
0.4300910.430091-1.3E-120.299262-9.3E-0800103.5103.5103.5103.5103.5103.5
