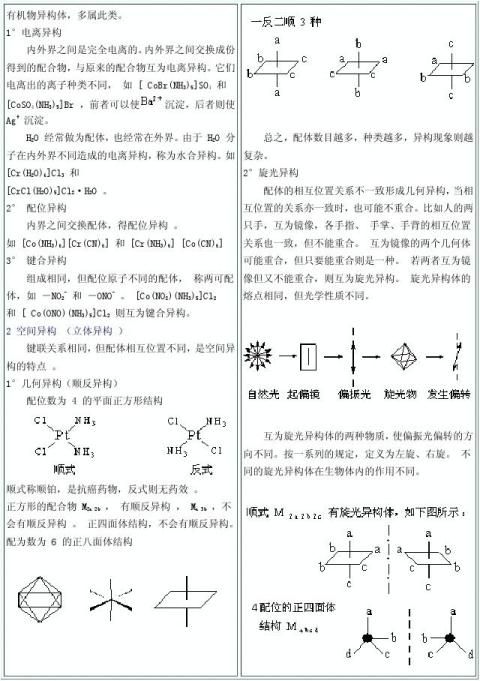
课题:配位化合物的基本概念
课型: 课时: 上课时间:
学习目标:
1、了解配合物的形成原理
2、知道配位键、配合物、配离子等基本概念
3、掌握配合物的组成和命名
重、难点:
1、配合物的组成
2、配合物的命名
学习过程:
课前检测:
(一)完成下面方程式:
1、硫酸铜与氨水反应
2、硫酸铜与氯化钡反应
3、硝酸银与氨水反应
(二)溶度积规则Qi与Ksp的关系
学习新课
一、配合物的定义
[实验探究]
1、取一支试管加入5mL 0.1mol/L CuSO4溶液,然后逐滴加入2mol/L NH3·H2O溶液至过量,观察并记录现象
。
2、将上述溶液分成两份,一份滴加数滴0.1mol/L BaCl2溶液,另一份滴加数滴1mol/L NaOH溶液,观察并记录现象
。
3、分析实验现象,你能得出什么结论:
。
(沉淀-溶解平衡考虑)
[自学反馈]预习P130配合物的定义,理解下列几个基本概念
1、配位键
2、配离子
3、配合物
二、配合物的组成
[自学反馈]预习P131配合物的组成,掌握配合物的组成
以[Cu(NH3)4]SO4为例,分析其组成
[Cu(NH3)4]SO4
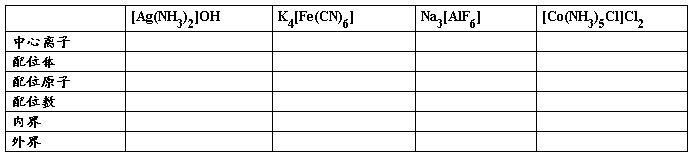
自学检测:分析下列配合物的组成。
小结:
1、中心原子:通常是 ,
例如: 。
 2、配位体:提供 的分子和离子叫配位体
2、配位体:提供 的分子和离子叫配位体
例如: 。
配位原子:配位体中 原子叫配位原子
例如: 。
 3、配位数:作为 直接与 结合的 的数目,即形成配位键的数目称为配位数。
3、配位数:作为 直接与 结合的 的数目,即形成配位键的数目称为配位数。
4、配离子的电荷数:配离子的电荷数等于 和 电荷数的代数和。
5、内界和外界:配合物分为内界和外界,其中 称为内界,与内界发生电性匹配的 称为外界。
三、配合物的命名
[自学反馈]预习P132配合物的命名,熟悉配合物的命名规则
1、配离子的命名:
2、配位酸:
3、配位碱:
4、配位盐:
自学检测:命名下列配合物
(1)K2[PtCl6]
(2)K4[Fe(CN)6]
(3)[Co(NH3)6]Cl3;
(4)[CrCl2(H2O)4]Cl
(5)[Co(NO3)3(NH3)3]
(6)[Fe(CO)5]
课堂检测:
1、由配位键形成的离子[Pt(NH3)6]2+和[PtCl4]2—中,两个中心离子铂的化合价是
A.都是+8 B.都是+6 C.都是+4 D.都是+2
2.0.01mol氯化铬(CrCl3·6H2O)在水溶液中用过量硝酸银溶液处理,产生0.02 mol AgCl沉淀。此氯化铬最可能是
A.[Cr(H2O)6]Cl3 B.[Cr(H2O)5Cl]Cl2
 C.[Cr(H2O)4Cl2]Cl·2H2O D.[Cr(H2O)3Cl3]·3H2O
C.[Cr(H2O)4Cl2]Cl·2H2O D.[Cr(H2O)3Cl3]·3H2O
3.下列大气污染物中,能与人体中血红蛋白中Fe2+以配位键结合而引起中毒的气体是  A.SO2 B.CO2 C.NO D.CO
A.SO2 B.CO2 C.NO D.CO
4.下列组合中,中心离子的电荷数和配位数均相同的是 ( )
A.K[Ag(CN)2]、[Cu(NH3)4]SO4 B.[Ni(NH3)4]Cl2、[Cu(NH3)4]SO4
C.[Ag(NH3)2]Cl、K[Ag(CN)2] D.[Ni(NH3)4]Cl2、[Ag(NH3)2]Cl
5.某物质的实验式为PtCl4·2NH3,其水溶液不导电,加入AgNO3溶液反应也不产生沉淀,以强碱处理并没有NH3放出,则关于此化合物的说法中正确的是( )
A.配合物中中心原子的电荷数和配位数均为6
B.该配合物可能是平面正方型构型 C.Cl—和NH3分子均与Pt4+配位
D.配合物中Cl—与Pt4+配位,而NH3分子不配位
6、命名下列配合物
K3[Fe(CN)6] K[PtCl3NH3]
[Co(NH3)5Cl2]Cl [Co(NH3)5H2O]Cl3
[Pt(NH3)2Cl2] [Ni(CO)4]
[Pt(NH2)NO2(NH3)2] )
配合物的命名法服从一般无机化合物的命名原则,如果配合物中的酸根是一个简单的阴离子,则称为某化某,如[Co(NH3)4Cl2]Cl称氯化二氯四氨合钴(Ⅲ)。如果酸根是一个复杂的阴离子,则称为某酸某,如[Cu(NH3)4]SO4称硫酸四氨合铜(Ⅱ)。若外界为氢离子,配阴离子的名称之后用酸字结尾,如H[PtCl3·(NH3)]称为三氯一氨合铂(Ⅱ)酸。它的盐如K[PtCl3(NH3)]称三氯一氨合铂(Ⅱ)酸钾。若外界为氢氧根离子则称氢氧化某,如[Cu(NH3)4](OH)2称为氢氧化四氨合铜(Ⅱ)。
配合物内界即配离子,其命名方法一般按照如下顺序:
配位体数——配位体名称(不同配位体名称之间以中圆点(·)分开)——“合”字——中心离子名称——中心离子氧化态(加括号,用罗马字注明)。
1.氢配酸和氢配酸盐
氢配酸的命名次序是:(1)酸性原子团,(2)中性原子团;(3)中心原子,(4)词尾用氢酸,氢字也可略去。
氢配酸盐的命名顺序同上,惟词尾用酸而不用氢酸,酸字后面再附上金属名称。
2.配阳离子配合物的命名次序是:(1)外界阴离子,(2)酸性原子团,(3)中性原子团,(4)中心原子。
3.中性配合物的命名次序是:(1)酸性原子团,(2)中性原子团,(3)中心原子。
若配离子中的配体不止一种,在命名时配体列出的顺序应按如下规定:
(1)在配体中如既有无机配体又有有机配体时,则无机配体排列在前,有机配体排列在后。如Cis-[PtCl2(Ph3P)2],应命名为顺-二氯·二(三苯基膦)合铂(Ⅱ)。
(2)在有多种无机配体和有机配体时,应先列出阴离子的名称,后列出阳离子和中性分子的名称。如K[PtCl3NH3]应命名为三氯·一氨合铂(Ⅱ)酸钾。
(3)同类配体的名称,应按配位原子元素符号的英文字母顺序排列。如[Co(NH3)5H2O]Cl3应命名为三氯化五氨·一水合钴(Ⅲ)。
(4)同类配体中若配位原子相同,则将含较少原子数的配体排在前面,较多原子数配体列后。如[Pt(NO2)(NH3)(NH2OH)(Py)]Cl应命名为氯化一硝基·一氨·一羟胺·一吡啶合铂(Ⅱ)。
(5)若配位原子相同,配体中含原子的数目也相同,则按在结构式中与配位原子相连的原子的元素符号的字母顺序排列。如[Pt(NH2)(NO2)(NH3)2]应命名为一氨基·一硝基·二氨合铂(Ⅱ)。
但是一些常见的配合物,通常都用习惯上的简单叫法。如[Cu(NH3)4]2+常称为铜氨配离子;[Ag(NH3)2]+为银氨配离子;K3[Fe(CN)6]称铁氰化钾(赤血盐);K4[Fe(CN)6]称亚铁氰化钾(黄血盐);H2SiF6称氟硅酸;K2PtCl6称氯铂酸钾等等。
第二篇:配位化合物的基本概念
配位化合物的基本概念
一.配位化合物


二 配合物的命名


三 异构现象