实验报告要求
1.认真完成实验报告,报告要用实验报告纸。一种药物写一份。
2. 应在理解的基础上简单扼要的书写实验原理,不提倡大段抄书。
3.应结合具体的实验现象和问题进行讨论,不提倡纯理论的讨论,更不要从其它参考资料中大量抄录。计算产率,思考题.
4.实验报告的分数与报告的篇幅无关。
对氯苯氧异丁酸(安妥明)的合成
一、目的要求:
掌握安妥明合成中缩合反应原理及产品精制操作方法。了解和掌握成盐方法,原理以及基本操作。
二、缩合反应
1、缩合反应原理:
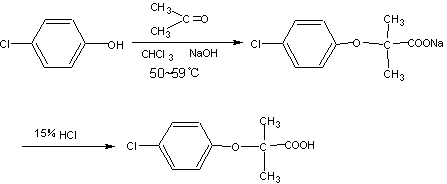
2、原料规格及投药量:

三、仪器设备
1、主要仪器:
250ml三口烧瓶 1个 调速搅拌器 1个、
200℃温度计 1个 球形冷凝管 1个
200ml抽滤瓶 1个 自动电热套 1个
100ml烧杯 1个 250V调压器 1个
吸滤瓶 1个 布氏漏斗 1个
表面皿 1个 b型熔点测定管1个
铁架台 1个
2、仪器与实验装置图
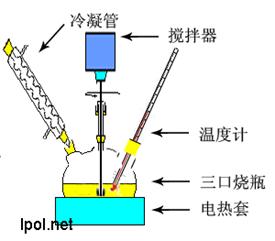
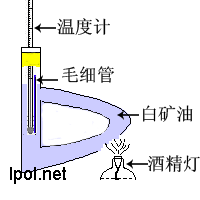 回流装置 熔点测试装置
回流装置 熔点测试装置

四 操作方法:
1 在装有液封搅拌和冷凝管的干燥三口瓶(250ml)中,投入对氯苯酚(12.9g)、丙酮(64.6ml) (对氯苯酚可以先用丙酮溶解再倒入三口瓶),开搅拌(此时不要加热),再投入NaOH固体(21.2g)( 注意NaOH易吸潮),充分搅拌,使NaOH固体混悬在反应液中,开始从冷凝管上端由滴管缓缓滴加氯仿(10.5ml),滴加氯仿时三口瓶内温不得超过50℃。加毕,此时开始水浴加热,继续反应1.5h,反应温度始终控制在50~60℃之间。
加玻璃弯管,改成蒸馏装置,继续加热,温度60~70℃,在缓缓搅拌下,蒸馏回收丙酮,至反应物呈稠糊状时,从插温度计口加入热水100ml,反应物全部溶解,继续蒸馏丙酮,继续升温,温度70~90℃,蒸馏丙酮完毕后,将瓶中反应物倒入250ml的烧杯中,在搅拌下用15%HCl趁热中和至PH=2(PH试纸),冷却至结晶产生,进行下一步精制。
思考题:
(1)缩合反应为什么要求无水操作?
(2)影响缩合反应收率的主要因素是什么?
2、精制操作:
将结晶液先倾去上层大部分水,再用玻棒将结晶块轻轻捣碎,抽滤,结晶用水洗涤二次,每次15ml,抽干,石油醚洗二次,每次15ml,抽滤,又水洗二次,每次15ml,抽干,用甲苯洗二次,每次15ml,抽干,最后水洗二次,每次15ml,压紧抽干,得淡黄色的对氯苯氧异丁酸粗品。(总共十次抽滤,不用换滤纸)(每次洗涤时,可先在漏斗里浸泡1分钟,再抽滤,切勿边倒边抽滤,每次要抽干)
取上述粗品置于250ml烧杯中,加入水40ml,水浴加热至内温60~65℃,滴加10%NaOH液,搅拌,使粗品完全溶解后,再用PH试纸测量,溶液pH应为8左右,如不到pH=8则继续用碱液调,加活性炭0.4g,搅拌保温15分钟,趁热抽滤,滤液趁热用18%C.P盐酸调节至pH=2,有大量白色结晶产生,放置冷水浴中冷却,抽滤,沉淀用水洗涤,置红外灯下于50℃干燥,得白色结晶粉末,称重,测熔点m.p118~122℃。计算收得率。
3、安妥明TLC反应终点的判断
方法: 薄层层析法
固定相:硅胶G
展开剂:氯仿-甲醇(7:3)
点样量:各10 μl (对氯苯酚甲醇液1ng/ml和反应液)
显色: 紫外 UV254nm
附注
1.缩合反应时,所用的仪器必须事前干燥,原料必须无水,水的存在必将使收率降低。因此需用液封装置,回流冷凝管需装上CaCl2干燥管。
2.缩合反应所用的催化剂必须是强碱,如固体NaOH、KOH,粒碱更好,液碱则不行。
3.缩合反应的产率与反应温度很有关系,反应温度高,加热时间长,将使油状物增多,因而要控制反应温度及避免加热时间过长。
4.缩合产物对氯苯氧异丁酸可溶于丙酮,所以反应回收丙酮时,必须尽量回收完全,否则收率降低。
5.在精制时的洗涤一定为使用水、石油醚、水和甲苯交替洗涤,以除去有机和无机杂质,保证产品质量。
氯贝丁酯Clofibrate
【类别】调节血脂及抗动脉硬化药
【药理作用】能抑制胆固醇和甘油三酯的合成。促进胆固醇和排泄,降低甘油三酯较降低胆固醇作用显著。还有减低血液粘度,降低血浆纤维蛋白原含量,有抗血栓作用。
【适应症】 主要用于高甘油三酯血症,尤其适用于Ⅲ、Ⅳ型高脂蛋白血症,还用于动脉粥样硬化。氯贝丁酯能降低血小板的粘附作用,抑制血小板聚集,使过高的纤维蛋白浓度降低至正常,因而减少血栓形成,可单独应用或与抗凝剂合用于缺血性心脏病人。
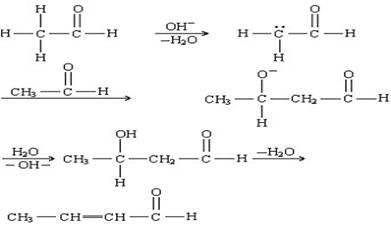
缩合反应 condensation reaction
两个或两个以上有机分子相互作用后以共价键结合成一个大分子,并常伴有失去小分子(如水、氯化氢、醇等)的反应。在多官能团化合物的分子内部发生的类似反应则称为分子内缩合反应。缩合反应在有机化学,尤其是有机合成中应用很广。
羟醛缩合反应。为醛、酮或羧酸衍生物等羰基化合物在羰基旁形成新的碳-碳键 , 从而把两个分子结合起来的反应。这些反应通常在酸或碱的催化作用下进行。一个羰基化合物在反应中生成烯醇或烯醇负离子后进攻另一个羰基的碳原子,从而生成新的碳-碳键 。 最简单的例子是乙醛的羟醛缩合反应:
实验六 依达拉奉的合成
一、目的要求
依达拉奉的吡唑环合成反应原理,产品精制操作方法
二、反应式:
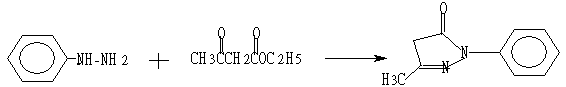
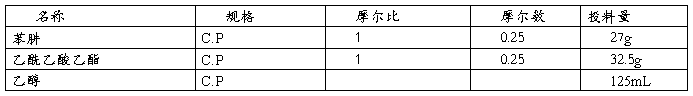
三、原料规格及投药量
四、操作方法
1、缩合
将40mL乙醇、27g (0.25mol) 苯肼加入装有搅拌、温度计和回流冷凝管的250ml三口瓶。加入32.5g (0.25mol) 乙酰乙酸乙酯。升温至回流(80℃)(避光)反应3h后停止加热,反应毕,然后放置过夜析晶。
将湿粗品直接以40mL乙醇回流80℃下溶解,稍冷,加入0.5g活性炭回流15分钟,热过滤,滤液室温放置析晶。滤集固体,60℃干燥,得到白色结晶性粉状固体依达拉奉,计算收率。
2、精制
称取依达拉奉10g,用乙醇加热溶解,热过滤,滤液室温放置析晶,滤集固体,60℃干燥得6g白色结晶性粉状固体,m.p:128-129℃。
依达拉奉 英文名:Edaravone
【化学名】:3-甲基-1-苯基-2-吡唑啉-5-酮3-methyl-1-phenyl-2-pyrazolin-5-one
【药理作用】 依达拉奉是一种脑保护剂(自由基清除剂)。临床研究提示N-乙酰门冬氨酸(NAA)是特异性的存活神经细胞的标志,脑梗塞发病初期含量急剧减少。脑梗塞急性期患者给予依达拉奉,可抑制梗塞周围局部脑血流量的减少,使发病后第28天脑中NAA含量较甘油对照组明显升高。临床前研究提示,大鼠在缺血/缺血再灌注后静脉给予依达拉奉,可阻止脑水肿和脑梗塞的进展,并缓解所伴随的神经症状,抑制迟发性神经元死亡。机理研究提示,依达拉奉可清除自由基,抑制脂质过氧化,从而抑制脑细胞、血管内皮细胞、神经细胞的氧化损伤。
【适应症】用于改善急性脑梗塞所致的神经症状、日常生活活动能力和功能障碍。
必存 依达拉奉注射液
【规格】5ml:10mg/支*6支
【药店价格】78.00
【用法用量】一次30mg,每日两次
实验三 磺胺醋酰钠的制备
学名:对氨基苯磺酰乙酰钠 ,用于治疗结膜炎、沙眼及其他眼部感染
结构式: 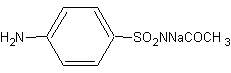
一、乙酰化
1.目的要求
(1)通过磺胺醋酰钠的合成,了解酰化反应的原理和掌握其操作技能。
(2)加深对磺胺类药物一般理化性质的认识
2.反应式

3 实验材料
药品:磺胺、醋酐、22.5%氢氧化钠、77%氢氧化钠、95%乙醇、活性炭、10%盐酸、 盐酸、40% 氢氧化钠、20% 氢氧化钠
仪器:搅拌器(标准口)、球形冷凝管(标准口)、三颈瓶(标准口)、减压过滤装置(水泵、吸滤瓶、布氏漏斗、滤纸、玻璃塞、剪刀、玻璃棒)、熔点测定仪、pH试纸、100℃温度计(标准口)、50 ml量筒、100 ml量筒、50 ml烧杯、100ml 烧杯、200ml烧杯、天平、称量纸、滴管
4. 操作方法
在装有搅拌、温度计和回流冷凝管的250ml三口瓶中投入0.10摩尔(17.2克)的磺胺和计算量的22.5%的氢氧化钠溶液(22ml),开搅拌,于水浴上加热至50~55℃左右,待物料溶解后加77%NaOH溶液3ml和醋酸酐4ml,因反应为放热反应,加料后温度会上升,加料期间反应温度控制在50-55℃,重复上述加料共5次,每次间隔不少于5分钟。(交替加料很重要,以使反应始终保持pH 12-14)。加料完成后,继续在水浴上保温搅拌30分钟,将反应液倾入250ml的烧杯中,加30ml常水稀释,用浓盐酸调至pH=7, 于冷水浴中放置半小时,并不时搅拌析出固体。 (pH7时析出的固体是N4-乙酰磺胺和磺胺)
5.思考题
(1)由磺胺乙酰化做成磺胺醋酰结构,修饰的目的是什么?
(2)乙酰化加碱原理?为什么要交替加料?
二 精制
1. 目的要求
掌握如何控制反应过程的pH、温度等条件及利用主产物与副产物不同的理化性质来分离副产物
2.分离副产物原理
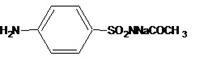


 3.操作方法:
3.操作方法:
取上次样品液,抽滤,沉淀物用10~15ml水洗涤,洗液与滤液合并,滤液用浓盐酸调至pH=4~5,得粗品(pH5时析出的固体是磺胺醋酰钠和双乙酰磺胺).抽滤,压干,称重,用3倍量(3 ml/1g)10%盐酸溶解得到的白色粉末,不时搅拌,放置30分钟,尽量使单乙酰物成盐酸盐溶解,滤除不溶物,(在10%HCl中不溶物是双乙酰磺胺,磺胺醋酰溶于10%HCl液),滤液加少量活性炭室温脱色后,抽滤,滤液用40%氢氧化钠溶液调pH=5,析出磺胺醋酰,抽滤,压干。于红外灯下干燥得精品,m.p 179-180℃,如果所得产品熔点不合格,可用热水(1:1.5)进行重结晶,直至熔点合格。
4.思考题
(1)乙酰化有那些副产物?怎样分离?
三、成盐
1. 目的要求 了解和掌握其成盐方法和操作方法
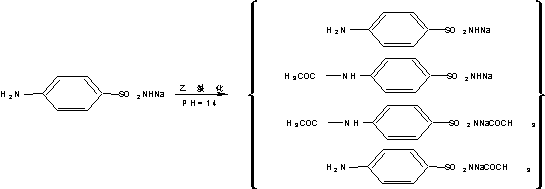
2.反应式

3.操作步骤:
将所得的磺胺醋酰精品投入100ml烧杯中,用少量水湿润后,于水浴上加热至90℃,用滴管滴加20%氢氧化钠至恰好溶解(在水浴中进行),PH=7-8,乘热过滤,滤液转入烧杯中放冷析出,滤取结晶,干燥,得磺胺醋酰钠成品,称重,计算收得率。
检查:取本品0.5g,加10 ml水,若p H 8-10 示为合格。
注:
1、磺胺类药物为无臭、无味白色或微黄色的结晶粉末,难溶于水,可溶于丙酮或乙醇,它具有磺酰氨基和芳伯氨基的通性。
酰化反应 定义:有机物分子中O、N、C原字上导入酰基的反应,
酰化剂强弱与种类:离去基团共轭酸的酸性越强,酰化剂的酰化能力越强
酰化能力:RCOClO4> RCOBF4> RCOX >RCOOCOR> RCOOH >RCOOR'> RCONHR
磺酸、磺酰胺和磺酰亚胺都有足够强的酸性,常利用其和碱金属离子形成盐,成盐后水溶性增大宜于制成液体制剂,如磺胺醋酰钠、磺胺嘧嚏钠、糖精钠等。
2、本反应是放热反应,氢氧化钠与醋酐交替投料交替加入,目的是避免醋酐和NaOH同时加入时产生大量的中和热而温度急速上升,造成芳伯胺基氧化和已生成的磺胺醋酰水解,导致产量降低,因此反应的温度亦不能过高,需控制在50℃―55℃。滴加乙酸酐和氢氧化钠溶液是交替进行的,先氢氧化钠后醋酐,每滴完一种溶液后,反应搅拌5分钟,再滴入另一种溶液,滴加速度以液滴一滴一滴加入为宜。
3、实验中使用氢氧化钠溶液浓度有差别,在实验中切勿用错,否则会影响实验结果,保持反应液最佳碱度是反应成功的关键之一。用22.5%NaOH液是做为溶剂溶解磺胺,使其生成钠盐而溶解。用77%NaOH液是为了使反应液维持在pH12-14左右,避免生成过多双乙酰磺胺。
4由于磺胺和醋酐反应时同时有磺胺醋酰和双乙酰磺胺生成,反应过程中若碱性过强(pH>14 ),则乙酰化反应可能不完全,磺胺较多,磺胺醋酰次之,磺胺双醋酰较少;因为碱性过强(pH>14)双乙酰磺胺易水解成磺胺,易引起磺胺醋酰水解成磺胺;若碱度不足(pH<12),则双乙酰磺胺生成较多,磺胺醋酰次之,磺胺较少,碱性过弱(pH<12 环境中反应易生成较多的N4-乙酰磺胺,且双乙酰磺胺分子结构中的乙酰基不易水解。故实验中需严格控制各步投料量。
5、本实验中溶液pH的调节应小心注意,否则实验会失败或收率降低。利用主产物和副产物不同理化性质在不同的pH下分别除去磺胺、双乙酰磺胺。在提取粗品时用浓HCl调pH7,使乙酰磺胺钠、磺胺钠水解成乙酰磺胺、磺胺而游离析出。再用浓HCl调pH5,磺胺醋酰钠和双乙酰磺胺钠水解生成游离单体而析出,得粗品。因磺胺醋酰溶于10%HCl液,而双乙酰磺胺不溶过滤除去,调pH得磺胺醋酰。但要注意的是,调pH时要控制酸或碱的用量,切忽调来调去。总结:酰化液处理过程中,pH7时析出的固体是N4-乙酰磺胺和磺胺,pH5时析出的固体是磺胺醋酰钠和双乙酰磺胺,在10%HCl中不溶物是双乙酰磺胺,因为其结构中无游离的芳伯氨基不能于HCl成盐。
6.精制时加入活性炭起脱色之功效,所加入的量为产品量的1%,不能太多,否则使产品收率下降。
7磺胺醋酰在无水乙醇溶解时,置水溶加热时间不宜太长(约3~5分钟为宜),否则产品易氧化和水解。固体溶解如溶液混浊,则需抽滤。必须严格控制水浴温度,若温度过高易引起磺胺醋酰钠水解和氧化,影响产量和质量,温度低不易成钠盐。
8.制备磺胺醋酰钠时,氢氧化钠溶液的量应严格控制,按计算量加。因磺胺醋酰钠水溶度大,由磺胺醋酰制钠盐时,氢氧化钠量多于计算量,则磺胺醋酰钠损失量大,必要时加少量丙酮,以使磺胺醋酰钠析出。滴加40%氢氧化钠溶液调pH7~8时可见溶液澄明,显示磺胺醋酰已生成磺胺醋酰钠,若有微量不溶物,可能是未除尽的副产物。氢氧化钠溶液切勿过量,因磺胺醋酰钠在强碱性溶液中和受热情况下,易氧化水解而致产量和质量下降。
9产品过滤时,严禁用水洗涤产品,因所得产品为钠盐,在水中有较大的溶解度。
第二篇:高分子化学实验讲义1
高 分 子 化 学 实 验 讲 义
1
目录
实验一 甲基丙烯酸甲酯的本体聚合.......................................3 实验二:苯乙烯的悬浮聚合.................................................................5 实验三 醋酸乙烯酯的乳液聚合...................................................7 实验四 乙酸乙烯酯的溶液聚合与聚乙烯醇的制备.10 实验五 苯乙烯与马来酸酐的交替共聚合.........................12 实验六 双酚A型低分子量环氧树脂的制备.....................14 实验七 乙酸纤维素的制备..............................................................20 2
实验一 甲基丙烯酸甲酯的本体聚合
一、实验目的
1. 了解自由基本体聚合的特点和实施方法。
2. 熟悉有机玻璃的制备方法,了解其工艺过程。
二、实验原理
本体聚合是指单体本身在不加溶剂及其他分散介质的情况下由微量引发剂或光、热、辐射能等引发进行的聚合反应。由于聚合体系中的其他添加物少(除引发剂外,有时会加入少量必要的链转移剂、颜料、增塑剂、防老剂等),因而所得聚合产物纯度高,特别适合于制备一些对透明性和电性能要求高的产品。
本体聚合的体系组成和反应设备是最简单的,但聚合反应却是最难控制的,这是由于本体聚合不加分散介质,聚合反应到一定阶段后,体系粘度大,易产生自动加速现象,聚合反应热也难以导出,因而反应温度难控制,易局部过热,导致反应不均匀,使产物分子量分布变宽。这在一定程度上限制了本体聚合在工业上的应用。为克服以上缺点,常采用分阶段聚合法,即工业上常称的预聚合和后聚合。
三 、主要药品与仪器
甲基丙烯酸甲酯(MMA) 20 mL
过氧化苯甲酰(BPO) ~20mg
50 mL锥形瓶 1个
恒温水浴 1套
试管夹 1个
试管 2支
四、实验步骤
3
(1)预聚合
在50mL锥形瓶中加入20mLMMA及单体质量0.1%的BPO,瓶口用胶塞盖上,用试管夹夹住瓶颈在85~90℃的水浴中不断摇动,进行预聚合约0.5h,注意观察体系的粘度变化,当体系粘度变大,但仍能顺利流动时,结束预聚合。
(2)浇铸灌模
将以上制备的预聚液小心地分别灌入预先干燥的两支试管中,浇灌时注意防止锥形瓶外的水珠滴入。
(3)后聚合
将灌好预聚液的试管口塞上棉花团,放入45~50℃的水浴中反应约20h,注意控制温度不能太高,否则易使产物内部产生气泡。然后再升温至100~105℃反应2~3h,使单体转化完全完成聚合;
(4)取出所得有机玻璃棒,观察其透明性,是否有气泡。
五、思考题
进行本体浇铸聚合时,如果预聚阶段单体转化率偏低会产生什么后果?为什么要严格控制不同阶段的反应温度?
4
实验二:苯乙烯的悬浮聚合
一、实验目的
1. 通过对苯乙烯单体的悬浮聚合实验,了解自由基悬浮聚合的方法和配方中各组分的作用;
2. 学习悬浮聚合的操作方法;
3. 通过对聚合物颗粒均匀性和大小的控制,了解分散剂、升温速度、搅拌形式与搅拌速度对悬浮聚合的重要性。
二、实验原理
悬浮聚合实质上是借助于较强烈的搅拌和悬浮剂的作用,通常将不溶于水的单体分散在介质水中,利用机械搅拌,将单体打散成直径为0.01~5 mm的小液滴的形式进行的本体聚合。在每个小液滴内,单体的聚合过程和机理与本体聚合相似。悬浮聚合解决了本体聚合中不易散热的问题,产物容易分离,清洗可以得到纯度较高的颗粒状聚合物。其主要组分有四种:单体,分散介质(水),悬浮剂,引发剂
1.单体 单体不溶于水,如:苯乙烯(styrene),醋酸乙烯酯(vinyl acetate),甲基丙烯酸酯(methyl methacrylate)等。
2.分散介质 分散介质大多为水,作为热传导介质。
3.悬浮剂:调节聚合体系的表面张力、粘度、避免单体液滴在水相中粘结。
a. 水溶性高分子,如天然物:明胶(gelatin),淀粉(starch);合成物:聚乙烯醇(PVA)等。
b.难溶性无机物,如:BaSO4,BaCO3,CaCO3,滑石粉,粘土等。 c. 可溶性电介质:NaCl,KCl,Na2SO4等。
4.引发剂 主要为油溶性引发剂,如:过氧化二苯甲酰(benzoyl peroxide,BPO),偶氮二异丁腈(azobisisobutyronitrile,AIBN)等。 5
二. 主要仪器和试剂
实验仪器:三口瓶(250ml)×1,球形冷凝管×1,电热锅×1,搅拌马达与搅棒×1,温度计(100℃)×1,量筒(100ml)×1,锥形瓶(100ml)×1,布氏漏斗×1,和抽滤瓶×1。
实验试剂:苯乙烯单体,过氧化二苯甲酰(BPO),聚乙烯醇(PVA),去离子水
三. 实验步骤
1.架好带有冷凝管、温度计、三口烧瓶的搅拌装置,如图1-1所示;
2. 分别将0.3g BPO和16ml苯乙烯加入100ml锥形瓶中,轻轻摇动至溶解后加入250ml三口烧瓶中;
3. 再将7-8 ml 0.3% PVA溶液和130ml去离
子水冲洗锥形瓶与量筒后加入250ml三口
烧瓶中开始搅拌和加热;
4. 在半小时内,将温度慢慢加热至85-90℃,
并保持此温度聚合反应2小时后,用吸管吸
少量反应液于含冷水的表面皿中观察,若聚
合物变硬可结束反应;
5. 将反应液冷却至室温后,过滤分离,反覆
水洗后,在50℃下温风干燥后,称重。
四. 注意事项
图1-1 其他可进行悬浮聚合的单体,1. 除苯乙烯外,
还有氯乙烯(vinyl chloride),甲基丙烯酸甲酯(MMA),醋酸乙烯酯(VAc)等;

2. 搅拌太激烈时,易生成砂粒状聚合体;搅拌太慢时,易生成结块,附着在反应器内壁或搅拌棒上;
3. PVA难溶于水,必须待PVA完全溶解后,才可以开始加热;
4. 称量BPO采用塑料匙或竹匙,避免使用金属匙;
5. 是否能获得均匀的珍珠状聚合物与搅拌速度的确定有密切的关系。聚合过程中,不宜随意改变搅拌速度
6
实验三 醋酸乙烯酯的乳液聚合
一、实验目的
1. 学习乳液聚合方法,制备聚醋酸乙烯酯乳液
2. 了解乳液聚合机理及乳液聚合中各个组分的作用
二、实验原理
乳液聚合是指将不溶或微溶于水的单体在强烈的机械搅拌及乳化剂的作用下与水形成乳状液,在水溶性引发剂的引发下进行的聚合反应。乳液聚合与悬浮聚合相似的是都是将油性单体分散在水中进行聚合反应,因而也具有导热容易,聚合反应温度易控制的优点,但与悬浮聚合有着显著的不同,在乳液聚合中,单体虽然同以单体液滴和单体增溶胶束形式分散在水中的,但由于采用的是水溶性引发剂,因而聚合反应不是发生在单体液滴内,而是发生在增溶胶束内形成M/P(单体/聚合物)乳胶粒,每一个M/P乳胶粒仅含一个自由基,因而聚合反应速率主要取决于M/P乳胶粒的数目,亦即取决于乳化剂的浓度。由于胶束颗粒比悬浮聚合的单体液滴小得多,因而乳液聚合得到的聚合物粒子也比悬浮聚合的小得多。
乳液聚合能在高聚合速率下获得高分子量的聚合产物,且聚合反应温度通常都较低,特别是使用氧化还原引发体系时,聚合反应可在室温下进行。乳液聚合即使在聚合反应后期体系粘度通常仍很低,可用于合成粘性大的聚合物,如橡胶等。乳液聚合所得乳胶粒子粒径大小及其分布主要受以下因素的影响:(1)乳化剂,对同一乳化剂而言,乳化剂浓度越大,胶粒子的粒径越小,粒径大小分布越窄;(2)油水比,油水比一般为1:2~1:3,油水比越小,聚合物乳胶粒子越小;(3)引发剂,引发剂浓度越大,产生的自由基浓度越大,形成的M/P颗粒越多,聚合物乳胶粒越小,粒径分布越窄,但分子量越小;(4)温度,温度升高可使乳胶粒子变小,温度降低则使乳胶粒子变大,但都可能导致乳液体系不稳定而产生凝聚或絮凝;(5)加料方式,分批加料比一次性加料易获得较小的聚合物乳胶粒,且聚合反应更易控制;分批滴加单体比滴加单体的预乳液所得的聚合物乳胶粒更小,但乳液体系相对不稳定,不易控制,因此多用分批滴加预乳液的方法。 7
醋酸乙烯酯乳液聚合机理与一般乳液聚合机理相似,但是由于醋酸乙烯酯在水中有较高的溶解度,而且容易水解,产生的乙酸会干扰聚合;同时,醋酸乙烯酯自由基十分活泼,链转移反应显著。因此,除了乳化剂,醋酸乙烯酯乳液生产中一般还加入聚乙烯醇来保护胶体。
醋酸乙烯酯也可以与其他单体共聚合制备性能更优异的聚合物乳液,如与氯乙烯单体共聚合可改善聚氯乙稀的可塑性或改良其溶解性;与丙烯酸共聚合可改善乳液的粘接性能和耐碱性。
三、主要药品与仪器
乙酸乙烯酯 32 ml
蒸馏水 20 mL
10%聚乙烯醇(1788)水溶液 30 mL
OP-10 0.8mL
过硫酸钾(KPS) 0.08~0.10 g
装有搅拌器、冷凝管、温度计的三颈瓶1套
恒温水浴 1套 、
10、50、100ml量筒各一支
50 mL烧杯 1个
四、实验步骤
先在50mL烧杯中将KPS溶于8mL水中。另在装有搅拌器、冷凝管和温度计的三颈瓶(如图1-1)中加入30mL聚乙烯醇溶液,0.8mL乳化剂OP-10,12 mL蒸馏水,5mL醋酸乙烯酯和2mL KPS水溶液,开动搅拌,加热水浴,控制反应温度为68~70℃,在约2h内由冷凝管上端用滴管分次滴加完剩余的单体和引发剂,保持温度反应到无回流时,逐步将反应温度升到90℃,继续反应至无回流时撤去水浴,将反 8
应混合物冷却至约50℃,加入10%的NaHCO3水溶液调节体系的pH值为2~5,经充分搅拌后,冷却至室温,出料。观察乳液外观,称取约4g乳液,放入烘箱在90℃干燥,称取残留的固体质量,计算固含量。 固含量=(固体质量/乳液质量)×100%,在100 mL量筒中加入10mL乳液和90mL蒸馏水搅拌均匀后,静置一天,观察乳胶粒子的沉降量。
五、思考题
(1) 乳化剂主要有那些类型?各自的结构特点是什么?乳化剂浓度对
聚合反应速率和产物分子量有何影响?
(2) 要保持乳液体系的稳定,应采取什么措施?
9
实验四 乙酸乙烯酯的溶液聚合与聚乙烯醇的制备
一、实验目的
1.通过本实验掌握醋酸乙烯酯溶液聚合方法;
2.了解聚醋酸乙烯酯制备聚乙烯醇方法;
3.通过高分子转化反应了解溶液聚合、高分子侧基反应原理及醇解度测定方法。
二、实验原理
溶液聚合是将单体和引发剂溶于适当的溶剂中,在溶液状态下进行的聚合反应。根据聚合产物是否溶于溶剂可分为均相溶液聚合和沉淀溶液聚合。与本体聚合相比,溶液聚合体系粘度小,传质和传热容易,聚合反应温度容易控制,不易发生自动加速现象,而且由于高分子浓度低,不易发生向高分子的链转移反应,因而支化产物少,产物分子量分布较窄;缺点是单体被稀释,聚合反应速率慢,产物分子量较低,而且如果产物不能直接以溶液形式应用的话,还需增加溶剂分离与回收后处理工序,加之溶液聚合的设备庞大,利用率低,成本较高。溶液聚合在工业上常用于合成可直接以溶液形式应用的聚合物产品,如胶粘剂、涂料、油墨等,而较少用于合成颗粒状或粉状产物。 本实验采用自由基溶液聚合反应。之所以选用乙醇作溶剂,是由于PVAc能溶于乙醇,而且聚合反应中活性链对乙醇的链转移常数较小。而且在醇解制取PVA时,加入催化剂后在乙醇中经侧基转化反应即可直接进行醇解。
PVAc的醇解可以在酸性或碱性催化下进行,目前工业上都采用碱性醇解法。
另一方面,乙醇中的水对醇解会产生阻碍作用,因为水的存在使反应体系内产生CH3COONa,消耗了NaOH,而NaOH在此是起催化作用,因此要严格控制乙醇中的水的含量。
10
三.主要仪器和试剂
实验仪器: 250ml三口瓶一个、回流冷凝管一个、搅拌器一个、100ml滴液漏斗一个
实验试剂:醋酸乙烯酯、氢氧化钠(NaOH)、乙醇、偶氮二异丁腈(AIBN)
四.实验步骤
1. 聚醋酸乙烯酯(PVAc)的制备: 如图1-1搭好装置,在250ml
三口烧瓶中加入20g乙醇、40g醋酸乙烯酯和0.05g偶氮二异丁腈,开始搅拌。当偶氮二异丁腈完全溶解后,升温至60±2℃,在此温度下反应3小时,加入40g乙醇备醇解用。
2. 将大部分聚合物溶液倒入回收瓶中,反应瓶内留下约15g。用
15ml乙醇将瓶口处的溶液冲净。
3. 醇解:在反应瓶中加入85ml乙醇。开动搅拌,使聚合物溶解
均匀后,在25℃下慢慢滴加5%的NaOH/乙醇溶液2.8ml(约2秒/滴)。仔细观察反应体系,约1-1.5小时发生相转变。这时再滴加1.2ml的NaOH/乙醇溶液,继续反应1小时,用布氏漏斗抽滤,所得聚醋酸乙烯酯(PVA)为白色沉淀,分别用15ml乙醇洗涤3次。产品放在表面皿上,捣碎并尽量散开,自然干燥后放入真空烘箱中,在50℃下干燥1小时,再称重。
五. 注意事项
为避免醇解过程中出现冻胶甚至产物结块,催化剂的递加速度要慢,并分两次加入。如反应过程中发现可能出现冻胶时,应加快搅拌速度,并适当补加一些乙醇。
11
实验五 苯乙烯与马来酸酐的交替共聚合
一、实验目的
了解共聚合的基本原理和实验方法。
二、实验原理
带强推电子取代基的乙烯基单体与带强吸电子取代基的乙烯基单体组成的单体对进行共聚合反应时容易得到交替共聚物。关于其聚合反应机理目前有两种理论:“过渡态极性效应理论”认为在反应过程中,链自由基和单体加成后形成因共振作用而稳定的过渡态。以苯乙烯/马来酸酐共聚合为例,因极性效应,苯乙烯自由基更易与马来酸酐单体形成稳定的共振过渡态,因而优先与马来酸酐进行交叉链增长反应;反之马来酸酐自由基则优先与苯乙烯单体加成,结果得到交替共聚物。
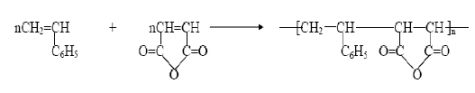
“电子转移复合物均聚理论”则认为两种不同极性的单体先形成电子转移复合物,该复合物再进行均聚反应得到交替共聚物,这种聚合方式不再是典型的自由基聚合。
当这样的单体对在自由基引发下进行共聚合反应时:(1)当单体的组成比为1:1时,聚合反应速率最大;(2)不管单体组成比如何,总是得到交替共聚物;(3)加入Lewis酸可增强单体的吸电子性,从而提高聚合反应速率;(4)链转移剂的加入对聚合产物分子量的影响甚微。
三、主要药品与仪器
甲苯 75mL
12
苯乙烯 2.9mL
马来酸酐 2.5g
AIBN 0.005g
装有搅拌器、冷凝管、温度计的三颈瓶 1套
恒温水浴 1套
抽滤装置 1套
四、实验步骤
在装有冷凝管、温度计与搅拌器的三颈瓶中(如图1-1)分别加入75mL甲苯、2.9mL新蒸苯乙烯、2.5g马来酸酐及0.005gAIBN,将反应混合物在室温下搅拌至反应物全部溶解成透明溶液,保持搅拌,将反应混合物加热升温至85~90℃,可观察到有苯乙烯-马来酸酐共聚物沉淀生成,反应1 h后停止加热,反应混合物冷却至室温后抽滤,所得白色粉末在60℃下真空干燥后,称重,计算产率。比较聚苯乙烯与苯乙烯-马来酸酐共聚物的红外光谱。
五、思考题
试推断以下单体对进行自由基共聚合时,何者容易得到交替共聚物?为什么?
(a) 丙烯酰胺/丙烯腈;(b)乙烯/丙烯酸甲酯;(c)三氟氯乙烯/乙
基乙烯基醚
13
实验六 双酚A型低分子量环氧树脂的制备 凡分子中含有环氧基团的树脂统称为环氧树脂,其品种繁多。工业上考虑到原料来源和产品价格等因素,最广泛应用的环氧树脂是由环氧氯丙烷和双酚A(4,4-二羟基二苯基丙烷)缩聚而成的双酚A型环氧树脂。它是采用逐步聚合方法制备的高分子化合物的重要代表。 环氧树脂具有良好的物理与化学性能,它对金属和非金属材料的表面具有优异的粘结性能。此外它的固化过程收缩率小、耐腐蚀、介电性能好、机械强度高、对大部分碱和溶剂稳定。这些优点为它开拓了广泛的用途,目前已成为最重要的合成树脂品种之一。
制造清漆是环氧树脂最早也是至今环氧树脂最重要的用途之一,工业上还大量采用环氧树脂制备粘合剂、浇铸塑料、层压塑料和电绝缘材料。环氧树脂除了单独使用外,还常常用来改善其他聚合物的性能。如对酚醛树脂、脉醛树脂、密胺树脂、聚酰胺、聚氯乙烯、氯醋树脂等均有良好的改性作用。
一、目的要求
深人了解逐步聚合的基本原理。
熟悉掌握环氧树脂合成的基本操作。
二、实验原理
以双酚A和环氧氯丙烷为原料合成环氧树脂的反应机理属于逐步聚合反应,一般认为它们在氢氧化钠存在下不断进行开环和闭环的反应。反应方程式可表示如下:
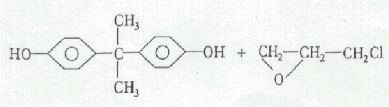
14
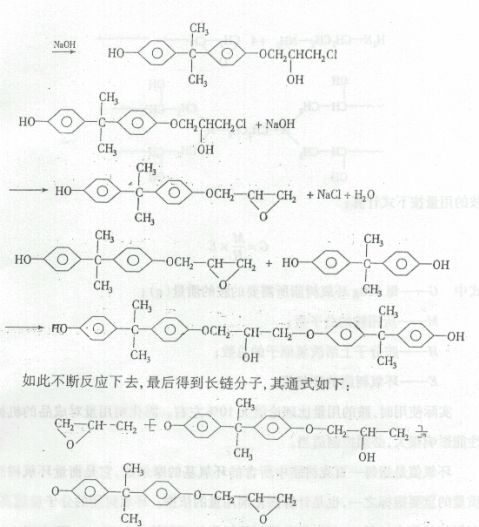
式中,n为聚合度。当平均聚合度n<2时,树脂呈液体状态,称为低分子量树脂;n>2时,树脂呈固体状态,称为高分子量树脂。本实验合成的是低分子量环氧树脂。
环氧树脂本身是热塑性的线型分子,不能直接使用,必须用固化剂使环氧树脂分子链交联成网状结构的大分子,才能显示出它的特有性能。
环氧树脂的固化剂种类很多,多元胺类是最常用的品种。以室温固化的乙二胺为例,它按下列历程进行固化反应:
15
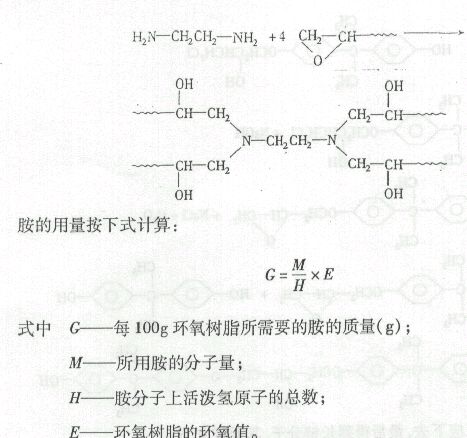
实际使用时,胺的用量比理论值大10%左右。固化剂用量对成品的机械性能影响很大,必须控制适当。
环氧值是指每一百克树脂中所含的环氧基的摩尔数,它是衡量环氧树脂质量的重要指标之一,也是计算固化剂用量的依据。环氧树脂的分子量越高,环氧值就相应越低。一般,低分子环氧树脂的环氧值在0.48~0.57之间。
分子量小于1500的环氧树脂,其环氧值可用盐酸一丙酮法测定,高分子量的则可用盐酸一毗毗咤法测定。
三、主要仪器与药品
标准磨口三颈瓶(250tn1/24mm x 3)一只;球形冷凝器(300mtn)一支;直形冷凝器(300mm)一支;滴液漏斗(60耐)一只;分液漏斗(250耐)一只,温度计(100℃、200℃)各一支;接液管一只;具塞锥形瓶(250m1)四只;量筒(100 cnl)一只;容量瓶(100 ml)一只;烧杯(800m1)两只、(50m1)一只;刻度吸管(10 ml)一支; 16
移液管(巧而)一支;碱式滴定管(50 ml)一支;广口试剂瓶(100耐)一只;电动搅拌器一套。
双酚A(4,4-二羟基二苯基丙烷);环氧氯丙烷;氢氧化钠;甲苯;盐酸;丙9-1;氢氧化钠标准溶液,l mol/l;酚酞指示剂,0.1%乙醇溶液。
四、实验步骤
1.环氧树脂合成
1)将三颈瓶称重并记录。将双酚A34.2g(0.15mo1)和环氧氯丙烷42g(0. 45mo1)依次加人三颈瓶中,按图6(a)装好仪器。用水浴加热,搅拌下升温至70℃一75℃,使双酚A全部溶解。
2)用12g氢氧化钠加30 ml去离子水,配成碱液。用滴液漏斗向三颈瓶中滴加碱液,开始必须加得很慢,以防止因反应物浓度过大而凝成固体,难以分散。此时反应放热,体系温度自动升高,可暂时撤去水浴,并调节碱液滴加速度,使温度控制在75℃。
3)滴加完碱液,将聚合装置改成如图6(b)所示。在75℃下回流
1.5h(温度不要超过80℃),体系呈现乳黄色。
4)加人去离子水45 ml,甲苯90ml,搅拌均匀后,倒入分液漏斗中,静止片刻。待液体分层后,分去下层水层。重复加人去离子水30ml,甲苯60ml,剧烈摇荡。然后静止片刻,分去水层。再用60~70℃温水按上法洗涤两次,上层有机相转入如图2(c)的装置中。
5)减压下蒸馏除去溶剂甲苯和未反应的环氧氯丙烷,得淡黄色粘稠树脂。
6)将三颈瓶连树脂称重,计算产率。所得脂倒人试剂瓶中备用。
2.环氧值测定
1)用刻度吸管吸取盐酸1.6ml,置于100ml容量瓶中,用丙酮稀释至刻度,即配成0. 2mo1/1的盐酸-丙酮溶液。
17
2)在锥形瓶中准确称取(0.3~0.5)g环氧树脂(精确到l mg),用移液管吸取15ml盐酸-丙酮溶液,塞上塞子,摇动使树脂溶解。放置阴暗处1h,加酚酞指示剂三滴,用0.lmol/1氢氧化钠标准溶液滴定至粉红色为终点。平行试验一次,并作空白试验一次。
3)环氧值E计算公式:

图2环氧树脂合成装置
3.粘接实验
环氧树脂作为粘合剂使用时,除需加人固化剂外,还常根据不同 18
要求加人一些其他组分,如稀释剂等。同时,为达到好的粘接效果,对被接样品进行表面处理(机械法和化学法两种处理方法)。如被粘接样品是玻璃,可将玻片放在70℃洗液中浸泡10~15min,然后用水洗净、低温烘干。
本实验以乙二胺作固化剂(参见附注),被粘接样品为木料、铁片。固化剂用量(理论值)可按下式计算:W=(M/H)EPV
式中,W为100g树脂所需固化剂的量(g);M为固化剂的mol质量(g/mol);H为固化剂分子中活性氢数目;EPV是树脂的环氧值。粘接试验的操作如下:
准备两小块木片和两小块铁片,将待粘接的表面用沙纸打过擦尽,涂上一层配好的环氧树脂粘合剂,迭合后,压紧,放在实验柜中,数天后检验其粘接强度。
附注
乙二胺是常用的固化剂,但用它来固化的环氧树脂是脆性材料。为克服其脆性,常同时加进一步柔性低分子量的聚合物,这样的环氧树脂固化物有一定的柔韧性。
五、注意事项
1.在环氧树脂制备过程中,碱液滴加速度应根据体系温升情况和反应物凝聚情况来调整。若发生凝聚现象,可暂停滴加,等凝聚物溶解后再继续滴加。
2.环氧树脂甲苯溶液蒸馏时,最终温度不可超过120℃。否则,树脂易焦化而发黑,影响质量。
3.用于环氧值测定的盐酸一丙酮溶液须现配现用。不需标定。 19
实验七 乙酸纤维素的制备
一、目的要求
(1)掌握乙酸纤维素的制备方法。
(2)了解纤维素的结构特征。
二、实验原理
纤维系是由葡萄糖分子缩合而成的高分子化合物。葡萄糖是一个
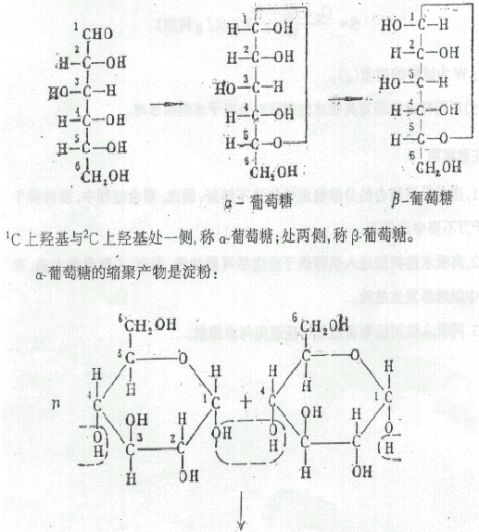
六碳糖,其第五个碳原子上的羟基与醛基形成半缩醛,产生两种构型 20
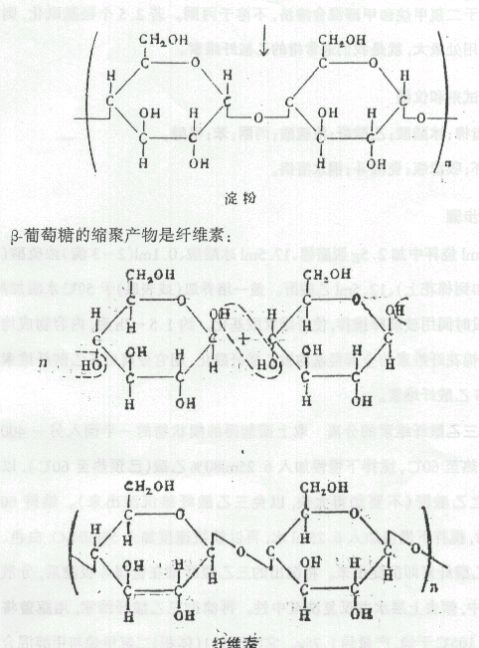
本实验将棉花(几乎是纯净的纤维素)用乙酸酐进行乙酰化制备乙酸纤维素。纤维素分子间由于有众多羟基,因氢键使大分子链间有很强作用力,从而不溶于有机溶剂,加热亦不能使它熔化,从而限制了它多方面的应用。
若将纤维素分子上的羟基乙酰化,减少大分子间氢键作用,根据酰化的程度,使它可溶于丙酮或其它有机溶剂,从而使纤维素的应用范围大大扩展。
构成纤维素的每个葡萄糖分子上有三个羟基,若都酰化就是三乙 21
酸纤维素,它溶于二氯甲烷和甲醇混合溶剂,不溶于丙酮。若2.5个羟基酰化,则溶于丙酮,用处最大,就是我们通常指的乙酸纤维素。
三、主要试剂和仪器
脱脂棉;冰醋酸;乙酸酐;浓硫酸;丙酮;苯;甲醇。
烧杯;吸滤瓶;瓷漏斗;铜水浴锅。
四、实验步骤
400ml烧杯中加2.5g脱脂棉、17.5m1冰醋酸、0.1m1(2-3滴)浓硫酸(不得直接加到棉花上)、12.5m1乙酸酐。盖一培养皿(或表皿)于50℃水浴加热。每隔一段时间用玻璃棒搅拌,使纤维素酰基化。约
1.5~2h后,内容物成均相糊状物,棉花纤维素的全部羟基均被乙酸酐酰化,用它分离出三乙酸纤维素和制备2.5乙酸纤维素。
(1)三乙酸纤维素的分离 取上面制得的糊状物的一半倒人另一400 ml烧杯,加热至60℃,搅拌下慢慢加人6.25 ml 80%乙酸(已预热至60℃),以破坏过量之乙酸酐(不要加得太快,以免三乙酸纤维沉淀出来)。维持60℃15min后,搅拌下慢慢加人6.25m1水,再以较快速度加人50m1H2O,白色、松散的三乙酸纤维素即沉淀出来。将沉出的三乙酸纤维在瓷漏斗吸滤后,分散于75ml水中,倾去上层水并反复洗至中性。再滤出三乙酸纤维素,用瓶盖将水压干,于105℃干燥,产量约1.75g。它溶于9:1(体积)二氯甲烷与甲醇混合溶剂中,不溶于丙酮及沸腾的1∶1(体积)苯-甲醇混合物。
(2)2.5乙酸纤维素的制备将另一半糊状物于60℃,搅拌下慢漫倒入12.5 m1 70%乙酸(已预热至60℃)及0.035 ml (1-2滴)浓硫酸的混合物中,于60℃水浴加热2h,使三乙酸纤维素部分皂化,得2.5乙酸纤维素。之后加水、洗涤,吸滤等操作与三乙酸纤维素制备的相同。产量约1.5g,它溶于丙酮及1∶1苯-甲醇混合溶剂。
五、说明
制备三乙酸纤维素时,浓硫酸不可直接滴在棉花上。等冰醋酸、乙酸酐将棉花浸润后或直接加人冰醋酸滴人。
六、思考题
(1)试计算本实验中纤维素羟基与乙酸酐之摩尔比。乙酸酐过量多少?破坏这些乙酸酐需用多少水?
22
(2)计算本实验的产率并列出溶解度试验结果。
附录:
一、试剂纯化和仪器的洗涤和干燥
实验室内制备聚合物,可以通过各种聚合反应来实现。所有聚合反应的一个共同特点是对于杂质非常敏感。因此,在聚合物的制备过程中,须特别注意对试剂的纯度要求,并采取相应的方法来纯化试剂,才能够高产率地获得高分子量的聚合物。
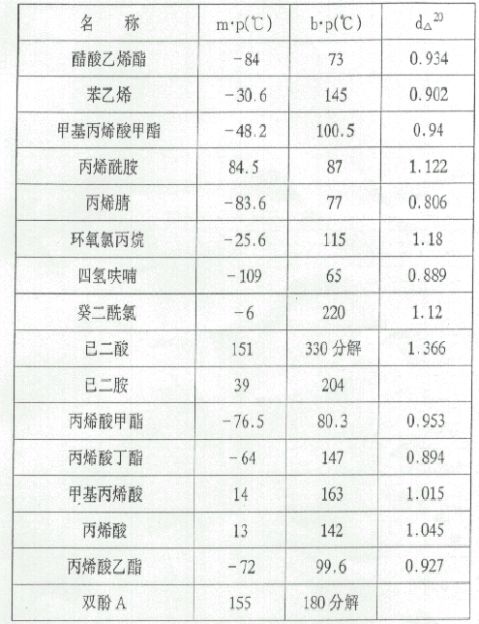
1.单体的精制也贮存
单体是指在聚合反应中用以形成聚合物的低分子物质。在聚合反应中,单体的纯度非常重要,有时数量级仅为10-4-10-16的杂质存在也会大大影响反应进程和产物的质量。因此,在反应前检验所用单体的纯度,并采取相应的纯化措施常常是必不可少的步骤。
单体中的杂质来源一般有以下三个方面:一是单体的制备反应过程中产生的副产物。无论是烯类单体,还是缩聚反应用的官能团单体,在其制备分离过程中,或多或少会残留一些副产物。但作为试剂级的商品单体,这部分杂质的影响并不十分重要。二是为了防止某些单体(烯类)在运输和贮存过程中发生聚合,常加人少量的阻聚剂(稳定剂)。这种人为加人的阻聚剂在单体使用之间通常要除去。三是在单体存放和转移过程中自身氧化、分解或聚合的产物(如双烯中的过氧化物,苯乙烯中的苯乙醛,丙烯腈中的氰化氢等)。
单体的类型和单体的原有纯度往往是不同的,不同类型的聚合反应对于单体纯度的要求也常常不同,所以不可能有精制单体的完全统一方式。如自由基聚合反应,可以在大量水介质中进行悬浮聚合和乳液聚合,而对于离子型聚合和配位聚合,少量的水、醇等都将显著地影响反应的进行。在用BF3催化异丁烯的正离子聚合和用烷基铝催化的配位聚合反应中,微量的水可以起到助催化剂的作用。然而稍过量的水却会使催化剂失效,或者水与活性链链端反应成为链终止剂。这样,自由基聚合反应和配位聚合反应对单体中的含水量就会有完全不同的要求。因而单体的纯化只能根据实际要求选择适当的方法。
聚合反应中所用的单体、引发剂、溶剂和其它助剂多数是低分子量的有机化合物。其纯化和精制方法也就和纯化其它的有机化合物相类似。固体单体多用重结晶或升华的方法,如制备聚酰胺一66所用的单体已二酸和已二胺,制备不饱和聚醋用的酸酐以及丙烯酰胺等采 23
用重量结晶的方法来进行纯化。
大部分烯类单体在贮存和运输过程中加人少量(几到几百ppm)的酚类、胺类、硝基化合物等阻聚剂,由于它们都具有一定的挥发性,若单纯采用蒸馏的方法,很难将它们完全除尽,常会有少部分阻聚剂进人新蒸的单体中。要彻底附去这些阻聚剂,可用稀碱或稀酸先行洗涤非水溶性单体,使阻聚物质与碱或酸作用后而进人水相中并与单体相分离。分离出的单体经反复水洗并干燥后,进行常压或减压蒸馏就可以获得不含阻聚剂的单体。但有时在最后一步的蒸馏操作中,为防止被蒸单体在蒸馏瓶中发生热聚合,还需要先加人少量CuCl等挥发性小的阻聚剂再进行蒸馏。蒸馏沸点较高的单体时,为了避免在蒸馏过程中发生热聚合,总是采用减压蒸馏的方法。为减少单体的热氧化反应和降低纯化单体中的溶解氧,蒸馏操作常在惰性气体(如N2)的保护下进行。在惰性气氛下经过多次减压蒸馏,可以得到高纯度的单体。例如在N2保护下,以铜屑作为阻聚剂,进行多次蒸馏,可得到能用于离子型聚合的单体。
若要除去烃类单体中微量的水分,可将单体与活性氧化铝、金属氢化物或碱金属先一起进行回流而后蒸出单体。
单体中若含有作为杂质存在的直链烯烃时,可用浓硫酸洗涤除去。 特别高纯的单体也可以用预聚合的方法得到。用加热、辐射或必要时加人引发剂的方法使已经初步纯化的单体进行聚合。至转化率达10--20%时在惰性气体保护下将未聚合的单体蒸馏出来。因为这时体系中的绝大部分杂质已被引发剂或聚合物活性链作用掉了,这就保证了蒸出的单体具有很高纯度。
要测定单体的纯度,在单体中所含杂质量很小的情形下并不是一件十分容易的事情,因为这时诸如沸点、折光指数等物理常数在测定往往不足以反映微量杂质的存在。气相色谱分析常常能获得令人满意的结果。
在进行聚合反应动力学研究的实验中,要研究所用单体是否存在有害杂质,最有把握的方法是进行试验性聚合。即将单体反复多次精制,直到在相同的条件下所得的聚合实验结果完全一致。这时可以认为有害要质已经完全除尽。
实验中所用单体应在临用前加以纯化,纯化后及时作用,一时未用完的单体,可暂存放于冰箱内,最好同时充从避光保存。在精制后短期内还不使用的烯类单体,需要加人0.1~1%的阻聚剂(常用对苯 24
二酚)再保存。
2.溶剂和引发剂的精制
对于单体的纯度标准,即对于有害杂质的含量要求,应同时适用于聚合反应中所用的各种溶剂和其它稀释剂。这些试剂也需要进行必要的纯化处理。一般可参照有机化学中有机试剂的纯化方法。对用于离子型聚合或配位聚合中的溶剂,常将它们从过量的催化剂中蒸出。例如四氢呋喃从萘钠中蒸出,苯从丁基铿中蒸出。
自由基型引发剂是一些有机或无机小分子化合物,它们很容易裂解成为自由基。典型的自由基引发如过氧化苯甲酰(BPO)和偶氮二异丁睛(AIBN)的化经方法常常选择重结晶,重结晶操作可以在甲醇或其它一些适宜的溶剂中进行。经过重结晶的引发剂应在较低温度下真空干燥。
离子型催化剂有正离子催化剂和负离子催化剂二类。负离子型催化剂如碱金属烷基锉、萘钠,二苯甲酮二钠等常常含有金属-碳健,这种金属-碳键极易被H2O、CO2、O2 、醇、胺和酸类破坏。正离子型催经剂除质子酸外还有非质子路易斯(Lewis)酸, 尽管这些路易斯酸需要有痕量的H2O,HCl等作为共催化剂,但稍过量的这类物质的存在却会抑制反应的进行。所以对于这些催化剂都应有较高的纯度要求。
催化剂和引发剂都应保存于阴凉干燥的暗处。
3.仪器的洗涤和干燥
在合成聚合物的实验过程中,洗涤和干燥仪器是一件十分重要而又是比较费时的工作,仪器的洁净与否往往能影响实验的成败。和大多数的无机及有机化学实验相比,聚合物合成实验对仪器的洁净程度有着更高的要求。
盛放过聚合产物的容器往往比较难洗,而搁置过久则更加难洗,因而一定要养成器具用完及时洗洗的好习惯。清洗仪器的原则是先尽量除尽聚合物。一般是每次只加少量溶剂,非磨口仪器可用毛刷和去污粉擦洗。对于那些用一般酸碱难除尽的残留物,或污染面不易触及的玻璃仪器(如容量瓶、膨胀计),洗液是相当有效的清洗剂。用热硝酸或热洗液来洗涤效果更好,但必须注意安全操作,可将装有洗液的容器放在搪瓷盘中或不锈钢盘中于烘箱内加热。或在通风橱中于水浴上加热盛水硝酸的容器,而后再用水反复冲洗干净。
洗净后的仪器可以晾干或烘干,烘干仪器除烘箱外,可以倒置玻 25
璃仪器的
气流干燥器的使用也很普遍。临时急用的仪器常用电吹风吹干。加人少量乙醇或丙酮荡涤水洗过的器皿可以加速吹干过程。
对于某些需要特别干燥的实验装置,可以在装置调装好以后,于高真空下加热除去玻璃仪器内壁吸附的水汽。
26
