福建农林大学考试试卷 (B)卷
20##——2010 学年第一学期
课程名称: 基础化学实验 考试时间 90分钟
专业 年级 班 学号 姓名

1.见光易分解的溶液,盛放时所用的器皿是( )
A、无色广口试剂瓶 B、无色细口试剂瓶 C、棕色细口试剂瓶 D、棕色广口试剂瓶
2.升华提纯咖啡因时,升华温度应控制在( )
A、120°C~238°C B、120°C~178°C C、178°C~238°C D、100°C~120°C
3.用镁试剂鉴定Mg2+离子时,适宜的酸度是 ( )
A、NH3-NH4Cl pH≈9 B、HAc-NaAc pH≈5
C、强碱性 D、强酸性
4.下列操作违反了实验室规则的是( )。
A、试剂应按规定用量取用,自瓶中取出后未用完的试剂可倒回原瓶中。
B、实验时,火柴梗、废纸屑、废液等应投入垃圾箱或废液缸中。
C、实验完毕后将玻璃仪器洗涤干净,放回原处。
D、实验完毕后必须检查电插头或闸刀是否拉开,水龙头是否关闭等。
5.下列是离心操作时的注意事项,请问哪一项是错误的( )
A、离心管所盛液体质量相同,体积相当
B、离心机的转速控制是开始时由慢到快
C、离心管应对称放入,保证离心机平衡
D、关闭电源,即可取出离心管
6.使用水蒸汽蒸馏提纯的有机物不必具备的条件是:( )
A、不溶或难溶于水
B、与水长时间煮沸不发生化学反应
C、在100°C左右时,待提纯物应具有一定的蒸汽压
D、易溶或可溶于水
7.在粗食盐的提纯实验中,除掉了SO42- Ca2+、Mg2+和多余的 Ba2+和 CO32-后,将溶液蒸发至稀糊状(切勿蒸干!)后冷却、过滤。在此,“切勿蒸干”的目的是( )
A、便于烘炒 B、便于抽滤
C、除去K+离子 D、除去少量的Ca2+、Mg2+离子
8.水蒸汽蒸馏提取烟碱时,为什么要用NaOH中和至明显碱性( )
A、中和杂质酸 B、生成不溶性的沉淀
C、使烟碱游离出来 D、中和烟碱
9.已知K?sp(AgCl) = 1.77×10-10,K?sp (AgBr) = 5.35×10-13,K?sp (Ag2CrO4) = 1.12×10-12。某溶液中含有KCl、KBr和K2CrO4,c(KCl)=c(KBr)=c(K2CrO4)=0.001mol·L-1,向该溶液中逐滴加入0.01mol·L-1的硝酸银溶液时,最先和最后产生的沉淀是( )
A . AgBr、Ag2CrO4 B. Ag2CrO4、AgCl C. AgBr、AgCl D. AgCl、AgBr
10.用pH试纸测定某无色溶液的pH时,规范的操作是( )
A、将pH试纸放入溶液中,跟标准比色卡比较
B、将溶液倒在pH试纸上,跟标准比色卡比较
C、用干燥的洁净玻璃棒蘸取溶液,滴在pH试纸上,跟标准比色卡比较
D、在试管内放入少量溶液,煮沸,把pH试纸放在管口上,观察颜色,跟标准比色卡比较
11.用移液管吸取溶液时(已用溶液润洗三次),调节液面至标线的正确方法是 ( )
A、保持移液管的管尖在液面下调节至标线
B、将移液管提高离开液面并使管尖紧贴放置溶液器皿的内壁并调至标线
C、将移液管移出液面,悬空调至标线
D、移液管移至水槽上调至标线
12.下列仪器在量取或配制标准溶液前不需要润洗的是( )
A、吸量管 B、移液管 C、滴定管 D、容量瓶

1.实验室起小火时,要立即进行灭火,同时要防止火势扩展,切断电源,移走易燃物品。灭火方法要根据起火原因选用合适的方法。若遇有机溶剂(如酒精、苯、汽油、乙醚等)引起着火应 ,即可灭火。切勿泼水,泼水反而使火蔓延开。若遇电器设备着火,必须先 ,只能使用 灭火器灭火,不能使用___________灭火器,以免触电。
2.洗净后的移液管或吸量管移液前必须用_________吸净尖端内、外的残留水,然后用待移液润洗________次,以防改变溶液的浓度。移液时,将润洗好的移液管或吸量管插入待取溶液的液面下 处,一手的拇指与中指拿住移液管标线以上部分,另一手拿洗耳球。当液面上升至标线以上时,拿掉洗耳球,立即用 堵住管口,将移液管提出液面,移液管保持 ,容器倾斜。放液时接受容器倾斜,移液管保持直立,使移液管的下端与容器内壁上方 ,松开食指,让溶液自由流下,当溶液流尽后,再停15 秒,并将移液管向左右转动一下,取出移液管。
3.蒸馏是加热物质 ,使之 ,再冷凝成 ,并于另一容器中收集冷凝液的操作过程。它是 液态有机化合物最常用的方法之一。
4.常用的过滤方法有 、 和 。
5.色谱法又称色层法、层析法,是分离、提纯和鉴定化合物的重要方法之一。其基本原理是利用混合物各组分在某一物质中的 的不同,或其亲和性能的差异,使混合物的各组分随着流动的液体或气体(称 ),通过另一种固定不动的固体或液体(称 ),进行反复的吸附或分配作用,从而使各组分分离。根据操作条件不同,又可分为柱色谱 、纸色谱、薄层色谱、气相色谱和高效液相色谱等。纸色谱分析中,单独氨基酸的Rf与在混合液中该氨基酸的Rf (相同或不同)。
6.水蒸气蒸馏的过程中,热源要稳定,否则会产生 现象,停止加热前一定要将_______ 打开,再移去 ,以防止 。
7.在熔点测定实验中,装样高度一般为 ;温度计水银球应位于 ,而毛细管中样品应处于 。
8.分步沉淀的次序为:需要沉淀剂浓度 的难溶电解质先析出沉淀。沉淀转化的方向为:溶解度 的难溶电解质沉淀转化为溶解度 的难溶电解质沉淀。
9.利用KSCN检验Fe3+时,反应应在 (酸性、碱性、中性)介质中进行,目的是防止 。
10.介质酸度对氧化还原反应产物会产生影响。KMnO4与Na2SO3反应,KMnO4的还原产物在酸性条件下是无色或肉色的 ;在中性介质中是棕褐色的 沉淀;在强碱性条件下是深绿色或墨绿色的 。
1.请在下面空白处画出烟碱提取实验中水蒸气蒸馏的实验装置图。
2.请在下列实验装置图的下面标出装置图和仪器的名称。


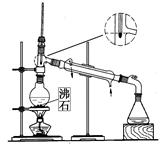
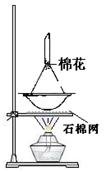
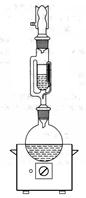
(1) 装置(2分) (2)__________装置(2分)(3)__________装置(2分)
A:_____________(1分) B:____________(1分)
1.提纯粗食盐时,如何用BaCl2、NaOH、Na2CO3、HCl溶液去除其中的K+、Ca2+、Mg2+、SO42-和不溶性杂质?
2.重结晶时溶剂的选用依据有哪些?重结晶时溶剂为什么不能用得太多或太少?
3.纸色谱分离氨基酸中在滤纸条上记录原点位置时,为什么用铅笔而不用钢笔?为什么纸色谱点样点的直径不得超过0.3 cm?展开剂中,为什么要含有一定比例的水?纸色谱的展开为何要在密闭的容器中进行?
4.下列各种情况对熔点的测定有何影响(应指出对熔点、熔程测定结果的影响)?
(1)毛细管未完全熔封;2)毛细管不大干净;3)升温太快;4)样品装得不紧密;5)毛细管壁太厚;6)样品位置未与水银球对齐。
第二篇:四川省绵阳南山中学20xx-20xx学年上学期高一年级1月学业水平测试化学试卷(B)(通用版)
四川省绵阳南山中学20##-20##学年上学期高一年级1月学业水平测试
化学试卷(B)
命题:庞涛 审题:杨先美 审核:王斌
(考试时间90分钟,满分100分)
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Cl-35.5 Na-23 Ag-108
第Ⅰ卷(选择题,共50分)
一、选择题(本题包括10小题,每小题2分,共20分。每小题只有一个选项符合题意)
1. 下列措施不能达到节能减排目的的是
A.利用太阳能制氢燃料 B.利用潮汐能发电
C.用家用汽车代替公交车 D.用节能灯代替白炽灯
2. 下列物质属于强电解质的是:①HClO ②CH3COOH ③NaHCO3 ④CO2 ⑤酒精 ⑥H2SO4 ⑦CaCO3
A.①②④ B.③⑥⑦ C.②⑤⑦ D.①③④⑥
3. 下列反应为吸热反应的是
A.C与CO2 B.Na2O2与H2O C.H2与Cl2 D.K与H2O
4. 已知反应:X+Y===M+N为放热反应,对该反应的下列说法中正确的是
A.X的能量一定高于M B.X和Y的总能量一定高于M和N的总能量
C.Y的能量一定高于N D.X和Y的总能量一定低于M和N的总能量
5. 下列变化需加入氧化剂才能实现的是
A.CO2-3 →HCO-3 B.2I-→I2 C.MnO-4→Mn2+ D.Cl2→HCl
6. 下列关于碱金属的叙述正确的是
A. 碱金属单质都可保存在煤油中
B. 碱金属着火时,可用水或泡沫灭火剂灭火
C. 碱金属离子半径比对应的原子半径小
D. 碱金属中密度最小,熔沸点最低的是金属铯
7. 某电解质溶液中,含有Na+、Cl-、SO2-4 、Al3+四种离子,已知Na+、Al3+、SO2-4 离子数目之比为2:1:1,则Na+与Cl-个数比为
A.2:3 B.1:1 C.2:1 D.1:3
8. 下列氧化还原反应中,水作为氧化剂的是
A. CO+H2O高温====CO2+H2 B. 3NO2+H2O===2HNO3+NO
C. 2Na2O2+2H2O===4NaOH+O2↑ D. 2F2+2H2O===4HF+O2
9.关于碱金属单质的性质叙述错误的是
A.熔沸点随原子序数增加而降低
B.还原性随原子电子层数的增加而增强
C.与水反应都能生成碱和氢气
D.在空气中燃烧的生成物都是过氧化物
10.卤族元素(从氟到碘)性质的递变规律正确的是
A.单质的密度逐渐减小,颜色逐渐加深 B.单质的氧化性逐渐增强
C.简单阴离子的还原性逐渐减弱 D.氢化物的稳定性逐渐减弱
二、选择题(本题包括10小题,每小题3分,共30分。每小题只有一个选项符合题意)
11. 下列各组离子,能在溶液中大量共存的是
A.K+、H+、ClO-、I- B.Na+、H+、Ca2+、HCO-3
C.H+、Fe2+、SO2-4 、Cl- D.Ca2+、Ag+、NO-3、Br-
12. 下列反应可用离子方程式2H++CO2-3 ===CO2↑+H2O表示的是
A. 碳酸钡与盐酸 B. 碳酸钠与稀硫酸
C. 碳酸氢钠与硝酸 D. 碳酸氢钙与盐酸
13. 下列说法正确的是
A. 同温同压下,同体积的氧气与空气所含原子数相等
B. 在标准状况下,1 mol任何气体所含分子数都约为6.02×1023
C. 当温度高于0 ℃,1 mol任何气体的体积都大于22.4 L
D. 当压强大于101 kPa时,1 mol任何气体的体积都小于22.4 L
14. 下列实验现象描述正确的是
A. 氢气在Cl2中燃烧产生白色的烟
B. 碘水中加入少量汽油振荡,静置后上层颜色变浅,下层颜色变为紫色
C. 往溴水中加入碘化钠溶液,溴水变为无色
D. 红热的铜丝在氯气中燃烧,产生棕黄色的烟
15. 下列叙述正确的是
A. 氧化还原反应的本质是化合价发生变化
B. 有单质产生的分解反应一定是氧化还原反应
C. 氧化剂在同一反应中既可以是反应物,也可以是生成物
D. 还原剂在反应中发生还原反应
16. 在甲、乙、丙三种溶液中各含有一种离子:Cl-、Br-、I-,向甲溶液中加入淀粉溶液和氯水时,溶液变为橙色;再加入丙溶液,溶液颜色无明显变化。则乙溶液中含有的离子
A.Cl- B.Br- C.I- D.无法判断
17. 能正确表示下列反应的离子方程式是
A. 用小苏打治疗胃酸过多:CO2-3 +2H+===CO2↑+H2O
A.碳酸氢钙溶液和氢氧化钠溶液混合:HCO-3 +OH-===CO2-3 +H2O
B.醋酸钠溶液和盐酸混合:CH3COONa+H+===CH3COOH+Na+
D.硫酸铜溶液和氢氧化钡溶液混合:
Cu2++SO2-4 +Ba2++2OH-===Cu(OH)2↓+BaSO4↓
18. 将等质量的纯碱(Na2CO3)和小苏打(NaHCO3)分别加入到相同浓度的足量盐酸中,结果是
A.纯碱消耗的盐酸较多,产生的气体较多
B.纯碱消耗的盐酸较少,产生的气体较少
C.小苏打消耗的盐酸较少,产生的气体较多
D.小苏打消耗的盐酸较多,产生的气体较少
19.由CO2、H2和CO组成的混合气体在同温,同压下与N2的密度相同,则该混合气体中CO2、H2和CO的体积比为
A.13:8:29 B.22:1:14 C.29:8:13 D.26:8:1
20. 将a g钠投入b g水中(足量水),反应后所得溶液中溶质的质量分数是
A. B.
B.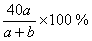
C.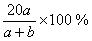 D.
D.
第Ⅱ卷(非选择题,共50分)
三、填空题(本题包括4小题,共16分)
21.(3分)工业上制取漂白粉的化学方程式为 ,漂白粉的有效成分是(写名称) ,向其溶液中通入少量CO2,反应的化学方程式是 。
22.(4分)二氧化碳气体通过过氧化钠粉末时,发生反应的化学方程式是: ,当反应前后固体质量增加2.8 g时,转移电子的数目是 。
23.(2分)若空气中各成分按体积计算大约是N2 80 %、O2 20 %,则空气中O2的质量分数为 。
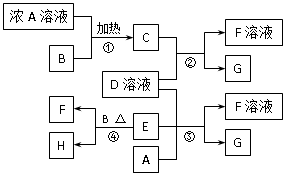 24.(7分)有关物质存在如图所示的转化关系(部分产物已省略)。通常C、H均为气体单质,G为紫黑色固体单质,B为黑色粉末,在反应④中作催化剂。F溶液的焰色反应呈紫色(隔蓝色钴玻璃观察)。请回答下列问题:
24.(7分)有关物质存在如图所示的转化关系(部分产物已省略)。通常C、H均为气体单质,G为紫黑色固体单质,B为黑色粉末,在反应④中作催化剂。F溶液的焰色反应呈紫色(隔蓝色钴玻璃观察)。请回答下列问题:
(1)H的化学式是 ,
反应②的离子方程式是:
。
(2)反应①的化学方程式为:
。
(3)D溶液与AgNO3溶液混合可形成___ _色沉淀,其离子方程式为:
。
(4)反应③的氧化剂是 ,氧化产物是 。
四、实验题(本题包括3小题,共24分)
25.(6分)现有溶质的质量分数为36.5%,密度为1.19 g/cm3的盐酸,需要配制2 mol·L-1的盐酸250 mL。
(1)需量取该浓盐酸_____ _mL。
(2)该实验所需要的仪器有______________ __。
(3)下列操作使配得溶液浓度偏高的是(填序号)_______ __。
A. 稀释浓盐酸的烧杯不干燥
B. 把溶液从烧杯转移到容量瓶里时,不慎流到瓶外数滴
C. 洗净的容量瓶底部残留蒸馏水
D. 定容时俯视液面使之与刻度线相切
26.(6分)某钠盐溶液可能含有阴离子NO-3,CO2-3 ,SO2-4 ,Cl-,Br-,I-,为鉴定这些离子,分别取少量溶液进行以下实验:
①加HCl溶液后,生成无色无味气体。该气体能使饱和石灰水溶液变浑浊;
②加CCl4,滴加少量氯水,振荡后,CCl4层未变色;
③加BaCl2溶液产生白色沉淀,分离,在沉淀中加入足量盐酸,沉淀不能完全溶解;
④加HNO3酸化后,再加过量AgNO3,溶液中析出白色沉淀。
原溶液中肯定存在的阴离子是 ,肯定不存在的阴离子是 ,可能存在的阴离子是 。
27.(12分)如下图是某学生设计的一个用实验室常用的方法制取氯气并验证氯气化学性质的实验。请观察和分析该装置图,回答有关问题:
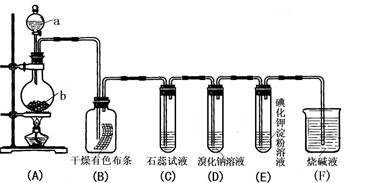
(1)(A) 装置中有关药品名称是:a_______,b______,发生反应的离子方程式为:___ ____。
(2)实验中(C)装置可见溶液先变红后褪色,其可能的原因是:
______________________ __ _。
(3)实验中(D)装置的溶液变________色,(E)装置内的溶液变________色,这两个装置发生反应的现象可以说明Cl2 、Br2 、I2三者之间氧化性强弱的关系是_________________ _____。
(4)(F)的作用是________ _______________,其化学方程式为: _____________________________。
(5)装置中(B)的设置目的是检验干燥的氯气有无漂白性,你认为该实验能否实现这一目的? 如能,请答出可作为判断依据的实验现象;如不能,请答出应该对装置作何改进?
___________________________________________________________________________________ _________。
五、计算题(本题包括2小题,共10分)
28.(4分)将一定体积的HCl气体通入50 mL AgNO3溶液中刚好反应完全,所得沉淀经过滤、干燥后称其质量为2.87 g,则AgNO3溶液的物质的量浓度为 ,通入的HCl气体在标准状况下的体积为 。
29.(6分)有一包Na2O和 Na2O2的混合物,置于一定量的水中配成250 mL溶液,测得该溶液中Na+ 的物质的量浓度为5 mol/L,并收集到5.6 L气体(已折合为标准状况),计算原混合物中Na2O与Na2O2的物质的量之比。
绵阳南山中学高20##级20##年1月学业水平测试
化学试题(B)答案
一、选择题(本题包括10小题,每小题2分,共20分。每小题只有一个选项符合题意)
1.C 2.B 3.A 4.B 5.B 6.C 7.A 8.A 9.D 10.D
二、选择题(本题包括10小题,每小题3分,共30分。每小题只有一个选项符合题意)
11.C 12.B 13.B 14.D 15.B 16.C 17.D 18.C 19.A 20.D
三、填空题(本题包括4小题,共16分)
21.(共3分,每空1分)2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O 次氯酸钙
Ca(ClO)2+CO2+2H2O===CaCO3+2HClO
22.(共4分,每空2分)2CO2+2Na2O2===2Na2CO3+O2 6.02×1022
23.(2分)22.2 %
24.(共7分,每空1分)(1)O2 Cl2+2I-===2Cl-+I2
(2)MnO2+4HCl(浓)△===MnCl2+Cl2↑+2H2O
(3)黄 Ag++I-== AgI↓ (4)KClO3 I2
四、实验题(本题包括3小题,共24分)
25.(共6分,每空2分)(1)42.0 (2)50 mL量筒、烧杯、胶头滴管、玻璃棒、250 mL容量瓶 (3)D
26.(共6分)CO2-3 、SO2-4 、Cl-(3分) Br-、I-(2分) NO-3(1分)
27.(共12分)(1)浓盐酸 二氧化锰 MnO2+4H++2Cl-△===Mn2++Cl2↑+2H2O(各1分)
(2)氯气与水反应生成的盐酸、浓盐酸挥发产生的HCl均可使石蕊试液变红,褪色是由于反应生成的HClO具有漂白作用(2分)
(3)橙(1分) 蓝(1分) Cl2>Br2、Cl2>I2(1分)
(4)吸收多余的Cl2、防止污染空气(1分) Cl2+2NaOH===NaCl+NaClO+H2O(1分)
(5)不能,因氯气进入B瓶前未经干燥处理。应在装置A、B之间增加除去水蒸气及HCl气体的装置(2分)
五、计算题(本题包括2小题,共10分)
28.(共4分)0.4 mol/L 448 mL
29.(共6分)Na2O+H2O ===2NaOH 2Na2O2+2H2O ===4NaOH+O2↑
1 mol 2 mol 2 mol 4 mol
根据反应前后Na元素守恒:n(Na2O)+n(Na2O2)=×5 mol/L×0.25 L=0.625 mol(2分)
2Na2O2+2H2O ===4NaOH+O2↑
2 mol 22.4 L
n(Na2O2) 5.6 L
n(Na2O2)==0.5 mol …………………………………………………(2分)
n(Na2O)=0.625 mol-n(Na2O2)=0.625 mol-0.5 mol=0.125 mol
n(Na2O):n(Na2O2)=0.125 mol:0.5 mol=1:4 ……………………………………(2分)