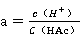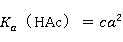综合化学实验报告
实验名称:电解法和传统化学法合成碘仿实验
专业
姓名
学号
实验日期 年 月 日—— 年 月 日
一、实验目的
1.熟悉电化学方法在有机合成中的应用
2.掌握电化学合成碘仿的基本原理
3.掌握电流效率等概念以及电化学合成的基本操作及影响因素
4.熟悉化学法合成碘仿的原理和操作,并与电解法进行比较,对比讨论两者的优缺点
二﹑实验原理
1.电解法:
主反应: 

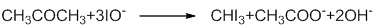
副反应: 
其中副反应每生成1mol IO3-会消耗6mol电子。因此,在制备碘仿实验中,实际通过
的电量要大于理论计算的数值。
反应式所需的电量与实际通过的电量之比称为电流效率。
2.化学法:
NaI+NaClO→NaIO+NaCl
CH3COCH3+3NaIO→CH3COCI3+3NaOH
CH3COCI3+NaOH→CHI3+CH3COONa
三﹑实验仪器与药品
1.仪器:电磁搅拌器、直流电源、电解池、自制电极(1对Ni电极和1对Cu电极)、
水浴锅、布式漏斗、pH试纸、数字熔点仪
2.药品:碘化钠(A.R.)、次氯酸钠(A.R.)、丙酮(A.R.)、乙醇(95%)

四﹑实验步骤
1.化学法制备碘仿
如图搭好装置,
在搅拌条件下向三颈烧瓶中依此加入50mL水,7.7gNaI和1mL丙酮。在滴液漏斗
中加入50mL5%的NaClO溶液。通过滴液漏斗逐滴向三颈烧瓶中滴加NaClO溶液,
 控制温度在25℃以下。滴加完之后,继续搅拌30分钟,停止反应。抽滤。于35~40
控制温度在25℃以下。滴加完之后,继续搅拌30分钟,停止反应。抽滤。于35~40
℃烘箱中进行干燥,得粗产品。用大约40mL95%乙醇加热溶解
所得粗产品。溶解采用右图所用装置。溶解完全后趁热抽滤,所
得母液在冰水浴中结晶,待结晶完全后抽滤,干燥,称量,并用
数字熔点仪测重结晶后的产品熔点。
2.电解法制备碘仿
在一定温度下,向电解池中加入100mL水。搅拌下加入7.7g碘化钠,待固体
溶解后,再加入1mL丙酮,混合均匀后测pH并记录。安装好电极,在某一电流下
开始电解,记下起始时间。1min后再测pH值并记录,实验中分别记录1,3,5,···,10min
反应(5min后每隔5min记录一次)时体系pH值和电流。电解30min后,切断电源,
停止电解。将电解液用布氏漏斗抽滤,得到的粗产品在烘箱中干燥后称重。
实验中需做对比实验。对比条件分别为电极材料,反应温度,电解电压。
(1)电极材料
1.Ni电极 采用两个Ni箔电极分别作为阴极和阳极,浸入液体中的尺
寸为2cm×1cm,电极间距调节为2 cm。控制水浴温度为25℃,调整电压为10.OV。
进行电解。
2.Cu电极 采用两个Cu箔电极分别作为阴极和阳极,浸入液体中的尺
寸为2cm×1cm,电极间距调节为2 cm。控制水浴温度为25℃,调整电压为10.OV。进
行电解。并与Ni电极的电解进行对比。
(2)电解电压(Ni电极,水浴T=25℃)
1.电压U1=10.0V
2.电压U1=6.0V 电解完全后两者相互比较。
(3)电解温度(Ni电极,电压U=10.0V)
1.水浴T1=25℃
2.水浴T1=42℃ 电解完全后两者相互比较。
3.重结晶
将将化学法和电解法得到的粗产品分别进行重结晶。粗产品用适量的乙醇在加热
搅拌回流的条件下溶解。乙醇的用量应使碘仿恰好溶解,待固体完全溶解后再加1mL
左右,趁热过滤。将母液用冰浴冷却,使晶体充分析出,抽滤所得混合物。将得到的
固体干燥,称量,并用数字熔点仪测量熔点。
五、结果与讨论
1.化学法
理论产量计算:m(NaI·2H2O)=7.7g → n(NaI·2H2O)=0.04142mol
1mL CH3COCH3→ n(CH3COCH3)=0.0136mol < n(NaI·2H2O)/3
所以,化学法制得的碘仿产率以丙酮为标准计算:
由反应式:NaI+NaClO→NaIO+NaCl
CH3COCH3+3NaIO→CH3COCI3+3NaOH
CH3COCI3+NaOH→CHI3+CH3COONa
理论可得:n(CHI3)= n(CH3COCH3)=0.0136mol
即m(CHI3)=5.355g
实验得到重结晶后的纯产物m(CHI3)=1.8g
产率为 1.8/5.355×100%=33.6%
产物测得熔点为118.2℃,118.5℃。平均熔点为118.5℃
2.电解法
①Cu电极,电解电压10.0V,水浴温度25℃,碘化钠7.7g
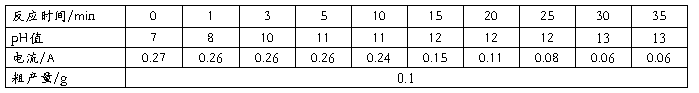
②Ni电极,电解电压10.0V,水浴温度25℃,碘化钠7.7g
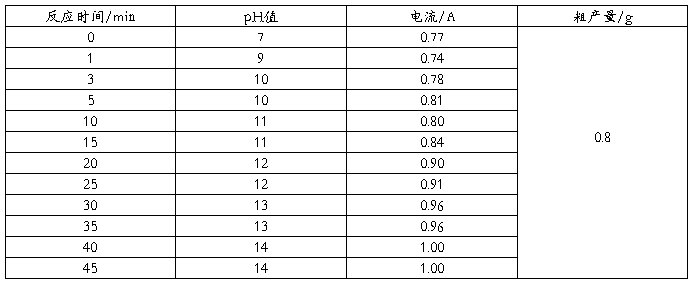
③Ni电极,电解电压6.0V,水浴温度25℃,碘化钠7.7g
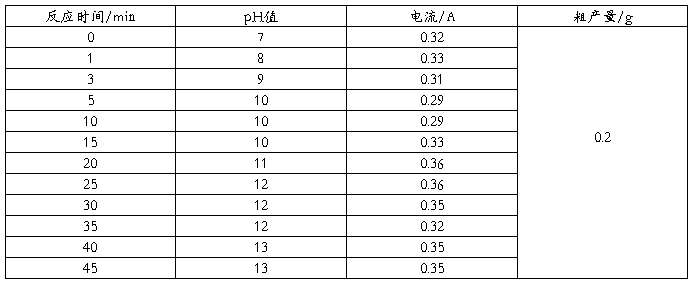
④Ni电极,电解电压10.0V,水浴温度42℃,碘化钠7.7g
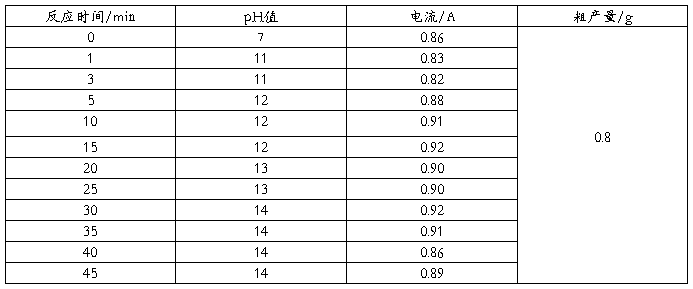
重结晶后总产物为0.6g,两次测得熔点分别为118.3℃,118.6℃。
I-t图
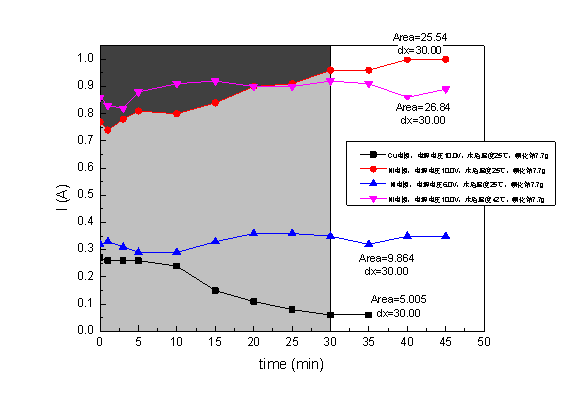
从下到上电子量分别为3.11×10-3mol、6.13×10-3mol、16.69×10-3mol、15.88×10-3mol
pH-t图
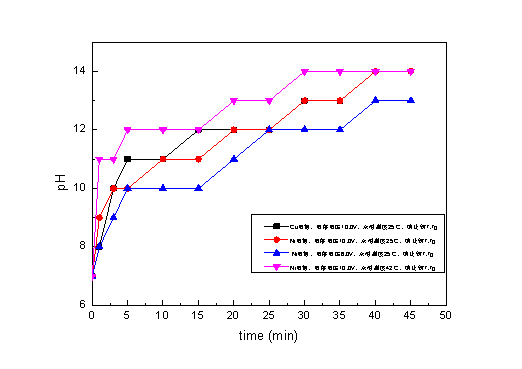
由于采用广泛pH试纸,故pH值记录误差较大,但可以看出总体趋势是酸性增强。
由I-t图可知,①Ni电极在单位时间内通过的电量大于Cu电极,故Ni电极在时间上效率
较Cu电极高。
②从总体上看,电流都有一个增大、减小的过程,增大的过程应该是发生了主反应,
随着反应的进行,主反应强度减弱,而电极随着I2以及Cu(OH)2等产生使得电极极化,电
流下降。
③电解电压从10V降到6V,反应中通过电量显著下降,意味着有利于电解的进行,有
利于增加碘仿的产量,但当电压过大时,氢气在镍电极上的超电位增大,会增加消耗的电
能,可能会使电流效率降低。
④42℃电解体系电流密度略高于25℃电解体系,说明在其他条件相同时,在一定温度
范围内,升高温度有利于电解的进行,有利于提高碘仿产量。因为温度加快传质过程,使
得在阳极部位生成的碘单质迅速扩散,与丙酮反应生成碘仿。
pH增大的原因是阴极不断产生氢氧根离子,而阳极总反应既不产生氢氧根也不生成,
因此溶液的pH值逐渐升高。
六、思考与讨论
1.电解法制备有机物时电极材料是首要考虑的问题,其应具备的条件:①具有良好的催化
活性 ②导电性能良好 ③稳定性好 ④具有一定的机械强度。本实验采用的是金属电极,
但由于金属电极很容易发生本身的电解氧化,使得电流效率很低,且产物不纯,但良好的
惰性金属价格昂贵,不适合大规模使用,可以考虑采用石墨电极。
2.讨论温度、搅拌、电解电压等因素对电解合成的影响:电化学反应电极过程主要有反应
物向电极表面传质、电子转移、产物离开电极或进入电极内部、电子转移前或电子转移后
在溶液中进行的化学转化、表面反应。其中物质的传质受温度、搅拌的影响较大,增大传
质,增强搅拌的强度有助于物质传质,促进电化学反应。电解电压对电子的转移影响较大,
故增大电压可以促进电化学反应进行。其中本实验中搅拌强度若不够,易使阴极产生的碘
单质附着在电极上,不利于溶液反应且会增大电极极化。
3.比较电解法和传统法:电解法的氧化剂为失电子,而传统法中氧化剂为
NaClO,考虑到重结晶后的产品质量,电化学法所用氧化剂仅为传统法的1/9,所以电化
学法更为经济,但需要解决电极和反应条件的优化问题,尽量减少副反应。
七、结论
1.电解法合成碘仿实验中,反应温度、电解电压、以及电极材料对电解反应影响很大,本
实验可以得出结论:在一定的范围内,Ni电极优于Cu电极,电解电压越高反应越好,温度
越高反应越好。电解电压和温度在哪个范围内于产量正相关没有进行实验。
2.在综合考虑反应条件以及操作和经济效益的影响下,电解法合成碘仿更优于化学法。
八、注意事项
①化学法制碘仿时应控制次氯酸钠的滴加速度,防止反应温度过高。
②电解法制碘仿时应注注意使用前将电极表面磨至光亮,否则其表面的氧化物会影响反应
的进行。电解过程中,勿触碰电极,否则会导致电流不稳,干扰实验。
③在进行重结晶操作时应控制加入的乙醇的量,加入过多会使碘仿溶解,使产率降低。
第二篇:采用分光光度法测定弱电解质的电离常数实验报告
采用分光光度法测定弱电解质的电离常数实验报告
一、 实验目的
1、 了解一种测定弱电解质电离常数的方法。
2、 掌握分光光度计的测试原理和使用方法。
3、 进一步熟练掌握pH的原理和使用方法。
二、 实验原理
根据朗伯-比耳定律,溶液对单色光的吸收,遵守下列关系式:
 ①
①
式中,A为吸光度; I/I0为透光率T;k为摩尔吸光系数它是溶液的特性常数;C为溶液浓度;l为溶液的厚度。
在分光光度分析中,将每一种单色光,分别依次地通过某一溶液,测定溶液对每一种光波的吸光度,以吸光度A对波长λ作图,由图可以看出,对应于某一波长有一个最大的吸收峰用这一波长的入射光通过该溶液就有最佳的灵敏度。
从①式可以看出,对于固定长度吸收槽,在对应的最大吸收峰的波长λ)下测定不同浓度c的吸光度,就可以做出线性的A~C,就是光度法的定量分析的基础。
以上讨论是对于单组份溶液的情况,对于含有两种以上组分的溶液,情况就要复杂一些。
1. 若两种被测定组分的吸收曲线彼此不相重合,这种情况就很简单,就等于分别测定两种单组分溶液。
2. 若两种被测定组分的吸收曲线相重合,且遵守贝尔-郎比定律,则可在两波长λ1及λ2时(λ1、λ2是两种组分单独存在时吸收曲线最大吸收峰波长)测定其总吸光度,然后换算成被测定物质的浓度。
根据贝尔-郎比定律,假定吸收槽长度一定时,则

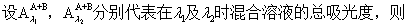
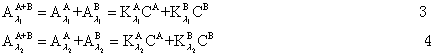

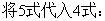
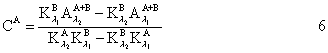
本实验是用分光光度法测定弱电解质(甲基红)的电离常数,犹豫甲基红本身带有颜色,而且在有机溶剂中电离度很小,所以用一般的化学分析法或者其它物理方法进行测定都有困难,但用分光光度法可不必将其分离,且同时能测定两组分的浓度。甲基红在有机溶剂中形成下列平衡:

甲基红的电离常数:
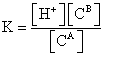
或  7
7
由7式知,只要测定溶液中[B]与[A]的浓度及溶液的pH值,即可求得甲基红的电离常数。
三、 实验仪器及试剂
仪器:722型分光光度计1台;pHs-3D型酸度计1台;容量瓶(100mL)7只;量筒(100mL)1只;烧杯100mL,4只);移液管(10mL,刻度)2支;洗耳球1只
试剂:酒精(95%,化学纯);HCl(0.1mol/L);HCl(0.01mol/L);醋酸钠(0.04mol/L);甲基红溶液
四、 实验内容
1、 制备溶液
(1) 甲基红溶液 将1g甲基红加300mL95%的乙醇,用蒸馏水稀释至500mL容量瓶中。
(2) 甲基红标准溶液 取10mL上述溶液,加入50mL95%乙醇,用蒸馏水稀释至100mL容量瓶中。
(3) 溶液A 取10.00mL甲基红标准溶液,加入0.1mol/L盐酸10mL,用蒸馏水稀释至100mL容量瓶中。
(4) 溶液B 取10mL甲基红标准溶液,加入0.04mol/L醋酸钠25mL,用蒸馏水稀释至100mL容量瓶中。
溶液A的pH约为2,甲基红以酸式存在。溶液B的pH约为8,甲基红以碱式存在。将溶液A、B和空白液(蒸馏水)分别放入三个洁净的比色皿内,测定吸收光谱曲线。
2、 吸收光谱曲线的测定
(1)用752分光光度计测定溶液A和溶液B的吸收光谱曲线并求出最大吸收峰的波长。波长从360nm开始,每隔20nm测定一次(每改变一次波长都有先用空白溶液校正),直至620nm为止。
由所得的吸光度A与λ作A-λ曲线,从而求得溶液A和溶液B的最大吸收峰波长λ1和λ2。
(2)求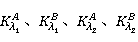 。将A溶液用0.01mol·L-1HCl稀释至开始浓度的0.75、0.50、0.25倍。B溶液用0.01mol?L-1NaAc稀释至开始浓度的0.75、0.50、0.25倍。并在溶液A、溶液B的最大吸收峰波长λ1、λ2处测定上述各溶液的吸光度。如果在λ1、λ2处上述溶液符合朗伯-比耳定律,则可得四条A—c直线,由此可求出
。将A溶液用0.01mol·L-1HCl稀释至开始浓度的0.75、0.50、0.25倍。B溶液用0.01mol?L-1NaAc稀释至开始浓度的0.75、0.50、0.25倍。并在溶液A、溶液B的最大吸收峰波长λ1、λ2处测定上述各溶液的吸光度。如果在λ1、λ2处上述溶液符合朗伯-比耳定律,则可得四条A—c直线,由此可求出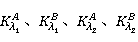 。
。
3、 混合溶液的总吸光度及其pH的测定
(1) 配制四个混合液
1) 10mL标准溶液+25mL0.04 mol·L-1 NaAc+50mL0.02 mol·L-1HAc,用蒸馏水稀释至100mL。
2) 10mL标准溶液+25mL0.04 mol·L-1 NaAc+25mL0.02 mol·L-1HAc,用蒸馏水稀释至100mL。
3) 10mL标准溶液+25mL0.04 mol·L-1 NaAc+10mL0.02 mol·L-1HAc,用蒸馏水稀释至100mL。
4) 10mL标准溶液+25mL0.04 mol·L-1 NaAc+5mL0.02 mol·L-1HAc,用蒸馏水稀释至100mL。
(2) 条件允许,可用超级恒温水浴25℃恒温5min后在进行测量。
(3) 用λ1、λ2的波长测定上述四个溶液的吸光度。
(4) 测定上述四个溶液的pH值。
五、 实验内容数据处理与处理结果
吸光度A—波长λ表


由图得,溶液A的最大吸收峰波长λ1=520,溶液B的最大吸收峰波长λ2=420。
波长为λ1时溶液A、B的吸光度表
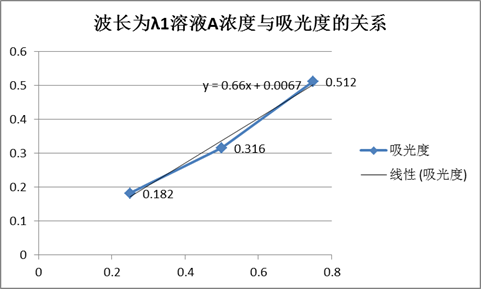
由图得,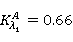 。
。
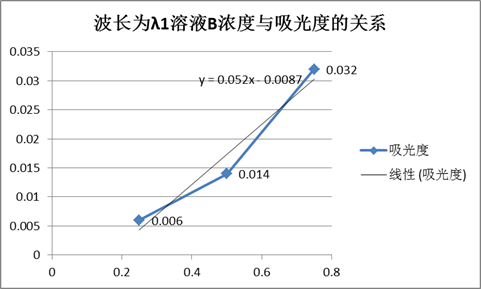
由图得, 。
。
波长为λ2时溶液A、B的吸光度表
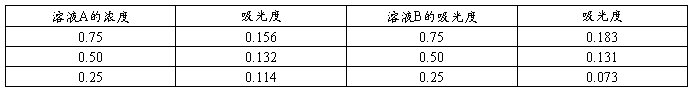
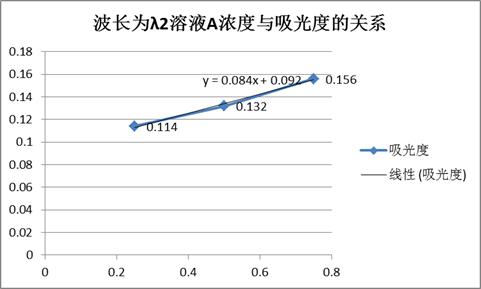
由图得,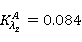
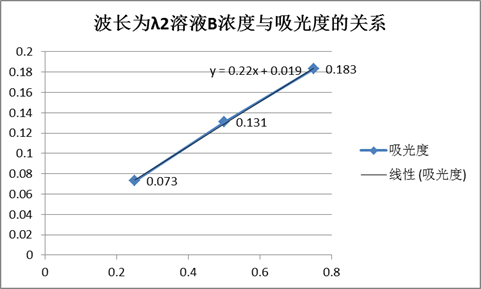
由图得,
混合溶液数据记录表

组别1:


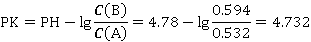
同理得,
组别2:
C(A)=0.524 C(B)=0.772 pK=4.912
组别3:
C(A)=0.288 C(B)=1.342 pK=4.922
组别4:
C(A)=0.114 C(B)=1.342 pK=5.059
六、 讨论
1、 为什么NaAc加入甲基红会变黄?
甲基红在有机溶剂中形成下列平衡:

由平衡关系可以看出,增大溶液酸度,甲基红以HMR结构形式存在,溶液显红色;降低溶液的酸度,甲基红以MR-离子结构形式存在,溶液显黄色。NaAc溶液为弱碱性溶液,加入甲基红中,导致溶液酸度降低,但酸度降低较小,溶液颜色在红、黄之间,呈橙色。
2、 醋酸的电离常数的测定。
1) 不同浓度的HAc溶液的配制
用酸式滴定管分别取5.00mL,10.00mL,25.00mL已标定好的HAc溶液于三个洁净的50mL容量瓶中,再用蒸馏水稀释至刻度,摇匀,并计算每份HAc溶液的准确浓度。
2) HAc溶液pH的测定
用四只洁净干燥的50mL烧杯,分别取20mL左右上述溶液的HAc溶液及一份未稀释的HAc标准溶液。按由稀到浓的顺序在pH计上分别测定它们的pH和实验温度并将pH换算成c(H+)。
将数据代入下式公式: