丙酮碘化反应速率常数的测定
一、目的及要求
1、掌握孤立法确定反应级数的原理和方法。
2、测定酸催化作用下丙酮碘化反应的速率方程和速率常数。
3、通过本实验加深对复杂反应特征的理解。
4、进一步掌握分光光度计的原理和使用方法。
二、实验原理
1、反应速率的测定
CH3COCH3+nH++I2=CH3COCH2I+(n+1)H++I- (a)
在实验条件下,丙酮碘化反应将按(a)的方式进行,其速率方程为:
v=-[d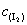 /dt]=k·
/dt]=k·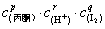 (b)
(b)
在酸的浓度较低的条件下,实验证明q=0,即反应(a)的速率与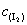 无关。
无关。
因为实验中c(丙酮)»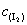 ,
,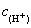 »
»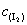 ,可认为c(丙酮)和
,可认为c(丙酮)和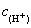 为定值,故
为定值,故
v =-[d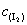 /dt]=k·
/dt]=k· = 常数 (c)
= 常数 (c)
积分(c)式可得 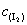 = -k·
= -k·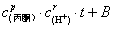 (d)
(d)
在反应(a)的混合溶液中,只有碘在可见光范围内产生光吸收,按朗伯-比尔定律:
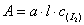 = lg(1/T )=-lgT (e)
= lg(1/T )=-lgT (e)
解出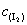 :
: 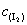 =A/(a·l )=-lgT /(a·l ) (f)
=A/(a·l )=-lgT /(a·l ) (f)
根据式(f),测定了已知浓度的标准碘溶液的吸光度A即可求得(a·l )。
将(f)代入(d)式整理后得:lgT=k·(a·l)·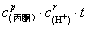 -B·a·l (g)
-B·a·l (g)
可见以lgT对t作图为直线,斜率:m = k·(a·l) · (h)
(h)
比较(c)、(h)式得:v =k· = m/(a·l ) (i)
= m/(a·l ) (i)
2、反应分级数p、q、r的确定(孤立法)
(1) p的确定
由1、2号试液由上述关系求得v1、v2后:
v1/v2= [k· ]/ [k·
]/ [k·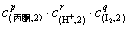 ]=2p
]=2p
(其中c(丙酮,1)= 2c(丙酮,2);c(H+,1)= c(H+,2);c (I2,1)= c(I2,2) )
上式两边取对数可得:p =[lg(v1/v2)]/lg2
(2) r的确定
由1、3号试液同理可得:r =[lg(v3/v1)]/lg2
(3) q的确定
由1、4号试液同理可得:q =[lg(v1/v4)]/lg2,直接求得的p、q、r取整为最接近的整数。
3、速率常数的求算
由上述方法确定丙酮一碘代反应速率方程v = k·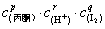 后,分别代入1—4号试液的v、c(丙酮)、
后,分别代入1—4号试液的v、c(丙酮)、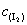 等数据,即可求出速率常数k,取平均值。
等数据,即可求出速率常数k,取平均值。
三、实验仪器和试剂
1、主要仪器:分光光度计、秒表、5 mL和10 mL移液管各三支、50 mL容量瓶5个。
2、主要试剂:0.01 mol/L标准碘溶液,1.0 mol/L HCl溶液,2 mol/L丙酮溶液。
四、实验步骤
1、由于分光度计无恒温水夹套,本实验在室温下进行,注意记录开始测定和测定最后
一个样品时的室温,取二者平均值为实验温度。
2、预热分光光度计20分钟以上,反复调节分光光度计零点和透光100,直至达到要求。
3、将标准碘溶液(0.0103184 mol/L)稀释10倍,以蒸馏水作参比,选择500 nm为测
定波长,测定(a·l)值。必须重复测定三次,每次均需要换标准碘溶液,取三次测定的平均值。
4、配制1号样品溶液,测定其不同时间的吸光度。其具体方法是:用不同的移液管分别移取0.01 mol·L-1标准碘溶液10 mL、1 mol·L-1标准HCl溶液5 mL于1号瓶中,再移取2 mol·L-1标准丙酮溶液10 mL迅速加入1号瓶,当丙酮溶液加到一半时开始计时,然后用蒸馏水将此混合液定容至刻度,摇匀。用此混合液将比色皿清洗干净,将此溶液装入比色皿(计时后的整个操作过程应迅速进行),以蒸馏水作参比,测定不同时间的吸光度。自第一次读数并记下时间和数据后,每隔2分钟测一次,直到取得10~12个数据为止。
5、按照4同样方法,分别测定2~4号样品溶液不同时间的吸光度。若测定中吸光度变化较大,则可改为每隔1分钟或更短的时间测一次,记下相应的时间和数据。
6、实验完毕后,洗净实验过程中使用的仪器。
五、数据记录和处理
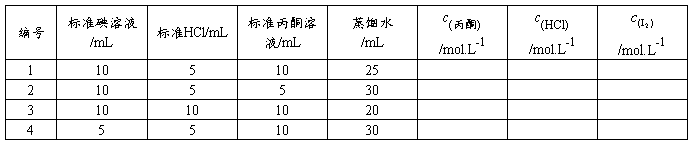
1、溶液配置表:
2、求al

3、混合溶液时间-吸光度
实验开始温度: ℃ 实验结束温度: ℃

4、根据实验数据结合实验原理通过以lgT对t作图(或一元线性回归法)求出斜率m,由此得到反应级数和反应速率常数k值——
⑴ 由(i)式计算反应速率v;
⑵ 确定反应级数p、r、q;
⑶ 计算速率常数k:将上述p、r、q值代入v =k·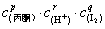 ,并将四组溶液的v值和相应反应物浓度代入,可算出四组速率常数k,取平均值。
,并将四组溶液的v值和相应反应物浓度代入,可算出四组速率常数k,取平均值。
六、注意事项
1.由于分光光度计使用过程中会发热,比色皿座舱温度会明显升高,为保证实验温度
确为室温,测定溶液吸光度时,每次测定后,要立即将分光光度计的盖板打开。
2.测定反应混合液不同时间的吸光度时,时间和吸光度读数必须同步。为此,可在操作时打5秒的提前量。
七、思考题
1.本实验中,将丙酮溶液加入含有碘和盐酸的容量瓶时不立即计时,而在注入比色皿
时才开始计时是否可以?为什么?
2.影响本实验结果准确度的主要因素有哪些?
3.分光光度计使用中,将蒸馏水从样品池倒出后,若样品架未完全复位,对结果有无影响?
第二篇:丙酮碘化反应速率常数及活化能的测定
丙酮碘化反应速率常数及活化能的测定
一:实验目的
1.加深对复杂反应特征的理解,掌握用孤立法确定反应级数。
2.掌握用分光光度计测定酸催化丙酮碘化反应的速率常数和活化能的实验方法。 二:实验原理
丙酮碘化反应方程为 CH3COCH3+I2→CH3COCH2I+H﹢+I﹣ 该反应是一个自动催化反应,并且为一个复杂反应,分两步进行:
1.丙酮的烯醇化反应CH3COCH3+H﹢→CH3COH=CH2
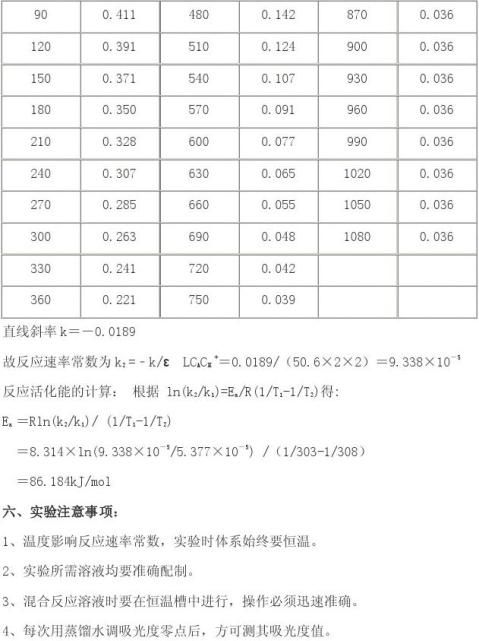
2.烯醇的碘化反应CH3COH=CH2+I2→CH3COCH2I+H﹢+I﹣ 总反应的速率方程为:﹣dCI2/dt=kCACH﹢ 对上式进行积分得: ﹣CI2=kCACH﹢t + B 因为碘在可见光区有宽的吸收带,而在此吸收带中,盐酸,丙酮,碘化丙酮和碘化钾溶液均没有明显的吸收,所以可以采用分光光度法直接测量碘浓度的变化。A=﹣kε LCACH﹢
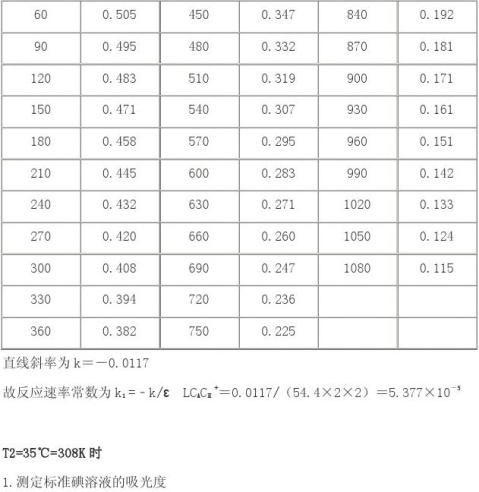
tB 上式中的 εL可通过测定一定浓度的碘溶液的吸光度A带入式中求得。做A-t图,直线的斜率可求出丙酮碘化反应速率常数K
值。
有两个以上温度下的速率常数就可以根据阿仑尼乌斯公式
ln(k2/k1)= Ea/R(1/T1-1/T2)
估算反应的活化能Ea得值。
三:仪器和试剂
试剂: 0.05mol/L碘溶液,2.00mol/LHCl标准溶液,2.00mol/L丙酮溶液,0.0050mol/L碘溶液
仪器: 721型分光光度计,超级恒温槽,停表,比色管(50ml一支,25ml两支)移液管(5ml两支,10ml一支),滴管一支
四:实验步骤 1.开启恒温水浴,控制温度为
30℃。
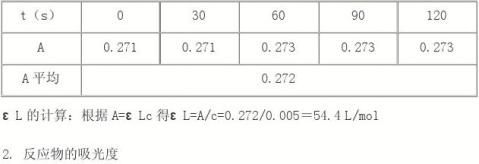
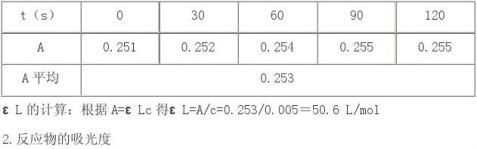
2.测定εL值:调整分光光度计的光路,测量波长定为590nm,在恒温比色皿中分别注入蒸馏水,用蒸馏水调吸光度零点,吸取0.0050mol/L碘溶液,将其注入恒温比色皿中,测其吸光度,平均测量三次,求其平均值。
3.测定反应速率常数: ⑴分别移取5.00ml0.050mol/L 碘溶液和5.00ml2.00 mol/LHCl标准溶液于25ml比色管中,加入10 ml水,在移取10ml2.00 mol/L的丙酮溶液于50ml比色管中, 加入10 ml水,混合前两个比色管中溶液的总体积不得超过50ml,然后在另一25ml比色管中注入25ml蒸馏水,三个比色管一同放入30℃恒温槽中恒温10min.
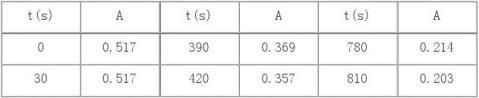
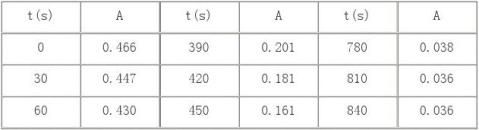
⑵温槽后快速将碘酸混合溶液倾入丙酮溶液中,迅速摇动,加同恒温水洗涤盛碘酸之比色管至50ml,然后快速注入比色皿中,每次用蒸馏水调吸光度零点后,测其吸光度值,每1min读一次吸光度值。 五、实验数据记录及处理 T1=30℃=303K时
1. 测定标准碘溶液的吸光度