丙酮碘化反应动力学测定——光度法
一、实验目的
1、 通过本实验加深对复杂反应特征的理解;
2、 掌握用孤立法确定反应级数的方法;
3、 学会用分光光度计测定酸催化作用下丙酮碘化反应的速率常数;
4、 掌握TU-1810型分光光度计的使用和校正方法,实验数据的作图处理方法;
二、实验原理
丙酮碘化的方程式为:
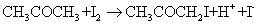
该反应是以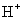 作为催化剂,同时反应自身会生成
作为催化剂,同时反应自身会生成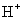 ,所以此反应是一个自动催化反应,并且为一个复杂反应,分两步进行:
,所以此反应是一个自动催化反应,并且为一个复杂反应,分两步进行:
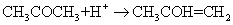 (1)
(1)
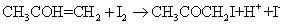 (2)
(2)
(1)式为丙酮的烯醇化反应,反应可逆并进行的很慢,是一个速控步,决定反应的总速率;(2)式为烯醇的碘化反应,反应快速并能进行到底。
总反应的速率方程为:
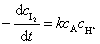
如果丙酮和酸相对于碘是过量的,则可认为在反应过程中丙酮和酸的浓度基本保持不变,同时,在酸的浓度不太大时,丙酮碘化反应对碘是零级反应。对上式进行积分得:

因为碘在可见光区有宽的吸收带,而在此吸收带中,盐酸,丙酮,碘化丙酮和碘化钾溶液均没有明显的吸收,所以可以采用分光光度法直接测量碘浓度的变化。
由朗伯—比尔定律 ,得
,得
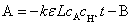
上式中的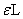 可通过测定一定浓度的碘溶液的吸光度A带入式中求得。做A-t图,直线的斜率可求出丙酮碘化反应速率常数k值。
可通过测定一定浓度的碘溶液的吸光度A带入式中求得。做A-t图,直线的斜率可求出丙酮碘化反应速率常数k值。
有两个以上温度下的速率常数就可以根据阿仑尼乌斯公式
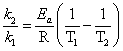
即可估算出反应的活化能Ea的值。
三、仪器与试剂
TU-1810光度计和计算机 1台 比色管 (50mL) 3只
恒温槽 1套 比色皿 1只
移液管 4只
0.050 mol/L、0.0050 mol/L碘溶液(含4%KI) 2 mol/L标准盐酸溶液
2 mol/L标准丙酮溶液
四、实验步骤
1.准备工作
(1)开启恒温水浴,控制温度为30℃(或35℃)。洗净比色管、比色皿 ,并用镜头纸将比色皿擦干净。
(2)反应液的配制:分别移取10mL碘溶液(0.05mol/L)和10mL酸溶液(2.000 mol/L)于50ml比色管中,加大约10ml水,再取10ml丙酮溶液(2.000 mol/L)于第二只比色管中,加大约10ml水,两管同时放入恒温水浴中恒温10分钟。
(3) 开启TU-1810光度计和计算机预热10分钟,同时开启比色皿恒温器控制温度为30℃。(或35℃)。
(4)计算机启动:确认紫外仪器与计算机的连接正常,并且已经打开主机电源。此时,可以点击UVWIN 5的快捷方式来启动软件。
(5)仪器初始化:如果此时仪器工作正常,则可进入仪器初始化画面。
(6)主界面窗口展开。
(7)计算机设置:单击【窗口】,选择[时间扫描]打开。
(8)参数设置:单击【测量】菜单下的【参数设置】子菜单,即可打开时间扫描参数设置窗口【M测量】。设置【光度模式】为Abs;【时间单位】为秒;【采样数】为40;【时间间隔】为30。设置扫描的【波长】点为590;扫描的【最大吸光度】点为0.6;【最小吸光度】点为-0.01。
(9)校正:在1cm比色皿中注入蒸馏水放入TU-1810光度计,在UVWIN 5的主界面窗口。单击【校正】。
2.测量工作
(1)快速将恒温的碘、酸混合液倾入丙酮溶液中,用恒温水洗涤盛碘酸的比色管,使反应液的总体积为50mL。
(2)在1cm比色皿中注入反应混合液,放入TU-1810光度计,在UNWIN 5的主界面窗口,单击[开始],开始A~t曲线测量,直到测量结束。
(3)数据处理:在UNWIN 5的主界面窗口,单击【文件】,选择【导出数据】子菜单,选择菜单下的【电子表格Excel】;填写菜单下的【导出文件命名】;单击【浏览图标】,存储该实验数据1#于[丙酮碘化]文件夹。
(4)测εL值:在1cm比色皿中注入0.005M碘溶液,放入TU-1810光度计,在UNWIN 5的主界面窗口,单击【开始】,测量2分钟后,按上述数据存储操作,另存储该数据2#于[丙酮碘化]文件夹。
五、实验注意事项
1.温度影响反应速率常数,实验时体系始终要恒温;
2.实验所需溶液均要准确配制;
3.混合反应溶液时要在恒温槽中进行,操作必须迅速准确;
4.实验每次用蒸馏水调吸光度零点后,方可测其吸光度值。
六、实验数据记录及处理
1.T=308K时的试验数据处理
cI2=0.005mol/L, λ=590nm

2.T=303K时的试验数据处理
cI2=0.005mol/L, λ=590nm

七、思考题
1.本实验中,丙酮碘化反应按几级反应处理,为什么?
2.若想使反应按一级反应规律处理,在反应液配制时应采用什么手段?写出实验方案.
3.影响本实验结果精确度的主要因素有哪些?
第二篇:8.电动势法对丙酮碘化反应动力学的研究
电动势法对丙酮碘化反应动力学的研究
组员:张芹 刘瑾玉 蒙开俊
前言:大多数化学反应是由若干个基元反应组成的复杂反应。这类反应的反应速度与反应物浓度间的关系不能用质量作用定律来确定,只能在一定条件下通过实验来求得。常用的方法有积分法和微分法和孤立法。对于复杂的反应多数采用孤立法。孤立法是设计一系列溶液,其中只有某一物质的浓度不变,而其它物质的浓度均相同,借此可以求得反应对该物质的级数.用同样的方法亦可得到其它各种作用物的级数,从而确定速率方程。
一、原 理
在酸性溶液中,丙酮碘化反应是一个复合反应,其反应式为:
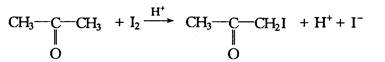
该反应由H+催化,其反应速率为:
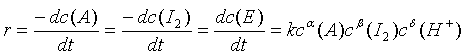 (1)
(1)
式中,r为反应速率; k为速率常数; 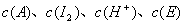 分别为丙酮、碘、氢离子、碘化丙酮的浓度, mol·dm-3、α、β、δ分别为反应对丙酮、碘、氢离子的分级数。
分别为丙酮、碘、氢离子、碘化丙酮的浓度, mol·dm-3、α、β、δ分别为反应对丙酮、碘、氢离子的分级数。
为了测定反应级数,例如α,至少需进行两次实验。在两次实验中丙酮的初始浓度不同, 和
和 的初始浓度相同。若用“①”、“②”分别表示这两次实验,令:
的初始浓度相同。若用“①”、“②”分别表示这两次实验,令:
c (A,①)=uc(A,②)
c ( ,①)=c(
,①)=c( ,②)
,②)
c ( ,①)=c(
,①)=c( ,②)
,②)
则可得:
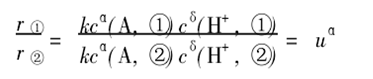
取对数,得:
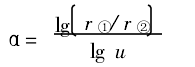
同理可求出β、δ。
实验中关键是要测出反应速率,也就是测反应过程中的浓度随时间的变化,测反应过程中浓度随时间变化的方法有很多,通常我们是测反应过程中某一种与浓度有关的物理量,测定它与时间的变化,从而确定浓度随时间的变化。比如有测定压力、体积、旋光度、折射率、吸收光谱、电导、电动势、介电常数、黏度、热导率等方法。这里我们采用的是电动势法,也就是测定反应过程中某种物质浓度随时间的改变。
根据上面的反应,我们可以设计一个原电池如下:
Hg(l)-Hg2Cl2(s)|KCl(饱和)|丙酮(α),碘溶液(α)|Pt
该电池电动势为:
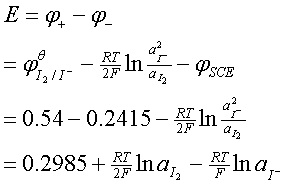
由于这个式子中有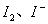 两个变量,所以必须想办法使式子变为一个变量。这里我们是使溶液中
两个变量,所以必须想办法使式子变为一个变量。这里我们是使溶液中 过量,即向反应溶液加入过量的
过量,即向反应溶液加入过量的 ,使反应生成的
,使反应生成的 忽略不计,即反应前后溶液中的
忽略不计,即反应前后溶液中的 不变,这样就可以把上式中的
不变,这样就可以把上式中的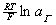 项归为常熟项中,从而通过测定反应中电动势的变化来跟踪
项归为常熟项中,从而通过测定反应中电动势的变化来跟踪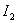 的溶度变化。
的溶度变化。
反应中所用的丙酮和酸应大大过量,而所用的碘量很少。这样,当少量的碘完全消耗后,反应物丙酮和酸的浓度仍基本保持不变。实验表明,丙酮碘化反应对碘是零级反应,即β=0。因而直到全部碘消耗完以前,整个反应的反应速率可以近似为一个常数,即:

根据(1)式,由反应级数、反应速率和各浓度数据可以算出速率常数k。由两个或
两个以上温度的速率常数,根据阿累尼乌斯公式:
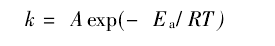
测得两个温度下的速率常数,
根据 ln(k2/k1)= Ea/R(1/T1-1/T2)
可以估算反应的表观活化能Ea。
二、实验部分
1 、仪器和试剂: 停表, 5mL移液管3支,烧杯,甘汞电极,铂电极,电位差计 , 超级恒温槽一套,100ml的溶量瓶一个,50ml溶量瓶若干个, 5ml,10ml移液管若干支。丙酮(A.R.),碘(A.R.),碘化钾(A.R.),盐酸(A.R.)。
2 、实验步骤
a.原始标准溶液的配制
(1)用分析纯丙酮,在实验前配制2mol·L-1丙酮溶液。通常用称重方法配制,也可用实验室当时温度下的比重,量体积方法配制。
(2)用分析纯浓HCl,配制1mol·LHCl溶液后进行标定。 ’
(3)用分析纯碘和蒸馏水配制0.01mol/L碘溶液后进行标定。
(4)用分析纯浓HCl,配制1mol·L-1KI溶液。
b. 丙酮碘化反应的速度常数的测定
(1)取四只50ml容量瓶,按下表装入溶液

在容量瓶中加入适量蒸馏水,其目的是为以后稀释到刻度时节省时间,但要注意不允许加入过量。
另取100m1容量瓶用少量丙酮溶液洗2—3次,然后装入50m1
2molmol/L丙酮溶液;另取50m1容量瓶装满蒸馏水。将这六只容量瓶置于恒温槽中待恒温。恒温时间不能少于10分钟。
(2)用移液管取已恒温好的丙酮溶液10m1(最好先吸取少量丙酮溶液使移液管温度也达到恒温温度,尤其冬季室温与待测温差大时特别要注意)放入l号瓶(2号加5ml),当丙酮溶液加到一半时,打开停表开始计时,用已恒温的蒸馏水将1号容量瓶稀释至刻度,迅速摇匀,然后倒入一个洗净的干燥小烧杯并把小烧杯放入恒温水浴中恒温,再插入饱和甘汞电极和铂电极按正负极接好电位差计,用对消法测量反应过程中的电动势。
(3)每隔2分钟记录一次电动势。对3号、4号样品每隔1分钟记录一次电动势。 ·
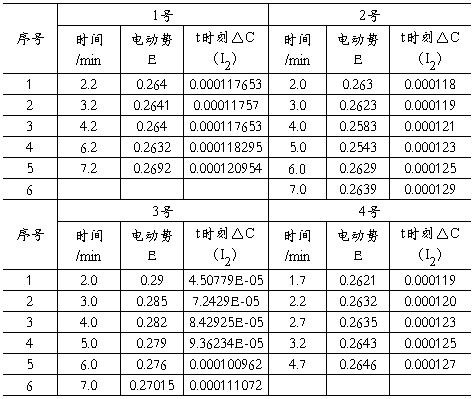
三 、实验数据处理(注:本实验数据仅作参考,可操作性不强。由于实验所得数据无法进行处理,有捏造成分)
(1)混合溶液的丙酮、盐酸、碘、碘离子的浓度(mol.L-1)
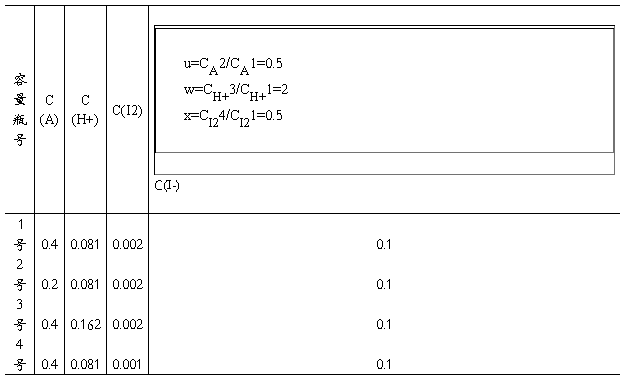
(2)混合溶液的时间——电动势——碘浓度改变(25C°)
(3)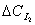 对t作图如下:
对t作图如下:
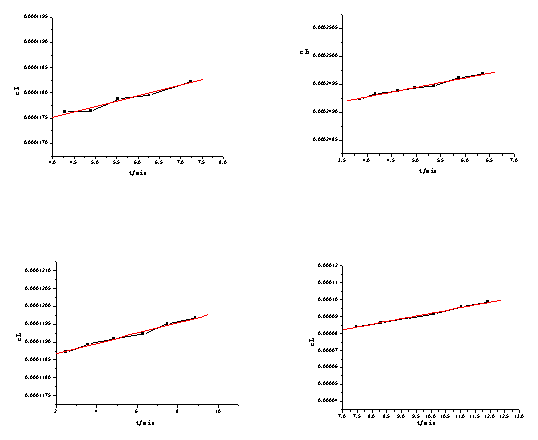
y=0.0412x+1.6845 y=0.0206x+1.6514
(1号) (2号)
y=0.0812x+1.7250 y=0.0240x+1.8456
(3号) (4号)
所以反应级数如下:

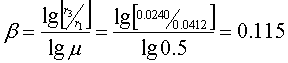
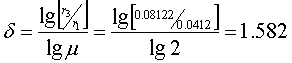
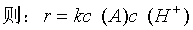
由一号溶液有:
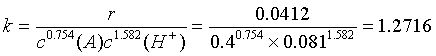
四 结果讨论
1据手册数据:丙酮碘化反应对丙酮、碘、氢离子的分级数分别为1,0,1,
25C时丙酮碘化反应的速率常数为
K=1.70×10-3
比较而言,相对误差很大,甚至有可能是错误。
2该法产生误差的主要原因可能有:
a用对消法测量反应过程中电动势,由于反应较快,又由于仪器不是全自动的,所以很难准确测量。
b由于是用秒表人为记录反应时间,所以反应时间的准确性也很难保证。
c 由于向化反应体系中加入了大量的KI溶液,而反应中有I-生成,这样极有可能造成加入的I-阻止反应的进行。
小结
本实验方案与用分光光度法测定反应过程中碘浓度随时间的变化的方案的比较:首先实验原理两者均采用微分法这点是相同的。不同点:①本实验是通过测量电动势随时间的变化用能斯特方程得到反应过程中消耗的碘的量,进而求得反应级数及其速率方程。而采用分光光度法是通过测定溶液透光率随时间的变化联立朗伯比尔定律来获得反应过程消耗的碘的量(碘在可见光区有一个很宽的吸收带,而在这个吸收带中酸和丙酮没有明显的吸收。)。②本实验测电动势是采用电位差计,测量是人工操控需要一定的时间而测量过程中反应一直在进行,所以所得电动势误差较大,影响实验的准确性。而采用分光光度法把溶液放入仪器后,测量是一个自动的过程,所测得的透光率比较精确,对实验的结果影响较小。③碘离子与碘单质在水溶液中存在平衡:I2+I-→I3-用能斯特公式处理时,所用的浓度存在误差。④本实验中为了利于处理数据,在反应溶液中加入了是50倍碘浓度的碘离子,使得生成物过量可能会导致反应一段时间后逆向进行影响反应正向进行。而采用分光光度法处理数据没有存在这样的问题所以准确性高。
综上所述,本实验的思路还是挺好的,就是误差太大,可操作性不强。至今还没有文献资料出版采用类似本实验的方案。由此可见此方案还在研究当中,尚未有一个完美的方案。
参考文献:
(1)“丙酮碘化反应”实验的改。李瑞英,古喜兰,陈六平,余小岚
中山大学学报论丛,20##年第23卷第1期
(2)丙酮碘化实验改进的思考 。刘马林1,麻 英2中国科技论文统计源期刊(中国科技核心期刊
(3)丙酮碘化反应速率常数的测定。郝茂荣 李仲轩包头钢铁学院学报 第15卷第3期 1996年9月
(4)丙酮碘化反应级数的确定 李 琮云南师范大学学报 第18卷第3期
1998年 9月
(5)物理化学 第四版下册 南京大学等校编
(6)中山大学物理化学实验网络课堂资料
