医疗器械临床试验病例报告表
试验项目名称
受试者病例号: □□□□□
试验用医疗器械编号:□□□
临床试验机构(或编号): □□
临床试验方案编号和日期(修改编号和日期若有)
试验开始日期 年 月 日
跟踪结束日期 年 月 日
记录人签名:
填 表 说 明
1.请用钢笔或签字笔填写,字迹应清晰,易于辨认。
2.每项填写内容务必准确,不得随便涂改,如发现填写内容有误,应在原记录上划单横线,在旁边写明正确内容及修改原因,由研究者签名并注明日期。不得用任何方式(橡皮、涂改液等)涂抹原记录。
一、受试者病历简况
1、入组日期 年 月 日
2、受试者姓名
3、出生日期 年 月
4、性别 □1.男 □2.女
5、临床诊断
6、接受的诊断/治疗方式(既往用药和/或手术)
7、入组前基础症状
8、入组时实验室检查
二、符合纳入/排除标准
三、诊断/治疗情况记录
五、一般情况观察记录
六、不良事件记录表
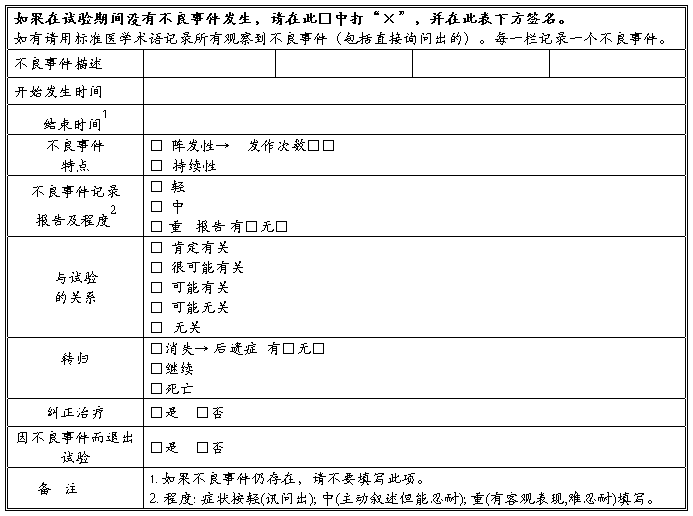
七、试验结论
八、声明
此病例报告表中的信息记录真实、准确,符合试验方案的要求,特此声明。
研究者签名:
年 月日
监查与检查记录粘贴处

第二篇:医疗器械临床试验病例报告表样表说明模板
医疗器械临床试验病例报告表样表
医疗器械临床试验病例报告表
试验项目名称
受试者病例号: □□□□□
试验用医疗器械编号:□□□
临床试验机构(或编号): □□
临床试验方案编号和日期(修改编号和日期若有)
试验开始日期 年 月 日
跟踪结束日期 年 月 日
记录人签名:
填 表 说 明
1.请用钢笔或签字笔填写,字迹应清晰,易于辨认。
2.每项填写内容务必准确,不得随便涂改,如发现填写内容有误,应在原记录上划单横线,在旁边写明正确内容及修改原因,由研究者签名并注明日期。不得用任何方式(橡皮、涂改液等)涂抹原记录。
一、受试者病历简况
1、入组日期 年 月 日
2、受试者姓名
3、出生日期 年 月
4、性别 □1.男 □2.女
5、临床诊断
6、接受的诊断/治疗方式(既往用药和/或手术)
7、入组前基础症状
8、入组时实验室检查
二、符合纳入/排除标准
三、诊断/治疗情况记录
四、一般情况观察记录
五、不良事件记录表
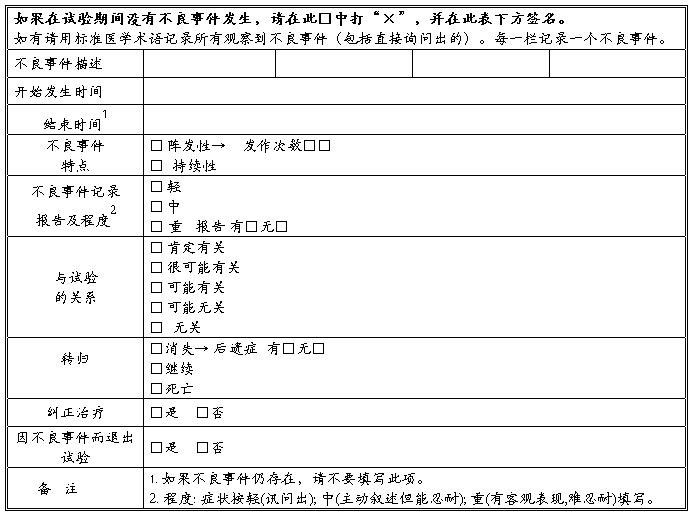
六、试验结论
七、声明
此病例报告表中的信息记录真实、准确,符合试验方案的要求,特此声明。
研究者签名:
年 月日
监查与检查记录粘贴处

奥咨达小编提醒你,
快捷医疗器械注-册、zi询、各国ren-证、体系、临-床试验等一条龙高质量服务,服-务超过2600家企业,技术过硬,成功率高。报jia?快来问问奥咨达客fu吧!
