学号:201014370135
基础物理化学实验报告
实验名称:乙酸乙酯皂化反应速率常数的测定
应用化学师范班 班级 03 组号
实验人姓名: xxx
同组人姓名:xxx xxx
指导老师: xx老师
实验日期:20##-11-2
湘南学院化学与生命科学系
一、实验目的:
1、了解测定化学反应速率常数的一种物理方法——电导法。
2、了解二级反应的特点,学会用图解法求二级反应的速率常数。
3、掌握DDS-11A型数字电导率仪和控温仪使用方法。
二、主要实验原理,实验所用定律、公式以及有关文献数据:
1、对于二级反应:A+B→产物,如果A,B两物质起始浓度相同,均为a,则反应速率的表示式为
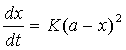 (1)
(1)
式中x为时间t反应物消耗掉的摩尔数,上式定积分得:
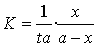 (2)
(2)
以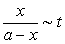 作图若所得为直线,证明是二级反应。并可以从直线的斜率求出k。
作图若所得为直线,证明是二级反应。并可以从直线的斜率求出k。
所以在反应进行过程中,只要能够测出反应物或产物的浓度,即可求得该反应的速率常数。
如果知道不同温度下的速率常数k(T1)和k(T2),按Arrhenius公式计算出该反应的活化能E
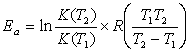 (3)
(3)
2、乙酸乙酯皂化反应是二级反应,其反应式为:

OH-电导率大,CH3COO-电导率小。因此,在反应进行过程中,电导率大的OH-逐渐为电导率小的CH3COO-所取代,溶液电导率有显著降低。对稀溶液而言,强电解质的电导率L与其浓度成正比,而且溶液的总电导率就等于组成该溶液的电解质电导率之和。如果乙酸乙酯皂化在稀溶液下反应就存在如下关系式:
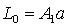 (4)
(4)
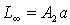 (5)
(5)
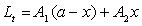 (6)
(6)
A1,A2是与温度、电解质性质,溶剂等因素有关的比例常数,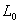 ,
,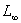 分别为反应开始和终了时溶液的总电导率。
分别为反应开始和终了时溶液的总电导率。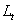 为时间t时溶液的总电导率。由(4),(5),(6)三式可得:
为时间t时溶液的总电导率。由(4),(5),(6)三式可得:
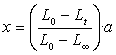
代入(2)式得:
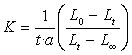 (7)
(7)
重新排列即得:

三、实验仪器及试剂(记录所用仪器型号、药品规格和溶液浓度):
DDS-llA型电导率仪(附DIS一型铂黑电极)1台,停表1只,恒温水槽1套,叉形电导池2只,移液管(25mL,胖肚)1根,烧杯(50mL)1只,乙酸乙酯(O.0200mol/L),氢氧化钠(O.0200mol/L)。
四、实验所用的主要仪器的工作原理、结构(实验装置图):

图1. DDS-llA型电导率仪
五、简述实验步骤和条件:
1、调节恒温槽为所测温度25℃。
2、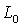 的测量:分别取10mL蒸馏水和10mL0.0200mol/L的NaOH溶液,加到洁净、干燥的叉形管电导池中充分混合均匀,置于恒温槽中恒温15min。用DDS-11A型数字电导率仪测定上述已恒温的NaOH溶液的电导率即为
的测量:分别取10mL蒸馏水和10mL0.0200mol/L的NaOH溶液,加到洁净、干燥的叉形管电导池中充分混合均匀,置于恒温槽中恒温15min。用DDS-11A型数字电导率仪测定上述已恒温的NaOH溶液的电导率即为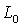 。
。
3、 的测量:在另一支叉形电导池直支管中加10mL 0.0200mol/L CH3COOC2H5,侧支管中加入10mL 0.0200 mol/L NaOH,并把洗净的电导电极插入直支管中。在恒温情况下,混合两溶液,同时开启停表,记录反应时间(注意停表一经打开切勿按停,直至全部实验结束),并在恒温槽中将叉形电导池中溶液混合均匀。在60min内分别测定6min、9min、12min、15min、20min、25min、30min、35min、40min、50min、60min时的电导率Lt。
的测量:在另一支叉形电导池直支管中加10mL 0.0200mol/L CH3COOC2H5,侧支管中加入10mL 0.0200 mol/L NaOH,并把洗净的电导电极插入直支管中。在恒温情况下,混合两溶液,同时开启停表,记录反应时间(注意停表一经打开切勿按停,直至全部实验结束),并在恒温槽中将叉形电导池中溶液混合均匀。在60min内分别测定6min、9min、12min、15min、20min、25min、30min、35min、40min、50min、60min时的电导率Lt。
作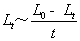 直线关系图,从斜率求出反应速率常数K
直线关系图,从斜率求出反应速率常数K
六、实验数据及现象的原始记录(需作表格的自作):
温度25℃ 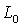 =2.20ms·cm-1
=2.20ms·cm-1

3、作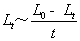 图:
图:
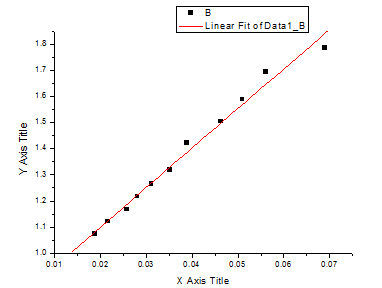
斜率 k=13.8165min-1;反应温度T1=25℃而反应速率常数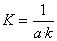 ,所以K=1/(13.8165 min-1×0.0200mol·L-1)=3.6189L·mol-1·min-1
,所以K=1/(13.8165 min-1×0.0200mol·L-1)=3.6189L·mol-1·min-1
八、 讨论(主要内容是:1误差分析;2实验中异常现象处理;3对本实验的改进意见;4回答思考题。):
误差分析
造成本实验误差的主要原因可能有:
1、恒温槽的温度不稳定,致使实验的结果存在一定的误差;
2、乙酸乙酯配置太久,部分挥发掉了,致使实验出现较大的偏差;
3、经过多次读数,误差比较大;
4、系统本身存在的偶然误差。
注意事项
1. 实验温度要控制准确
2. 切勿触及铂电极的铂黑
3. 乙酸乙酯溶液和NaOH溶液浓度必须相同。
4. 配好的NaOH溶液要防止空气中的CO2气体进入。
5. 乙酸乙酯溶液需临时配制,配制时动作要迅速,以减少挥
发损失。
回答思考题
1、 酸溶液所用的水中含有不与反应物生成物发生反应的电解质,对测定的结果有无影响?
答: 存在一定的影响。因为反应速率常数的值与反应条件如温度、催化剂、溶剂等有关,而杂质的存在影响了反应物的浓度,因而对实验结果存在一定的影响。
2、各溶液在恒温和操作过程中为什么要盖好?
答:因为温度升高,溶液的挥发度增大,将溶液盖好是为了减少其挥发,保证溶液的浓度不变;此外,NaOH溶液很容易与空气中的CO2反应,将其盖住就是为了尽量减少此反应的影响。
九、 结论(是否达到了预期目的,学到了那些新知识):
本实验虽存在一定的误差,但基本达到了预期的实验目的
学到的新知识:
1、熟悉并掌握了DDS-11A型数字电导率仪和恒温槽的使用方法
2、进一步了解了二级反应的特点,学会了用图解法求算二级反
应的速率常数。
十、参考文献(预习及写报告时实际参考文献):
[1] 《基础实验教材》 湘南学院化学与生命科学系
第二篇:电导法测定乙酸乙酯皂化反应的速率常数含思考题答案
电导法测定乙酸乙酯皂化反应的速率常数
07化四 ##
指导老师:## 小组成员:##
【实验目的】
①学习电导法测定乙酸乙酯皂化反应速率常数的原理和方法以及活化能的测定方法;
②了解二级反应的特点,学会用图解计算法求二级反应的速率常数;
③熟悉电导仪的使用。
【实验原理】
(1)速率常数的测定
乙酸乙酯皂化反应时典型的二级反应,其反应式为:
CH3COOC2H5+NaOH = CH3OONa+C2H5OH
t=0 C0 C0 0 0
t=t Ct Ct C0 - Ct C0 -Ct
t=∞ 0 0 C0 C0
速率方程式 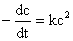 ,积分并整理得速率常数k的表达式为:
,积分并整理得速率常数k的表达式为:
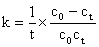
假定此反应在稀溶液中进行,且CH3COONa全部电离。则参加导电离子有Na+、OH-、CH3COO-,而Na+反应前后不变,OH-的迁移率远远大于CH3COO-,随着反应的进行,
OH- 不断减小,CH3COO-不断增加,所以体系的电导率不断下降,且体系电导率(κ)
的下降和产物CH3COO-的浓度成正比。
令 、
、 和
和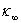 分别为0、t和∞时刻的电导率,则:
分别为0、t和∞时刻的电导率,则:
t=t时,C0 –Ct=K( -
- ) K为比例常数
) K为比例常数
t→∞时,C0= K( -
-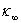 )
)
联立以上式子,整理得:
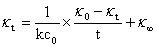
可见,即已知起始浓度C0,在恒温条件下,测得 和
和 ,并以
,并以 对
对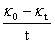 作图,可得一直线,则直线斜率
作图,可得一直线,则直线斜率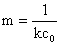 ,从而求得此温度下的反应速率常数k。
,从而求得此温度下的反应速率常数k。
(2)活化能的测定原理:
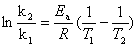
因此只要测出两个不同温度对应的速率常数,就可以算出反应的表观活化能。
【仪器与试剂】
电导率仪 1台 铂黑电极 1支 大试管 5支
恒温槽 1台 移液管 3支
氢氧化钠溶液(1.985×10-2mol/L) 乙酸乙酯溶液(1.985×10-2mol/L)
【实验步骤】
①调节恒温槽的温度在26.00℃;
②在1-3号大试管中,依次倒入约20mL蒸馏水、35mL 1.985×10-2mol/L的氢氧化钠溶液和25mL1.985×10-2mol/L乙酸乙酯溶液,塞紧试管口,并置于恒温槽中恒温。
③安装调节好电导率仪;
④ 的测定:
的测定:
从1号和2号试管中,分别准确移取10mL蒸馏水和10mL氢氧化钠溶液注入4号试管中摇匀,至于恒温槽中恒温,插入电导池,测定其电导率 ;
;
⑤ 的测定:
的测定:
从2号试管中准确移取10mL氢氧化钠溶液注入5号试管中至于恒温槽中恒温,再从3号试管中准确移取10mL乙酸乙酯溶液也注入5号试管中,当注入5mL时启动秒表,用此时刻作为反应的起始时间,加完全部酯后,迅速充分摇匀,并插入电导池,从计时起2min时开始读 值,以后每隔2min读一次,至30min时可停止测量。
值,以后每隔2min读一次,至30min时可停止测量。
⑥反应活化能的测定:
在35℃恒温条件下,用上述步骤测定 值。
值。
【数据处理】
①求26℃的反应速率常数k1,将实验数据及计算结果填入下表:
恒温温度=28.00℃  =2.29ms·cm-1
=2.29ms·cm-1
V乙酸乙酯=10.00mL [乙酸乙酯]=1.9850×10-2mol/L
VNaOH=10.00mL [NaOH]=1.9850×10-2mol/L
c0=0.5×1.9850×10-2mol/L
实验数据记录及处理表1:
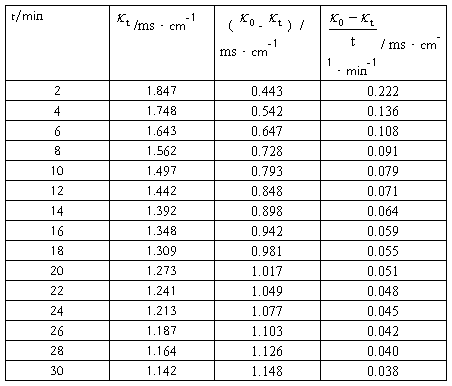
图1: -
-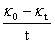 :
:
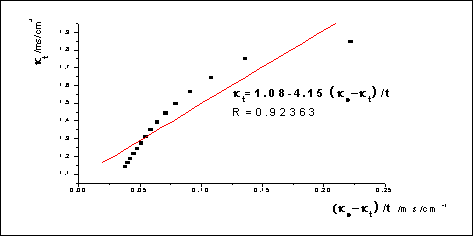
数据处理: 对
对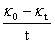 作图,求出斜率m,并由
作图,求出斜率m,并由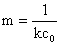 求出速率常数
求出速率常数
m=4.15,k1=1/(mc0)=1/(4.15*1.9850*0.5*10-2)mol·L-1·min=24.3L/(mol·min)
文献参考值:k(298.2K)=(6±1)L/(mol·min)
②采用同样的方法求35℃的反应速率常数k2,计算反应的表观活化能Ea:
a、35℃的反应速率常数k2
恒温温度=35.00℃ 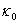 =2.63ms·cm-1
=2.63ms·cm-1
V乙酸乙酯=10.00mL [乙酸乙酯]=1.9850×10-2mol/L
VNaOH=10.00mL [NaOH]=1.9850×10-2mol/L
c0=0.5×1.9850×10-2mol/L
实验数据记录及处理表2:
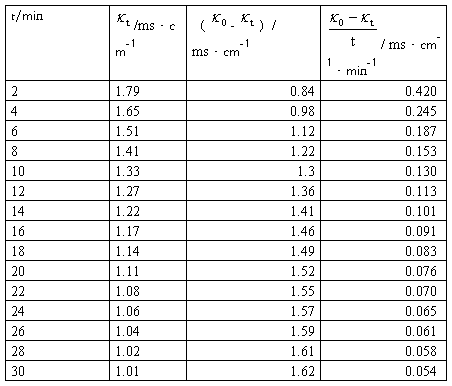
图2: -
-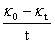 :
:
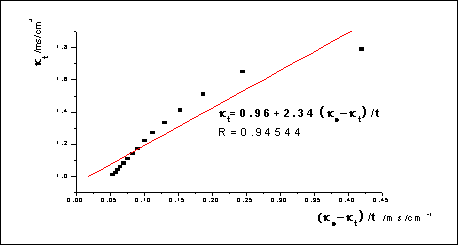
m=2.34,k1=1/(mc0)=1/(2.34*1.9850*0.5*10-2)mol·L-1·min=43.1L/(mol·min)
文献参考值:k(308.2K)=(10±2)L/(mol·min)
b.计算反应的表观活化能:
∵k1/k2=m2/m1
∴ln(k2/k1)=Ea/R·(1/T1-1/T2) ln(m1/m2)=Ea/R·(1/T1-1/T2)
∴Ea=Rln(m1/m2)·[T1T2/(T2-T1)]
=8.314×ln(4.15÷2.34)×[308×299÷(308-299)]J/mol
=48.7kJ/mol
文献值:Ea=46.1kJ/mol
相对误差:(48.7-46.1)÷46.1×100%=5.64%
【结果分析与讨论】
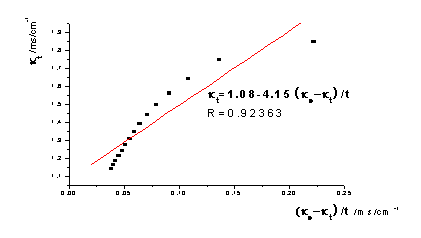
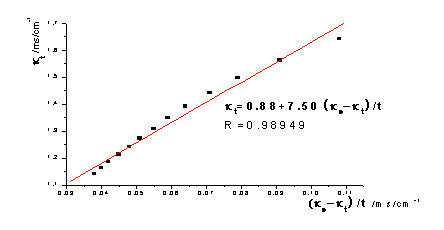
①根据本实验中测定的数据作 -
-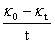 图,图形为抛物线并非直线:乙酸乙酯皂化反应为吸热反应,混合后体系温度降低,所以在混合后的几分钟所测溶液的电导率偏低。如果从6min开始测定,即去掉前两个数据,重新作图,则
图,图形为抛物线并非直线:乙酸乙酯皂化反应为吸热反应,混合后体系温度降低,所以在混合后的几分钟所测溶液的电导率偏低。如果从6min开始测定,即去掉前两个数据,重新作图,则 -
-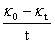 图线性提高了。以26.0℃数据为例作图对比:
图线性提高了。以26.0℃数据为例作图对比:
去点前:
去点后:
②作 -
-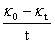 图得斜率m,根据m求出k值约为文献值的4倍:
图得斜率m,根据m求出k值约为文献值的4倍:
26.0℃:
m=4.15,k1=1/(mc0)=1/(4.15*1.9850*0.5*10-2)mol·L-1·min=24.3L/(mol·min)
文献参考值:k(298.2K)=(6±1)L/(mol·min)
35.0℃:
m=2.34,k1=1/(mc0)=1/(2.34*1.9850*0.5*10-2)mol·L-1·min=43.1L/(mol·min)
文献参考值:k(308.2K)=(10±2)L/(mol·min)
分析原因:实验过程中加入乙酸乙酯后没有充分混合就开始测定,由于电导率仪处于主要是乙酸乙酯的环境氛围内,所以测定的κt偏小,而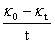 值偏大,则作图所得斜率偏小。由于实验过程中,加入乙酸乙酯的操作及插放电导率仪的操作都由我完成的,所以在不同温度下所测定的数据都出现的相同程度的负偏差。
值偏大,则作图所得斜率偏小。由于实验过程中,加入乙酸乙酯的操作及插放电导率仪的操作都由我完成的,所以在不同温度下所测定的数据都出现的相同程度的负偏差。
【提问与思考】
①为何本实验要在恒温条件进行,而CH3COOC2H5和NaOH溶液在混合前还要预先恒温?
答:因为反应速率k受温度的影响大,(kT+10)/kT=2~4,若反应过程中温度变化比较大,则测定的结果产生的误差较大;反应物在混合前就预先恒温是为了保证两者进行反应的时候是相同温度的,防止两者温差带来温度的变化影响测定结果。
②为什么CH3COOC2H5和NaOH起始浓度必须相同,如果不同,试问怎样计算k值?如何从实验结果来验证乙酸乙酯反应为二级反应?
答:因为乙酸乙酯的皂化反应是二级反应,为了简化计算,采用反应物起始浓度相同。如果不同,则k=1/t(a-b)·ln[b(a-x)/a(b-x)]。选择不同浓度的CH3COOC2H5和NaOH溶液,测定不同浓度的反应物在相同反应条件下的反应速率。
③有人提出采用pH法测定乙酸乙酯皂化反应速率常数,此法可行吗?为什么?
答:可以。CH3COOC2H5+OH-=CH3COO-+C2H5OH,反应速率方程为:v=dx/dt=k(a-x)(b-x),当起始浓度相同(a=b),对该式积分简化得:k=x/ta(a-x)。设t时刻溶液的pH值为ε(t),则此时溶液OH-的浓度为ct(OH-)=10(pH-14),即a-x=10(pH-14),ka=[a-10(pH-14)]/[t·10(pH-14)],用a-10(pH-14)对[t·10(pH-14)作图,可得一条直线,该直线的斜率m=ka,即k=m/a。
④为什么要将电导率仪的温度旋钮选为“25”?
答:测量值就是待测液在实际温度下未经补偿的原始电导率值。
