药品GMP认证缺陷整改报告撰写指导原则
2014-10-24
为进一步完善药品GMP认证管理,提高药品生产企业实施GMP的水平,指导企业采取有效措施对药品GMP认证现场检查中存在问题的整改,规范企业整改报告的撰写,根据《新疆维吾尔自治区〈药品生产质量管理规范认证管理办法〉实施细则》,特制订本指导原则。
1. 整改报告的基本要求
1.1 企业应在现场结束后40个工作日内,将整改报告上报自治区食品药品审评查验中心,同时抄报当地局。
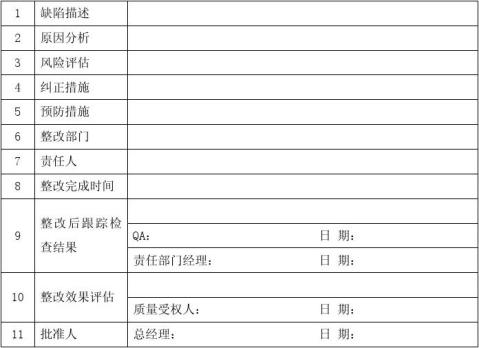
1.2 整改报告应由正文和附件两部分组成。正文部分至少应包括:缺陷的描述、产生缺陷的原因分析、相关的风险分析评估、采取的整改措施及完成情况。附件部分应是对正文部分进一步解释说明的证明性材料。
1.3 整改报告应内容完整、表达清楚,文字通顺、用语准确,充分如实反映企业的整改情况,并加盖企业公章。
2. 整改报告撰写的具体技术要求
2.1正文部分
2.1.1缺陷的描述
2.1.1.1企业需改正的缺陷不仅仅是检查报告中缺陷条款的内容,还应包括现场检查报告其他部分涉及的缺陷内容,如综合评定、需要说明的问题中涉及的缺陷等。
2.1.1.2 应对检查报告中涉及的每项缺陷进行详细的文字表达,包括发生的时间、地点、具体情节及相关人员等。
2.1.2原因分析
2.1.2.1 应对涉及的缺陷逐条进行原因分析。原因分析不应停留在引发缺陷的表面现象,应找到缺陷发生的根本原因。
2.1.2.2 对发生的缺陷至少应从以下方面进行分析:
2.1.2.2.1 涉及软件的,应分析是否制订了相应的文件;相应的文件的内容是否完善、合理;相应的文件是否已经过了培训;员工是否按照相应的文件进行了操作;质量管理部门是否进行了有效的监督。
2.1.2.2.2涉及硬件的,应主要从设计选型、施工安装、日常维护等因素进行原因分析,并审阅支持该硬件的文件系统。
2.1.2.2.3 涉及人员的,应分析是否配备了足够的人员;相关人员的能力是否胜任岗位的需要;相关人员是否受到了应有培训;培训的内容是否已被掌握。
2.1.3风险评估
结合原因分析的结果,对涉及的缺陷逐条进行全面的风险评估,确定该缺陷是由于系统原因造成还是偶然发生的个例。
2.1.3.1 评估至少应包括以下内容:
2.1.3.1.1 该缺陷带来的直接后果;
2.1.3.1.2 该缺陷可能发生频率的高低;
2.1.3.1.3 该缺陷涉及的范围,是否涉及本次检查范围外的产品;
2.1.3.1.4 该缺陷是否对产品质量产生直接的不良影响;
2.1.3.1.5 该缺陷是否对产品质量存在潜在的风险;
2.1.3.1.6 风险的高低程度。
2.1.3.2 风险评估结果的应用
认为存在的缺陷对已经生产或上市的产品产生质量风险的,企业应明确是否需要采取进一步的风险防范措施,包括拒绝放行、停止销售、召回、销毁等。
2.1.4采取的整改措施
采取的整改措施应包括纠正措施和预防措施。
2.1.4.1 纠正措施
企业应根据原因分析及风险评估的结果,针对缺陷产生的根本原因,在企业内部进行全面排查,举一反三,分析关联性环节是否存在同样问题,如考虑相邻批次、其他车间相同工序等,提出对缺陷采取的修正行动或拟采取的修正行动。
2.1.4.2 预防措施
对有可能再次发生的缺陷应提出明确的预防措施,以防止此类缺陷的再次发生。
2.1.5采取的整改措施应明确相关的责任部门和责任人,并明确完成时间。
2.2 附件部分
2.2.1企业应在附件提供所采取的风险防范措施和整改措施的证明性材料,材料至少应包括以下内容:
2.2.1.1 风险评估认为存在的缺陷对已经生产或上市的产品有质量风险的,采取拒绝放行、停止销售、召回、销毁等措施的,应提供产品的名称、规格、批次、数量、销售情况、流向及对产品的处理情况。
2.2.1.2 涉及关键岗位人员调整的,应提供相应的文件及相关人员的资质证明复印件。
2.2.1.3 涉及人员培训的,应提供相应的培训计划或培训记录,包括培训内容、时间、参加人员、考核方式、考核结果等。
2.2.1.4涉及文件系统的,应提供新起草或修订的文件文本,修订的文件应提供新老文件的对照,并标注修订的内容。新起草或修订的文件应有对相关人员进行培训的证明性材料。
2.2.1.5 涉及厂房设施设备变更的,应在文字说明的同时,附变更后图纸或照片等证明性材料。
2.2.1.6 涉及关键设施设备、供应商、工艺、检验方法等重要变更的,应提供相关的研究验证资料。
2.2.1.7 涉及计量校验的还应提供相应的计量校验合格证书。
2.2.1.8 涉及标识的,应提供改正后反映标识状况的照片或其他证明性材料。
2.2.1.9 涉及验证的,应提供相应的验证方案或验证报告。
2.2.1.10 涉及稳定性试验的,应提供稳定性试验方案或稳定性试验结果。
2.2.1.11 涉及有关许可证明的,应提供相应的许可证明文件、批准证明文件、备案件等。
第二篇:02 药品GMP认证整改报告模版
药品GMP认证现场检查
单位名称:
法人代表:
联 系 人:
联系电话:
注册地址:
生产地址:
邮政编码: 整改报告
年 月 日
云南省食品药品监督管理局药品认证审评中心:
****年*月*日-****年*月*日,贵中心药品GMP认证检查小组对我公司*******进行了药品GMP认证现场检查,检查结果如下:
严重缺陷:*项
主要缺陷:*项
一般缺陷:*项
对于检查中提出的缺陷项目,我公司高度重视,及时召开了整改会议,并成立了由总经理、质量总监、生产总监牵头、各部门负责人参与的GMP整改小组。按照药品GMP风险管理理念,深入分析缺陷产生原因,并根据分析结果,拟定切实可行的整改方案,确保措施得当、整改到位。目前检查中提出的缺陷项目已整改完成,具体整改情况如下:
1、****************************************************(缺陷内容);
以上整改是否妥当,请批评指正。
厂名
日期
