Department Involved: R&D Department (开发工程)/ Production Department (生产工程)、
Material Control Department (物料部)、Purchasing Department (采购部) 、Quality Department (品管部)
 Prepared by (组织人员) :
Prepared by (组织人员) :
Responsible Engineer (工程师) :
 Date (日期) :
Date (日期) :

Item Name and No. (产品名称/编号) :

 Customer (客户) :
Customer (客户) :
 Age Grade (适应年龄) :
Age Grade (适应年龄) :
 Sale Region (销售地区) :
Sale Region (销售地区) :
(A) Mechanical (物理和机械性)
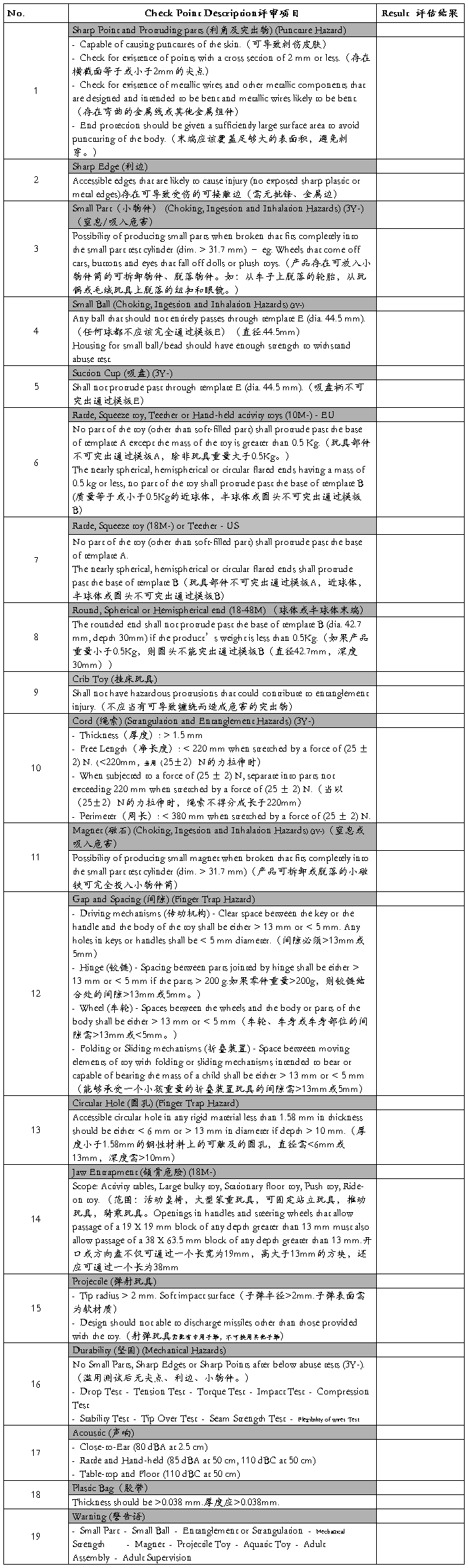
(B) Flammability (易燃性)

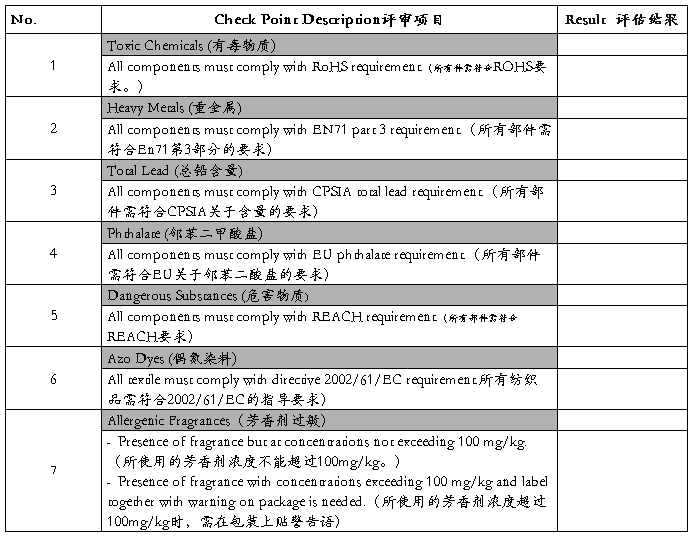
(C) Chemical (化学性)
(D) Electric Shock (电气性能)

(E) Radiation (放射性)

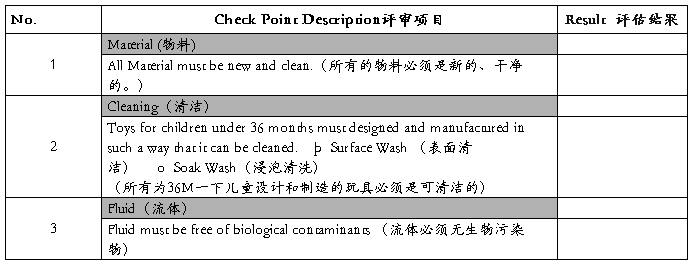
(F) hygiene (卫生性)
Comment on the Structure

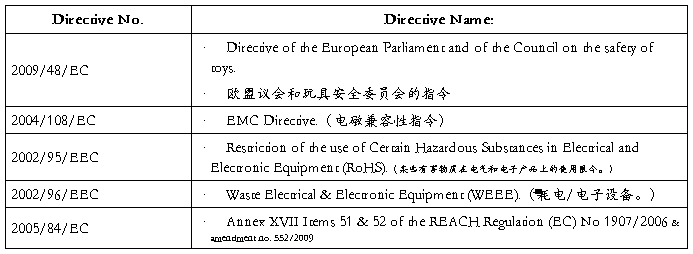
Applicable Standards 适用标准
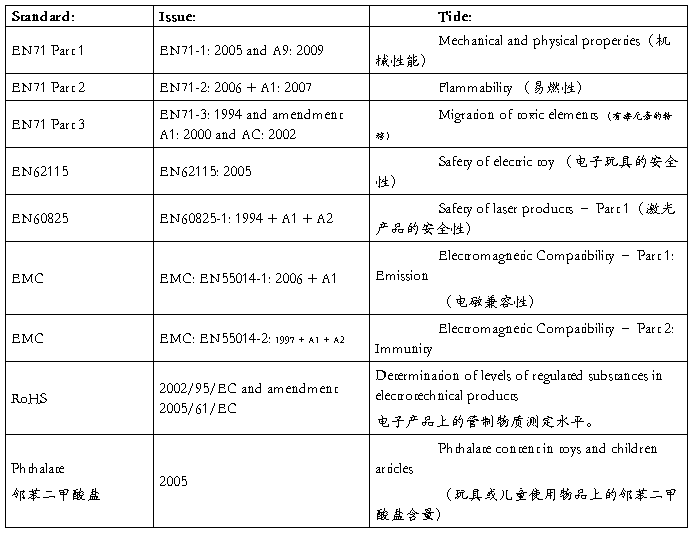
PRODUCT DESIGN EVALUATION
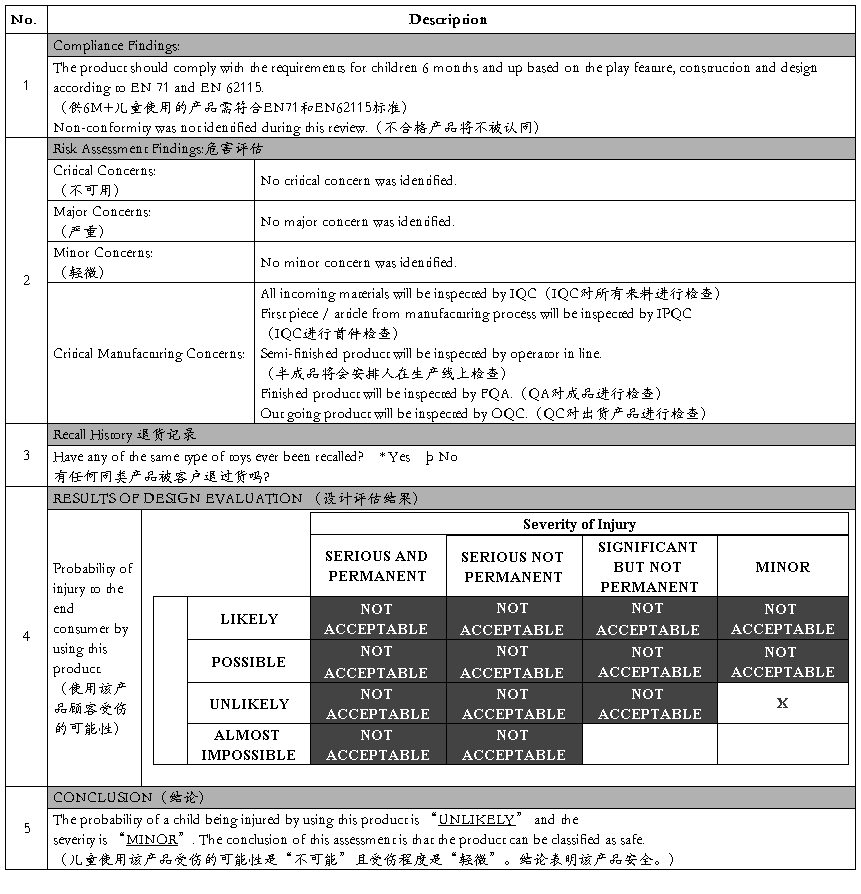
Approved by (核实人员) :
 Position (职位) : Quality Manager
Position (职位) : Quality Manager
 Date (日期) :
Date (日期) :
第二篇:产品质量风险评估报告
复方氨酚那敏颗粒
质量风险评估报告
报告起草: 年 月 日
报告审核: 年 月 日
报告批准: 年 月 日
有限公司
二〇##年八月
目 录
1.复方氨酚那敏颗粒注册相关信息…………………………………………1
2.复方氨酚那敏颗粒质量风险概述…………………………………………………1
3.复方氨酚那敏颗粒质量风险识别…………… ………………………………………1
4.风险分析……………………………………………………………………………3
4.1复方氨酚那敏颗粒风险失败模式建立……………………………………………3
4.2复方氨酚那敏颗粒风险分析…………………………………………………………4
4.2.1人员风险……………………………………………………………………4
4.2.2设备、仪器风险……………………………………………………………5
4.2.3复方氨酚那敏颗粒用物料风险……………………………………………………6
4.2.4复方氨酚那敏颗粒生产操作方法风险……………………………………………7
4.2.5复方氨酚那敏颗粒生产环境风险………………………………………………10
4.2.6复方氨酚那敏颗粒检验(测量)风险…………………………………………13
5.评估总结论与建议………………………………………………………………14
6.本风险评估依据与资料收集范围………………………………………………15
产品名称:复方氨酚那敏颗粒
产品阶段:生产全过程
评估小组成员:
评估日期:
1. 复方氨酚那敏颗粒注册相关信息
药品注册基本信息:通用名称:复方氨酚那敏颗粒,规格:每袋装10g,有效期:24个月。批准注册认证信息:取得批件时间: ,批件有效期:5年,再注册时间: ,批准文号:国药准字 ,执行标准:国家食品药品监督管理局标准WS-10001-(HD-0256)-2002。
我公司复方氨酚那敏颗粒的工艺规程、质量标准以及包装标签上的信息均按上述信息执行,与注册信息相符合。
2. 复方氨酚那敏颗粒质量风险概述
本报告复方氨酚那敏颗粒质量风险进行系统的分析评估,对复方氨酚那敏颗粒涉及的生产过程所有可能出现的风险进行评估,确定重点控制的目标,制定纠正和预防措施,对于高风险和中等风险的没有管理措施的必须确定降低风险的措施,低风险加强生产过程控制,确保产品质量,降低风险发生的可能性,提高可识别性,将风险控制在可接受水平。如果采取风险控制措施和预防措施后风险仍不可接受,应重新制定降低风险的措施和办法。本风险评估资料来源于公司复方氨酚那敏颗粒质量档案,历年生产记录,各种涉及的偏差、变更、验证、工艺规程、质量标准涉及等复方氨酚那敏颗粒生产的全部记录资料。
3、复方氨酚那敏颗粒风险识别
复方氨酚那敏颗粒质量风险的识别用鱼骨图来描述,根据鱼骨图(见下图)逐一展开分析和评价,找出风险点进行控制,把降低风险的措施落实到每个环节。
采用鱼骨图针对复方氨酚那敏颗粒产品质量风险,从人、机、料、法、环、测量六大因素进行风险识别分析:




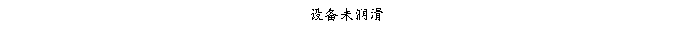


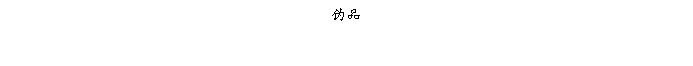



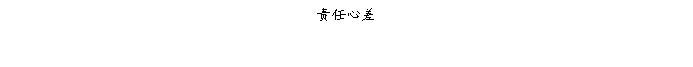






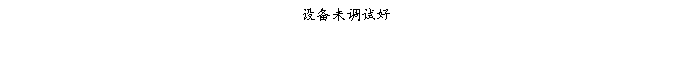

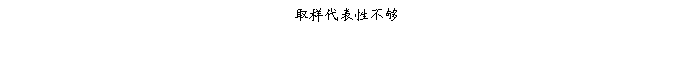
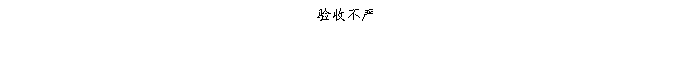
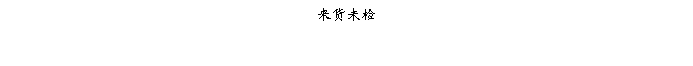


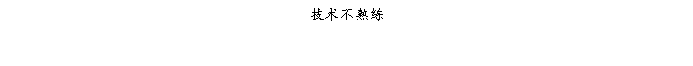


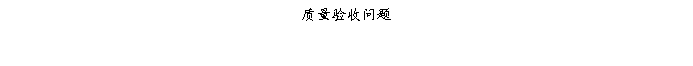







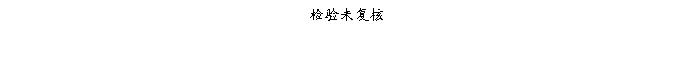
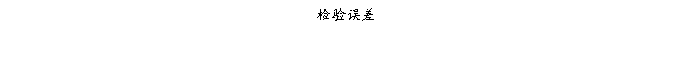












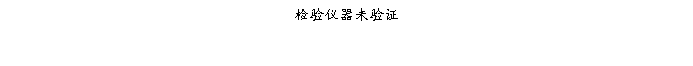
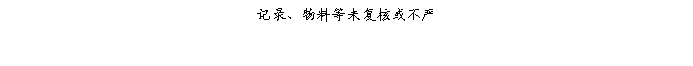

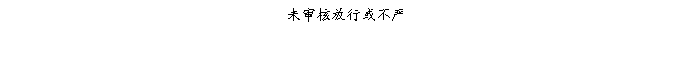





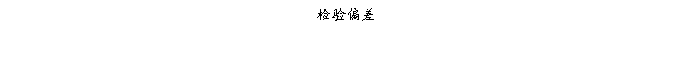

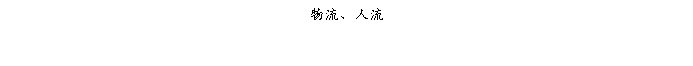
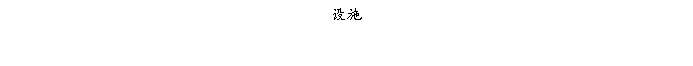





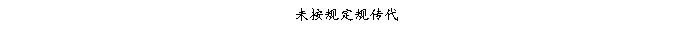





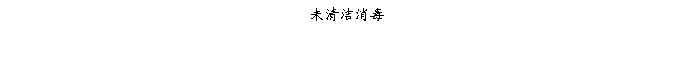
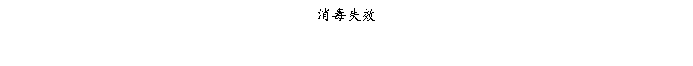








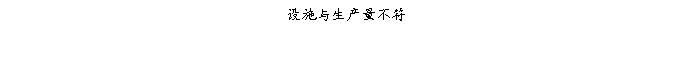
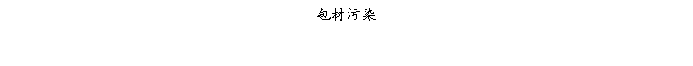







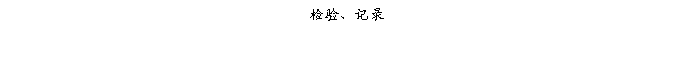
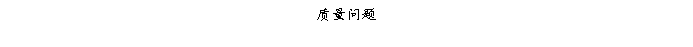
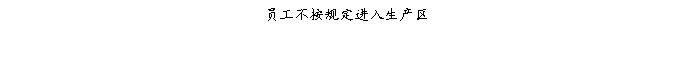
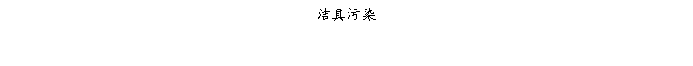

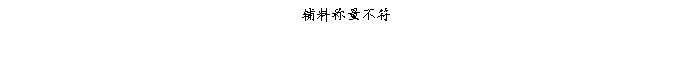



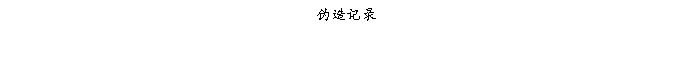




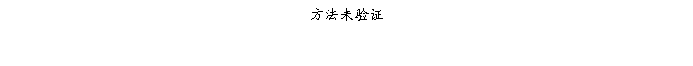

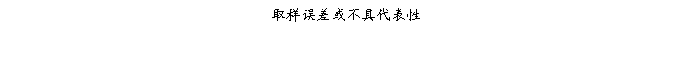

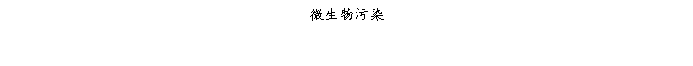




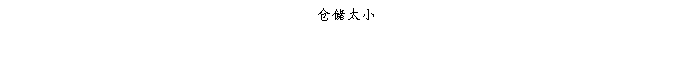



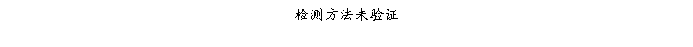
4、风险分析
4.1.复方氨酚那敏颗粒风险失败模式建立
上述通过鱼骨刺识别了复方氨酚那敏颗粒生产主要风险因素,对复方氨酚那敏颗粒生产质量风险有了初步的了解和认识,为了更深入了解复方氨酚那敏颗粒生产过程质量风险,下面建立风险失败模式(FMEA)进行详细分解分析复方氨酚那敏颗粒生产风险因素及风险严重程度,通过建立FMEA来减少、控制将来生产过程失败。
失败模式效果分析评分
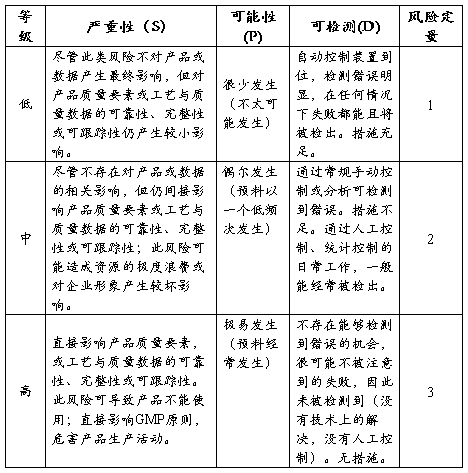
失败模式效果优先管理顺序分析 (风险优先系数RPN=S*P*D)

4.2.复方氨酚那敏颗粒风险分析
4.2.1人员风险
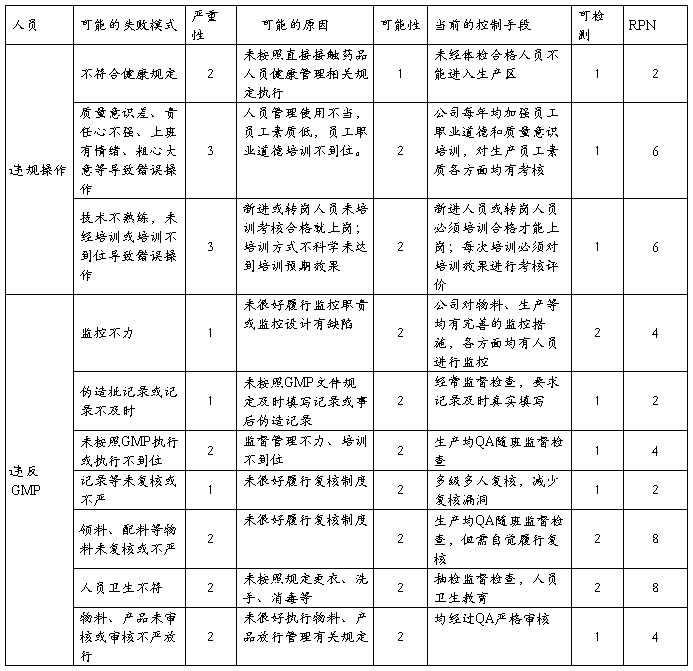
结论:人员方面经过失效模式分析评估,除领料、配料等物料复核和人员卫生存在中等程度的风险外,其它均为低风险。人员方面总体风险微小,整体风险可接受,但还是需加强领料、配料等复核和人员卫生方面的管理。违规操作风险虽然微小,但失效风险严重,需要加强有关管理制度的执行。
4.2.2设备、仪器风险
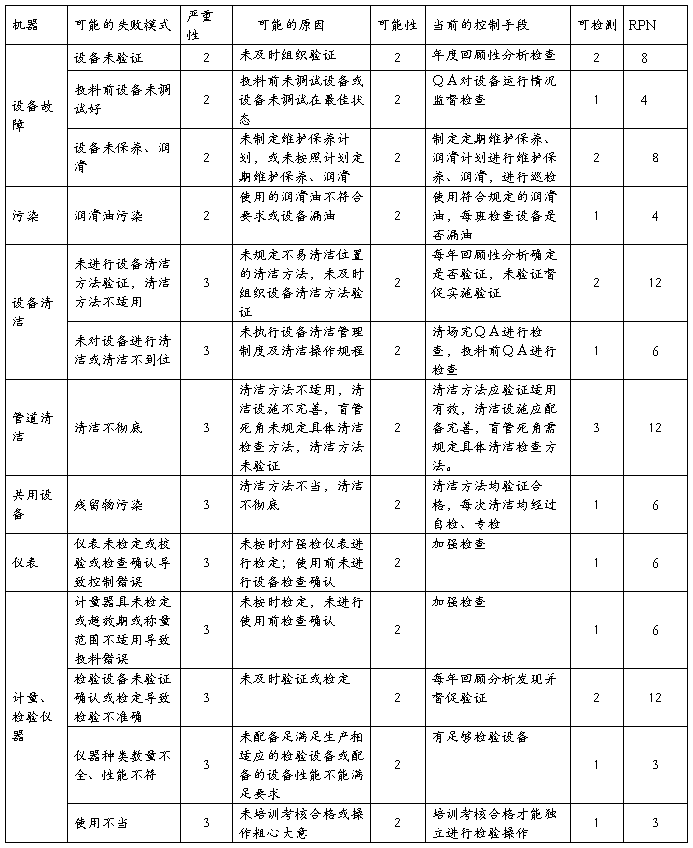
结论:设备仪器风险经过分析,公司设备仪器管理健全,不存在严重风险。设备验证、清洁方法验证、管道清洁、设备维护保养润滑、检验仪器验证及检定存在中等程度风险,其它方面均是微小风险。整体风险可接受,但应注意设备验证、清洁方法验证、设备维护保养润滑、检验仪器验证及检定的监督管理,设备不易清洁位置应详细规定清洁方法,应有别于一般表面清洁;管道应配备足够清洁设施、清洁方法经过验证适用有效、盲管死角规定具体的清洁检查方法,保证清洁彻底。
4.2.3复方氨酚那敏颗粒用物料风险
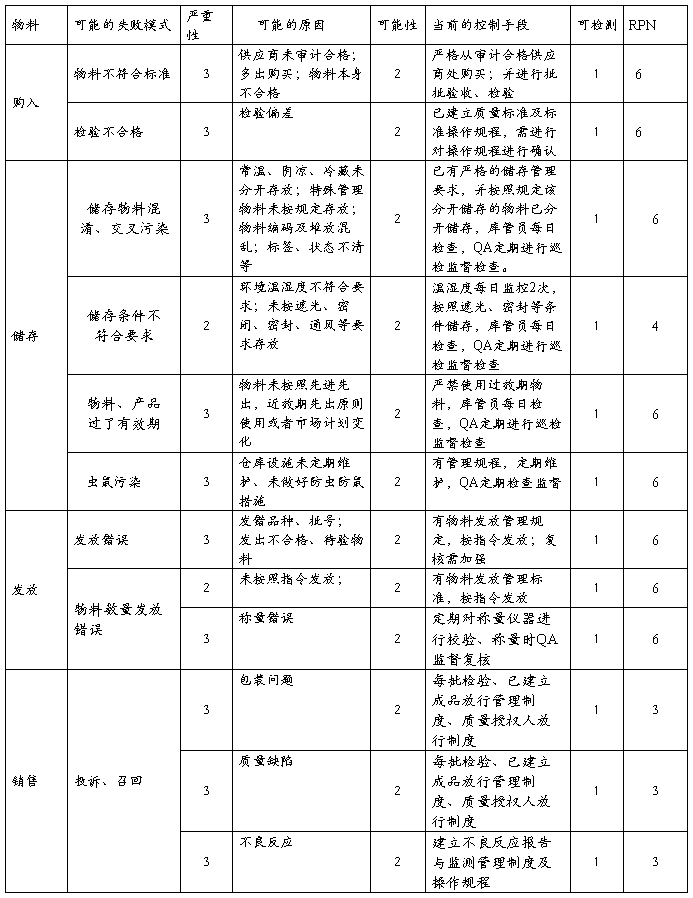
结论:复方氨酚那敏颗粒物料质量管理制度健全,各环节均有效控制,风险微小,完全可接受。但物料发生失效风险严重,平时依然需加强各种管理制度及操作规程的执行管理,不能放松。
4.2.4复方氨酚那敏颗粒生产操作方法风险
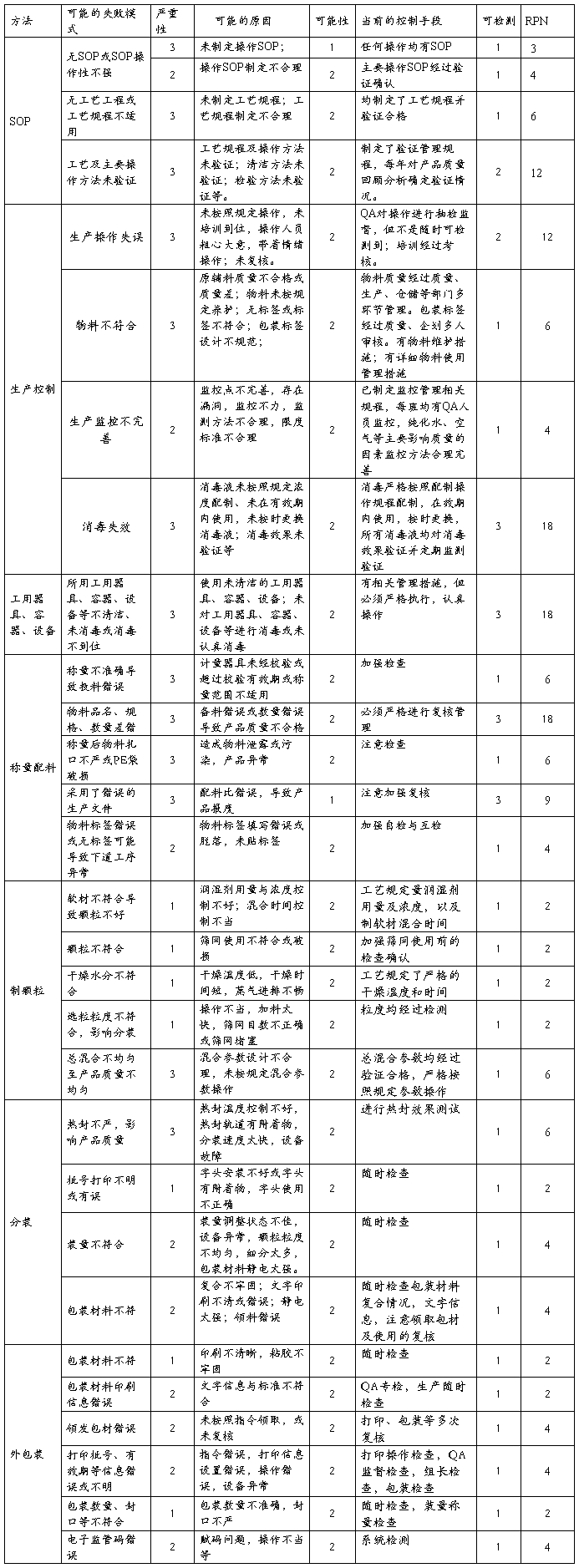
结论:通过对生产方法评估分析,复方氨酚那敏颗粒生产工艺规程与主要操作方法验证、操作失误存在中等程度风险。设备、工用具、容器等清洁消毒,配料错误因可检测性非常不强,存在高风险,在生产过程重在严格检查、复核,一丝不苟的执行有关操作规定,进一步完善操作与管理,避免失效。其它方面风险微小。复方氨酚那敏颗粒整体风险微小,少数中高风险环节管理措施完善,完全可接受,但注意加强中等及高风险环节的管理。
4.2.5复方氨酚那敏颗粒生产环境风险
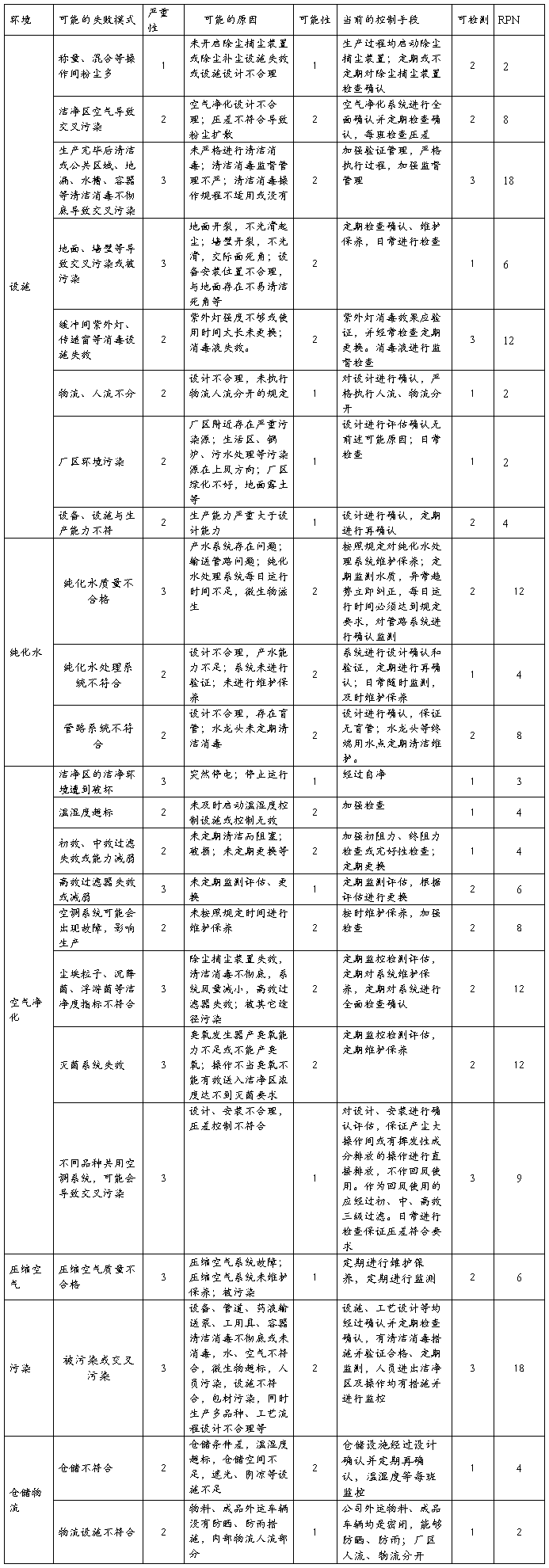
结论:通过对复方氨酚那敏颗粒生产环境分析评估,压差不符空气扩散的交叉污染、消毒设施失效、纯化水不合格及其管路不符合、空调系统故障、洁净度不达标、不同品种共用空调系统存在中等程度风险,清洁消毒不彻底或未按照规定清洁消毒存在高风险;其它方面风险微小。中等程度风险及高风险项目均制定了严格完善的操作规程、监督管理制度,认真执行可以有效控制和降低,因此复方氨酚那敏颗粒生产环境整体风险小,完全可以接受,但必须认真执行已制定各项操作规程及监督管理制度,特别要对高风险、中等风险项目、失效后果严重的风险项目加强监督管理、有效执行。
4.2.6复方氨酚那敏颗粒检验(测量)风险
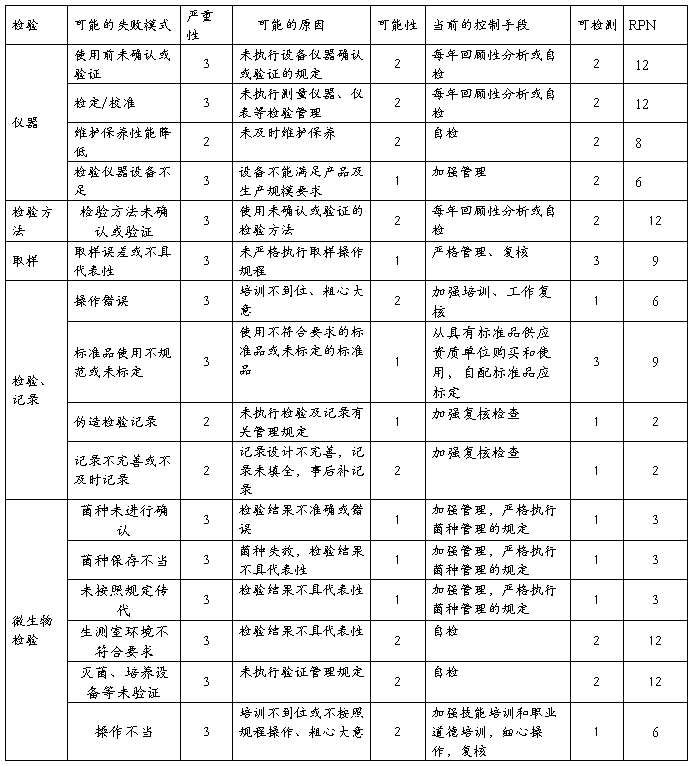
结论:经过对检验的风险分析评估,仪器确认或验证、仪器检定(校准)、检验方法确认或验证、取样、生测室环境、灭菌培养设备等验证存在中等程度风险,中等风险项目管理措施完善,关键在执行;其它项目风险微小,但一旦失效,可能导致检验结果误差或错误,进行错误指导生产操作和质量监管,最终威胁产品质量,因此虽然风险微小,但依然不能放松管理。检验风险总体可接受,但必须认真执行已制定各项操作规程及监督管理制度,保证有效执行。
5.评估总结论与建议
综合评估分析,复方氨酚那敏颗粒在生产过程中质量风险比较小,完全可接受,但建议做好如下管理:
加强本风险评估确定存在的中高风险项目管理,保证各项措施落实到位、有效执行,同时兼顾本风险回顾确定风险微小,但一旦失效后果严重的项目管理,避免失效发生。
每年对该品种的生产过程质量控制情况结合新的知识与经验进行风险回顾,分析评估原风险控制和改进情况,分析、评估,确认是否出现新的风险,如果出现新的风险是否对风险进行了评估,并制定了纠正和预防措施,将风险降低至可接受限度。
6.本风险评估依据及资料收集范围
l 《药品生产质量管理规范》(20##年修订)
l 《药品GMP指南》2011
l 复方氨酚那敏颗粒工艺规程及涉及全部质量标准、注册资料
l 历年涉及投诉、召回、质量缺陷等质量档案
l 历年相关变更与偏差
l 公司质量体系全部管理制度及操作规程
l 涉及相关设备、工艺、清洁、厂房设施等的验证
l 历年日常监控、监测记录与总结报告
l 历年设备使用、批生产、检验、稳定性考察等记录
l 年度产品质量回顾分析
l 涉及相关风险评估与年度总结报告
l 其它涉及有关资料、记录
