药品不良反应/事件报告表
新的□ 严重□ 一般□ 医疗卫生机构□ 生产企业□ 经营企业□ 个人□ 编码
单位名称: 部门: 电话: 报告日期: 年 月 日
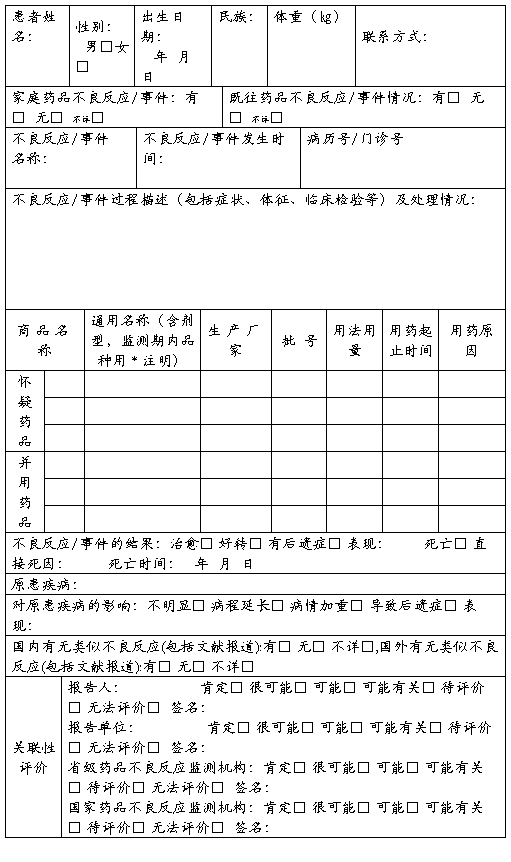
报告人职业(医疗机构):医生□ 药师□ 护士□ 报告人职务职称(企业): 报告人签名:
第二篇:药品不良反应报告表
附表1
药 品 不 良 反 应 / 事 件 报 告 表
首次报告□ 跟踪报告□ 编码:
报告类型:新的□ 严重□ 一般□ 报告单位类别:医疗机构□ 经营企业□ 生产企业□ 个人□ 其他□
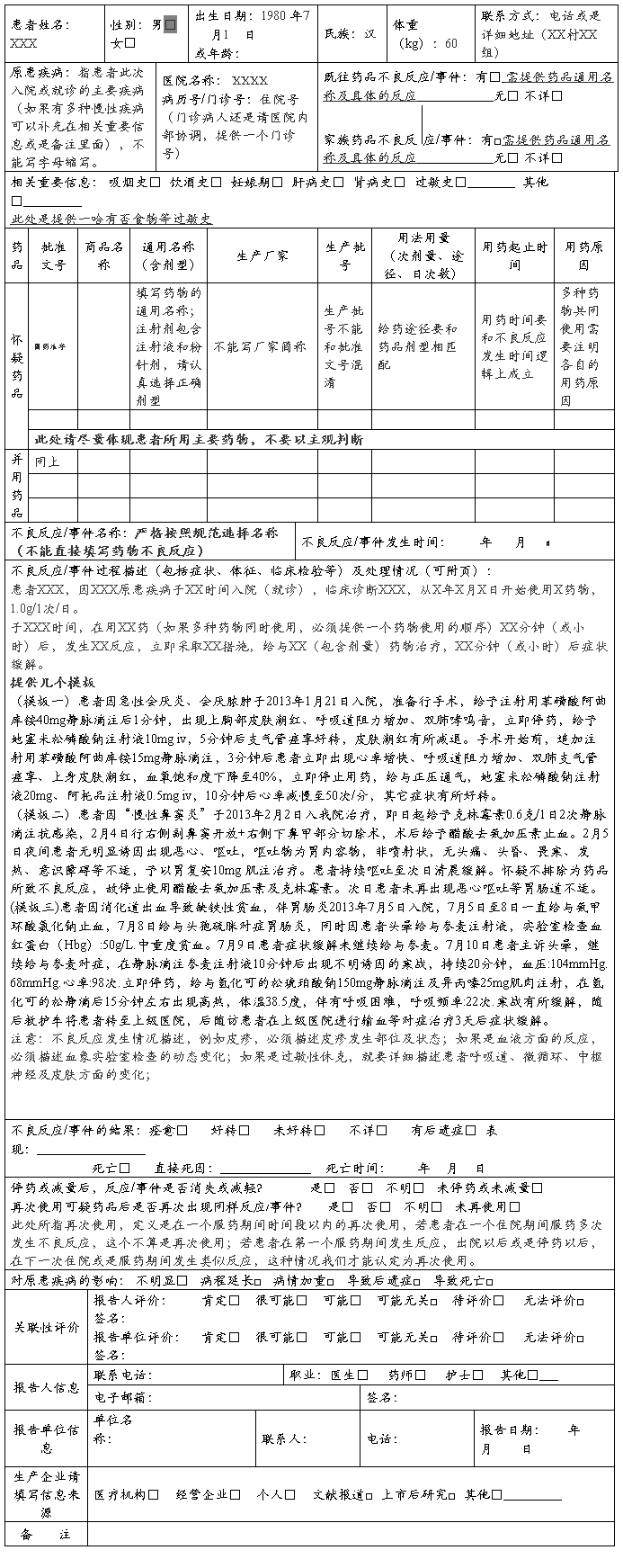
药品不良反应报告表
部分项目填报注意事项
一、药品不良反应事件名称及描述
1.如果患者出现皮疹伴瘙痒,不要把二者同时列为一个不良反应,应当分类描述为“皮疹;瘙痒”,
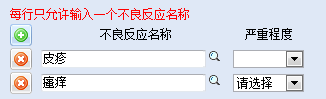
对于皮疹的发生部位、大约形态进行描述;
2.如果患者发生多种过敏反应,就不用分类描述,直接描述为“过敏反应”或是“过敏样反应”;不属于过敏反应的其他症状,应当分类描述;
3.如果患者出现过敏性休克,就必须描述患者的临床表现(包含呼吸道阻塞、微循环障碍、中枢神经系统症状及皮肤过敏症状)及体征;
例如头晕、面色苍白、呼吸困难、胸闷、腹痛、出汗、脉搏增快及血压下降等;此时相应的体征进行描述,如体温、心率、血压、呼吸频率等;还包含不良反应发生前后的症状和体征的动态变化。
4.如果患者出现血象异常,要将不良反应发生前后相应指标、实验室检查进行描述;
例如患者白细胞降低,此时就需要提供患者入院时(或服药前)白细胞指数,服药后发生不良反应是监测的白细胞指数以及采取措施停药后患者白细胞有所恢复的指数。
5.如果患者出现消化道反应,例如腹泻、呕吐等,请具体描述一哈相关的症状;
例如腹泻,一日几次、什么性状;呕血,一日几次、颜色等性状;呕吐,一日几次、内容物是什么。
二、药品不良反应发生后采取的措施及转归
1、药品不良反应发生以后,主要采取的治疗措施要进行描述。例如立即停药,给与抗过敏治疗(过敏反应)、给与升白细胞治疗(白细胞下降)、给与物理降温(高热)等对症治疗。具体的治疗措施,例如给与地塞米松10mg肌肉注射,要尽量详细描述对症治疗的药物及剂量。
2、药品不良反应的转归,要尽量描述采取对症治疗之后患者的转归。有的医疗机构在患者刚刚发生不良反应,采取措施尚未缓解的时候就立即上报,这种是不规范的。
国家规定药品不良反应报告的上报时限。大家应当按照规定时限完整的对药品不良反应进行上报。

