Q/企业缩写
风 险 管 理 文 档
(本文件在质量体系文件集里的编号)
产品名称:
产品编号:

XXXXXXXXXXXXXXXX 公司
风险管理文档
1 目的
文档对 的全部风险管理活动进行了记录,用来证明风险管理的符合性,并为产品设计和产品安全性评估提供相关的依据。
2 规范性引用
下列文件中的条款,通过本文档相关条款的引用成为村文档条款。
YY/T 0316—2003 医疗器械 风险管理对医疗器械的应用
注册产品标准
3 产品描述
3.1 产品特征
a 概况(产品类型等的描述)
b 预期用途
c 预期目的
d 适用环境
e 产品的使用方法
3.2 产品寿命周期阶段
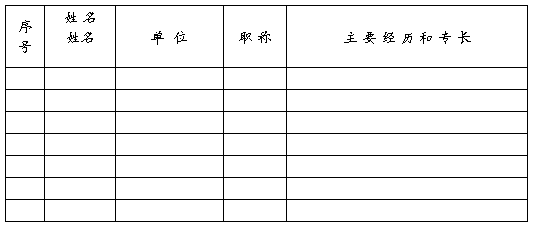
4 风险管理工作执行者简介
5 风险的可接受性准则
5.1 风险可接受性的决策过程
此过程中有三个决策点,对风险的可接受性提出不同的问题:
a 风险是否低到不需要对它进行考虑 ?
b 是否不再有任何理由去考虑风险,或者风险已降到合理可行的低水平,并且风险已被受益超过 ?
c 是否所有的风险对所有受益的全面平衡是可接受的?
在有适当的数据可资利用的情况下,应优先考虑对风险进行定量分类。
5.2 风险发生概率水平的分类
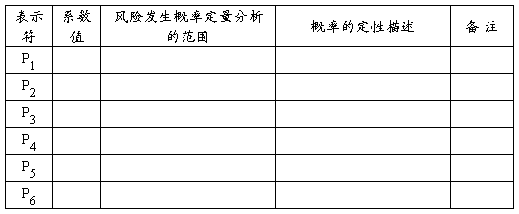
5.3 风险严重度水平的分类

5.4 可接受系数 Ac
Ac = Pi + Si
5.5 广泛可接受区
Ac ≤ ;
该区域内,风险是可以接受的,并且不需要主动采取风险控制。
5.6 ALARP(合理可行)区
< Ac ≤ ;
该区域内,应先考虑接受风险的受益和进一步降低的可行性,然后对风险与受益进行比较,如果受益超过风险,则风险是可接受的;如果受益没有超过风险,则风险是不可接受的。任何风险都应降到可行的最低水平。
5.7 不容许区
Ac > ;
该区域内,风险如果不能予以降低,则判断为是不容许的。
6 产品及附件危害清单
以下各条款序号同时作为后续风险管理中的产品危害的编号
6.1 产品在疾病的诊断、预防、监护、治疗或缓解,创伤和残疾的补偿,解剖方面的替代或矫正,妊娠的控制等方面起什么作用 ?
可能的危害:
6.2 产品是否用于生命维持或生命支持 ?
可能的危害:
6.3 在产品失效的情况下是否需要特殊的干预 ?
可能的危害:
6.4 是否有接口设计方面的特殊问题,可以导致不经心的使用错误 ?
可能的危害:
6.5 产品是否预期和患者或其他人员接触 ?
可能的危害:
6.6 在产品中包含有何种材料和/或组分或与其共同使用、或与产品接触 ?
可能的危害:
6.7 是否有能量给予患者或从患者身上获取 ?
可能的危害:
6.8 是否有物质提供给患者或从患难身上提取 ?
可能的危害:
6.9 是否由产品处理生物材料然后再次使用 ?
可能的危害:
6.10 产品是否以无菌形式提供或准备由使用者灭菌,或用其他微生物控制方法灭菌 ?
可能的危害:
6.11 产品是否预期由用户进行常规清洁和消毒 ?
可能的危害:
6.12 产品是否预期改善患者的环境 ?
可能的危害:
6.13 产品是否进行测量 ?
可能的危害:
6.14 产品是否进行分析处理 ?
可能的危害:
6.15 产品是否预期和医药或其它医疗技术联合使用 ?
可能的危害:
6.16 是否有不希望的能量或物质输出 ?
可能的危害:
6.17 产品是否对环境影响敏感 ?
可能的危害:
6.18 产品是否影响环境 ?
可能的危害:
6.19 是否需要维护和校准 ?
可能的危害:
6.20 产品是否有软件 ?
可能的危害:
6.21 产品是否有储存寿命限制 ?
可能的危害:
6.22 是否有延迟/或长期使用效应 ?
可能的危害:
6.23 产品承受何种机械力 ?
可能的危害:
6.24 是什么决定产品的寿命 ?
可能的危害:
6.25 产品是否预期一次性使用 ?
可能的危害:
6.26 产品是否需要安全的退出运行或处置 ?
可能的危害:
6.27 产品的安装或使用是否要求专门的培训 ?
可能的危害:
6.28 是否需要建立或引入新的生产过程 ?
可能的危害:
6.29 产品的成功使用,是否决定性的取决于人为因素,例如使用者接口 ?
可能的危害:
6.30 产品是否有连接部分或附件 ?
可能的危害:
6.31 产品是否有控制接口 ?
可能的危害:
6.32 产品是否有显示信息 ?
可能的危害:
6.33 产品是否由菜单控制 ?
可能的危害:
6.34 产品是否预期为移动式或便携式 ?
可能的危害:
7 产品风险管理一览表
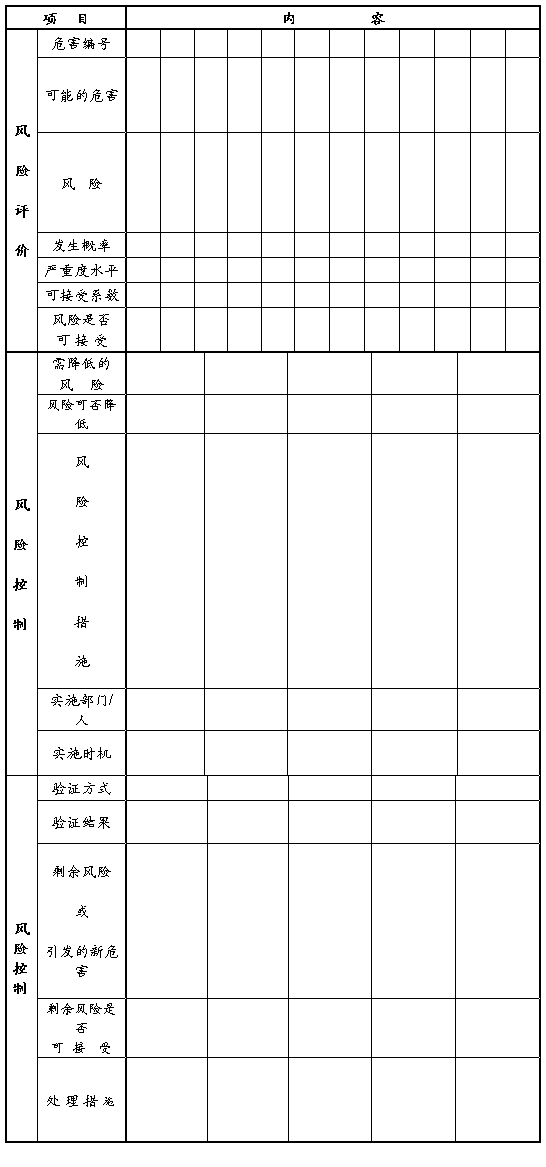
8 风险管理过程的结果
编制: 审批:
9 生产后的信息
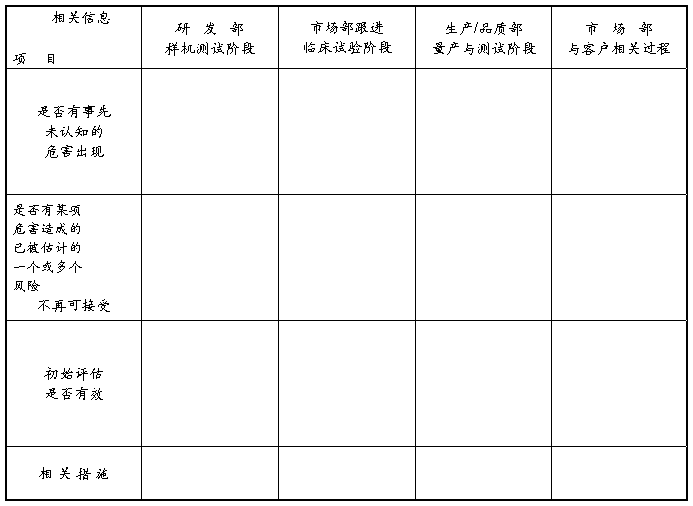
10 风险管理活动中相关附录
包括受益与风险对比分析及相关资料,风险控制措施验证相关记录、数据,风险再管理等资料。
第二篇:医疗器械 注册标准模板 注册标准范本
00ICS

YZB/粤
********有限公司 发布
Q/TD 001—2001
前 言
本产品目前尚无相应的国家标准和行业标准,为了规范市场,保证产品质量,维护消费者权益,特制定本标准作为组织生产和检验的依据。
本标准的编写格式按照GB/T1.1-2000标准化工作导则第一部分《标准的结构和编写规则》和GB/T1.2-2002标准化工作导则第二部分《标准中规范性技术要素内容的确定方法》编写的。
本标准由********有限公司提出。
本标准由********有限公司起草。
本标准主要起草人:****
企业标准 编写与备案
专业提供企业标准编写备案服务,欢迎垂询。
Q1270007512
企业标准工作室
业务范围(全国各地):
1、国家标准、行业标准的标准文本;
2、企业标准/注册标准/执行标准+编写/备案;
3、采用国际标准产品认可(采标标志)申报备案; 4、企业标准体系建立/标准化良好行为企业创建。
企业标准/注册标准 编写与备案 Q1270007512 1
Q/TD 001—2001
定制式义齿
1 范围
本标准规定了活动义齿和固定义齿的定义、分类与组成、技术要求、试验方法、检验规则、标志、标签、使用说明书、包装、运输和贮存。
本标准适用于义齿加工单位根据医疗机构设计的图样,规定的材料和提供的牙模进行加工的活动和固定义齿。
2 规范性引用文件
下列文件中的条款通过本标准的引用而成为本标准的条款。凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否可使用这些文件的最新版本。凡是不注日期的引用文件,其最新版本适用于本标准。
GB9969.1 工业产品使用说明书 总则
GB/T191 包装储运图示标志
GB6387 齿科材料名词术语
YY0270 牙科学 义齿基托聚合物(义齿基托树脂)
YY0300 牙科学 合成树脂牙
YY0301 牙科学 陶瓷牙
GB15980 一次性使用医疗用品卫生标准
3 定义
3.1 可摘局部义齿
是牙列缺损的修复方法之一,它是指利用天然牙和基托覆盖的粘膜、骨组织作支持,靠义齿的固位体和基托固位,患者能自行取摘戴的一种修复体。
3.2 全口义齿
为牙列缺失患者制作的义齿称全口义齿。
3.3 人工牙
是义齿代替缺失牙建立咬合关系,恢复咀嚼功能和外形的部分。
3.4 基托
是连接义齿各部件成一整体,在其上排列人工牙,承担、传递和分散咬合力,加强义齿
的固位和稳定的部件。
3.5 固位体
是可摘局部义齿重要组成部件之一,义齿借固位体得以固位。
3.6 连接体
是可摘局部义齿的组成部分之一,可将义齿的各部分连接在一起,同时还有传递和分散咬合力的作用。
2 企业标准/注册标准 编写与备案 Q1270007512
Q/TD 001—2001
3.7 固定义齿
固定义齿主要是利用缺牙间隙相邻两侧或一侧的天然牙作为支持,通过其上的固位体将义齿粘固于天然牙上,患者不能自行摘戴,故称为固定义齿。
3.8 固位体
固位体是在固定义齿基牙上制作的全冠、部分冠、桩冠、嵌体等。
3.9 桥体
桥体即人工牙,是固定义齿修复缺失牙的形态和功能的部分。
3.10 连接体
连接桥体与固位体的部分称为连接体。
3.11 固定修复体
用于恢复牙体缺损的修复体,包括嵌体,部分冠,全冠,桩冠,种植体牙冠等。
3.12 嵌体
前提为嵌入牙冠内的修复体。
3.13 部分冠
部分冠为覆盖部分牙冠表面的修复体。
3.14 全冠
全冠为覆盖全部牙冠表面的修复体。
3.15 桩冠
桩冠是利用冠钉插入残根先形成金属桩核或树脂核,然后再制作全冠修复体的总称。
3.16 种植体牙冠
种植体牙冠是在植入牙槽骨内的种植体上制作的人工牙冠。
4 分类与组成:
4.1 活动义齿的分类
活动义齿分为全口义齿和局部可摘义齿。
4.2 结构组成
4.2.1 全口义齿由基托和人工牙组成。
4.2.2 局部可摘义齿由人工牙、基托、固位体和连接体组成。
4.3 材料组成:活动义齿的主体原材料应经过医疗器械产品注册。
4.4固定义齿的分类
固定义齿分为固定修复体和固定义齿,其中固定修复体包括嵌体、部分冠、全冠、桩冠和种植体牙冠。
4.5 结构组成
固定义齿由固位体、桥体和连接体组成。
4.6 材料组成
固定义齿的主体原材料应经过医疗器械产品注册。
5.要求:
5.1 活动义齿的制作符合口腔临床医生的设计要求。
5.2 外观
5.2.1 磨光面
5.2.1.1 金属表面应高度抛光,无划痕,金属基托边缘园钝不尖锐,铸造卡环和弯制卡环的尖端应该园钝不尖锐,表面粗糙度应达到Ra≤**。
5.2.1.2 树脂基托表面应光滑有光泽,不应有气孔和裂纹。
5.2.2 义齿组织面应无残存石膏,无尖锐物。
5.3 铸造基托、连接体和卡环内部应无气孔、夹杂。
5.4. 基托边缘应该与石膏模型相贴合,无明显晃动、翘动。
企业标准/注册标准 编写与备案 Q1270007512 3
Q/TD 001—2001
5.5. 卡环应该与石膏模型相贴合。
5.6. 咬合关系:全口总义齿的上、下牙合修复体对 后,4-7牙位均应有接触,正中牙合、侧向牙合及前伸牙合时,都不能有早接触,上、下牙合修复体之间应无翘动现象。
5.7 产品卫生指标:污染菌应≤**cuf/g, 致病菌不得检出。
5.8 固定义齿的制作符合口腔临床医生的设计要求。
5.9外观
5.9.1 修复体瓷质表面颜色符合医生设计要求。
5.9.2 修复体表面光洁度
修复体瓷质表面应该光洁,无裂纹、无气泡;
金属表面高度抛光,表面粗糙度应Ra≤**,应无裂纹、无气泡,没有任何粗糙面和纹理,反光均匀一致。
5.9.3 修复体表面形态
修复体的外形及大小应与同名牙相匹配,应符合牙齿的正常解剖特点;
冠修复体唇、颊面的细微结构应于正常牙一致。
5.10修复体的咬合关系
修复体的咬合面应有接触点,但正中牙合、侧向牙合及前伸牙合时,不应有早接触及其他咬合障碍。
5.11 修复体的邻接关系
修复体的邻面于相邻牙之间的接触部位与同名正常牙的接触部位相一致。
5.12 修复体的边缘
固定义齿的边缘与模型应有良好的密合度,交接处无明显缝隙,无晃动、翘动。
5.13 产品卫生指标: 表面污染菌应≤**cuf/g;致病菌不得检出。
6 试验方法:
6.1 活动义齿的设计要求:活动义齿对照医生的设计图样和指示单应符合5.1条规定。
6.1.1 外观
磨光面:用4倍放大镜目力检查各磨光表面。其表面粗糙度用Ra0.025的样块进行比较,结果应符合
5.2.1条的规定。
6.1.2目测检查义齿组织面应符合5.2.2条的规定。
6.1.3 目力观察活动义齿的边缘是否与模型贴合,用手指按压义齿轻轻晃动检查义齿是否晃动或翘动应符合5.4条的规定.
6.1.4 目力检查卡环是否与模型贴合情况,应符合5.5条的规定。
6.1.5 咬合关系
将咬合色纸置于活动义齿的咬合面及对合牙之间,做正中咬合、前伸咬合、侧向咬合
运动,检查义齿和模型的着色点应符合5.6条的规定。
6.1.6 按照GB15980-1995中附录C的方法进行。
6.2 固定义齿对照医生的设计图样和指示单应符合5.1条规定。
6.2外观
6.2.1 用VITA比色板、SHOFU比色板,以同一背景目测检查,以同一背景目测检查,修复体瓷质表面颜色与比色板是否相符。
6.2.2 用4倍放大镜目力观察和用粗糙度Ra0.025的比较块对比应符合5.2.2的规定。
6.2.3 用4倍放大镜目力观察应符合5.2.3的规定。
6.2.4. 将厚度为**毫米的咬合色带置于固定义齿的咬合面及对合牙之间,做正中咬合、前伸咬合、侧向咬合运动,检查义齿和模型有无着色点,结果应符合5.3.条的规定。
6.2.5 用4倍放大镜目力观察并将厚度为**毫米的咬合色带置于固定义齿的近中或远中与邻牙之间并4 企业标准/注册标准 编写与备案 Q1270007512
Q/TD 001—2001
抽出,检查咬合色带有否破损,结果应符合5.4条的规定。
6.2.6 在10倍放大镜下观察固定义齿的边缘是否与模型密合情况,用手指按压义齿轻轻晃动检查义齿是否晃动或翘动,结果应符合5.5条的规定。
6.2.7 按照GB15980-1995中附录C的方法进行。
7 检验规则
7.1 活动义齿出厂检验:
对每个活动义齿产品从5.1~5.6条逐项检测
注:卫生指标每年检验一次。
7.2 判定规则和复验规则:
5.1-5.6条中任一条不合格即为产品不合格,进行修复直至全项合格。
7.3固定义齿出厂检验:
对每个固定义齿产品从5.1-5.5条逐项检测
注:卫生指标每年检验一次。
7.4 判定规则和复验规则:
5.1-5.5条中任一条不合格即为产品不合格,进行修复直至全项合格。
8 标志、产品使用说明:
8.1 标志
产品内包装上应有订单号码和客户名称,并附单据。
产品外包装上应印有产品名称,公司名称,公司地址,联系方式,生产许可证号等内容。
8.2 产品使用说明
活动义齿见附录A 固定义齿见附录B
9 包装和运输:
9.1 包装
内包装:产品用清洁的塑料袋密封包装,并做缓冲保护。
外包装:经过内包装的产品与模型及相关单据一同包装在外包装袋中。
9.2 运输
运输过程注意防震。
9.3 每一产品包装均附检验合格证和产品使用说明。
企业标准/注册标准 编写与备案 Q1270007512 5
