高一化学月考试题
有关相对原子质量H 1 C 12 O 16 Na 23 Mg 24 Al 27 Fe 56
一 单项选择
1 实验室中对于少量金属钠的保存方法, 正确的是 ( )
A.保存在水中 B.密封,保存在广口瓶中
C.用铝箔包裹,密封在广口瓶中 D.密封,保存在煤油中
2 下列物质中能与水反应的是 ( )
A. CuO B. CaO C. Fe2O3 D. Al2O3
3.铁和水蒸气在高温条件下发生反应3Fe+4H2O(g)  Fe3O4+4H2 ,在此反应中水是( )
Fe3O4+4H2 ,在此反应中水是( )
A.氧化剂 B.还原剂
C.既是氧化剂又是还原剂 D.既不是氧化剂又不是还原剂
4.制备氯化物时,常用两种方法:①用金属与氯气直接化合制得:②用金属与盐酸反应制得。用以上两种方法都可制得的氯化物是 ( )
A.AICl3 B.FeCl3 C.FeCl2 D.CuCl2
5. 将Fe(OH)2在空气久之后用酒精灯加热灼烧至恒重,所得的最终产物是( )。
A、FeO B、Fe2O3 C、Fe3O4 D、Fe(OH)3
6、下列反应,其产物按红、红褐、淡黄的顺序排列的是 ( )
①金属钠在纯氧气中燃烧 ②FeSO4溶液中滴入NaOH溶液,并在空气中放置一段时间 ③FeCl3溶液中滴入KSCN溶液
A.②③① B.③②① C.③①② D.①②③
7.下列物质中既能跟稀H2SO4反应, 又能跟氢氧化钠溶液反应的是.. ①NaHCO3 ②Al2O3③Al(OH)3 ④Al ( )
A.③④ B.②③④ C.①③④ D.全部
8.除去Na2CO3 固体中少量NaHCO3的最佳方法是 ( )
A.加入适量盐酸 B.加入NaOH溶液 C.加热 D.配成溶液后通入CO2
9.下列离子方程式书写正确的是( )
A.碳酸钙与盐酸反应 CO32-+2H+=CO2↑+H2O
B.往CuCl2溶液中加入钠 2Na+Cu2+=2Na++Cu
C.铁与稀硫酸反应 Fe+2H+= Fe2++H2↑
D.稀硫酸与氢氧化钡溶液反应 H++SO42-+Ba2++OH-= H2O +BaSO4↓
10.在标准状况下,将2.8 g铁和2.3 g钠分别与100 m L 1 mol·L-1的盐酸反应 ,则放出H2的体积( )
A. 铁和钠放出一样多 B.铁的多 C. 钠的多 D.无法比较
11、下列各组反应中最终肯定不生成白色沉淀的是 ( )
A.AlCl3溶液中加入过量氨水 B.Al2(SO4)3溶液中加入过量KOH溶液
C.MgCl2溶液中加入过量氨水 D.MgSO4溶液中加入过量KOH溶液
12.往AgNO3和Cu(NO3)2的混合溶液中加入一定量的铁粉,充分反应后,发现有少量金属析出,过滤后往滤液中滴加盐酸有白色沉淀生成,则析出的少量金属可能是 ( )
A. Cu和Ag B. Cu C. Ag D. 无法判断
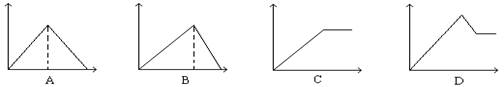
13.向MgSO4和Al2(SO4)3的混合溶液中, 逐滴加入NaOH溶液。下列图象中, 能正确表示上述反应的是(横坐标表示加入NaOH溶液的体积, 纵坐标表示反应生成沉淀的质量)( )
14.实验室中,要使AlCl3溶液中的Al3+离子全部沉淀出来,适宜用的试剂是 ( )A.NaOH溶液 B.Ba(OH)2溶液 C.氨水 D.盐酸
15.将等物质的量的Na2O和Na2O2分别投入到足量且等质量的水中,得到溶质质量分数分别为 %和
%和 %的两种溶液,则
%的两种溶液,则 和
和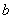 的关系是
的关系是
A.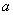 =
=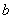 B.
B.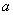 >
>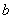 C.
C.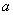 <
<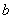 D.无法确定
D.无法确定
16、铝分别与足量的稀盐酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况下体积相同时,反应中消耗的HCl和NaOH的物质的量之比为( )
A. 1:1 B.2:1 C. 3:1 D.1:3
17,在含有1molFeSO4的溶液中投入一小块金属钠,反应完全后,滤出沉淀并洗涤之,然后在空气中灼烧沉淀得到的固体物质是 ( )
A.Fe B.FeO C.Fe(OH)3 D.Fe2O3
18、向20mL2mol/LAlCl3溶液中,加入30mLNaOH溶液,充分反应后,得0.78g沉淀,则NaOH溶液的物质的量浓度为 ( )
A.3mol/L B.2mol/L C.4mol/L D.5mol/L
19.将Fe、Cu、Fe2+、Fe3+和Cu2+盛于同一容器中充分反应,如Fe有剩余,则容器中只能有 ( )
A.Cu、Fe3+ B.Fe2+、Fe3+ C.Cu、Cu2+、Fe D.Cu、Fe2+、Fe
20.向一定量的Fe、FeO、Fe2O3的混合物中,加入100mL 1mol/L的盐酸,恰好使混合物完全溶解,放出224mL(标准状况)的气体,所得溶液中,加入KSCN溶液无血红色出现。若用足量的CO在高温下还原相同质量的混合物,能得到铁的质量为( )
A.11.2g B.5.6g C.2.8g D.无法计算
 二 填空题
二 填空题
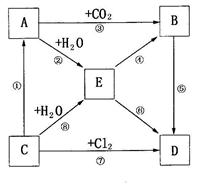
21、右图表示A--E五种物质的相互转化关系,其中A为淡黄色粉末,C为单质,D为离子化合物。
(1)推断A为 ;B为 ;
C为 ;D为 (填化学式)
(2)写出②、③的化学方程式:
②
③ 。
22. 实验室中氢氧化钠溶液在在空气中放置,因密封不好会变质,有关反应的离子方程式为 ;为了检测一瓶氢氧化钠溶液是否已变质,可取少量该溶液向其中加入 ,若有 现象发生,则说明烧碱溶液已经变质。为了除去烧碱溶液中的杂质,应加入适量的 ,并进行过滤。
23.请你设计实验方案验证明明矾中含有K+、Al3+和SO42-,将下表中的实验步骤、实验现象填写完整。

24.回答下列问题:
(1)除去铁粉中混有的铝粉可以选用的试剂为 (填序号)。
A.稀盐酸 B.氢氧化钠溶液 C.浓硫酸
涉及反应的离子方程式为 ______________________________。
(2)为了检验某未知溶液是否是FeCl2溶液,一位同学设计了以下实验方案加以证明。
方案:向一支装有该未知溶液的试管中先通入氯气,再滴加KSCN溶液,溶液呈现红色,证明该未知溶液是FeCl2溶液。回答以下问题:
①你认为此方案是否合理 (填”合理”或”不合理”),若不合理,要检验Fe2+应如何操作 (若填”合理”,则此空可不答)
(3) 现向一支装有FeCl2溶液的试管中滴加氢氧化钠溶液,可观察到的现象是 ,有关的化学方程为 , 。
(4)实验室在保存FeCl2溶液时为了防止FeCl2溶液变质,经常向其中加入铁粉,其原因是(用离子方程式表示) 。
25.右图是一块用FeCl3溶液与Cu反应制作的印刷电路板,其制作原理可用下式表示: 
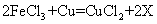 .
.
(1)上式中X物质的化学式为 。
(2)在上述反应中,氧化剂为 ,氧化产物为 ,将两者的氧化性比较, 的氧化性更强。
(3)用双线桥法表示该反应的电子转移情况: 。
(4)该反应的离子方程式为 。
(5)使用过的腐蚀液会失效,但还可以回收利用,其中有一步需要将X物质转化,下列试剂能实现上述转化的是 (填序号)
A.氯气 B.铁 C.双氧水 D.稀硫酸
26.甲、乙、丙三种物质之间有如下转化关系:
甲 乙
乙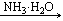 丙
丙 甲
甲
(1)若甲和丙都是不溶于水的白色固体物质,既能溶于盐酸又能溶于氢氧化钠溶液。则甲是 ,丙是 (填化学式)。写出“乙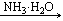 丙”转化的离子方程式: 。
丙”转化的离子方程式: 。
(2)若乙溶液中加入KSCN溶液,有血红色出现,则甲是 ,丙是 (填化学式)。写出“甲 乙”转化的离子方程式: 。
乙”转化的离子方程式: 。
三 计算题
27.(6分)使0.23 g金属钠跟足量的水反应,反应后所得溶液的体积为100 mL。试计算:
(1)反应后所得NaOH溶液的物质的量浓度是多少?
(2)反应生成的氢气在标准状况下的体积为多少毫升?
答案:
21
(1)Na2O2 Na2CO3 Na NaCl
(2)2Na2O2+2H2O 4NaOH+O2↑
2Na2O2+2CO2 2Na2CO3+O2
(3)2OH- + Ca2+ + 2HCO3- = CaCO3↓ + CO32- +2H2O
22
2OH-+CO2=CO32-+H2O 氯化钙溶液或氢氧化钙溶液(其他合理答案也得分)
白色沉淀 氢氧化钙溶液 (每空1分)
23

24
(1) B 2Al+2H2O +2OH-=2 AlO2-+3H2↑ 。
(2)① 不合理 , 先加KSCN溶液,无现象,再加入氯水,溶液变成红色,则原溶液有Fe2+
(3)出现白色沉淀,马上变成灰绿色,最终变成红褐色
FeCl2+2NaOH=Fe(OH)2↓+2 NaCl ,4 Fe(OH)2 +O2+2H2O=4 Fe(OH)3 。
(4) 2 Fe3++Fe=2 Fe2+
25

26
(1)甲是Al2O3、丙是Al(OH)3
离子方程式:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
(2)甲是Fe2O3 丙是Fe (OH)3
离子方程式:Fe2O3+6H+=2Fe3++3H2O
第二篇:高一化学第二次月考试题
高一第一学期第二次月考化学试题
命题:西平县高级中学 张荣莲
考试时间:90分钟 满分:100分
可能用到的相对原子质量:O:16 S:32 N:14 H:1 C:12 Cl:35.5
Fe:56 Al:27 Mg:24 Na:23 Cu:64
第一卷 选择题 (共54分)
一、选择题(本题包括18小题,每小题3分,共54分,每小题只有一个选项符合题意)
1. 铝镁合金因坚硬、轻巧、美观、洁净、易于加工而成为新型建筑装潢材料,主要用于制作窗框、卷帘门、防护栏等。下列与这些用途无关的性质是( )
A.不易生锈 B.导电性好 C.密度小 D.强度高
2.下列实验仪器不宜直接用来加热的是( )
A.试管 B.坩埚 C.蒸发皿 D.烧杯
3.蒸馏原理主要依据各成分的以下哪种性质的不同( )
A.状态 B.凝固点 C.沸点 D溶解度
4设阿伏加德罗常数值为NA,下列说法错误的是( )
A. 32g O2所含的原子数为NA
B. 0.5mol H2O含有的原子数目为1.5NA
C. 0.1mol OH- 含有NA个电子
D. 0.5 NA个氯气分子的物质的量是0.5mol
5.人体血红蛋白中含有Fe2+离子,如果误食亚硝酸盐,会使人中毒,因为亚硝酸盐会使Fe2+离子转变为Fe3+离子,生成高铁血红蛋白而丧失与O2结合的能力。服用维生素C可缓解亚硝酸盐的中毒,这说明维生素C具有( )
A .酸性 B.碱性 C.氧化性 D.还原性
6.下列试剂可用带玻璃塞的玻璃瓶存放的是( )
A、Na2CO3溶液 B.Ca(OH)2溶液 C.HF溶液 D.HCl溶液
7.用98%的H2SO4(ρ=1.84g·cm-3)配制1mol·L-1的稀H2SO4100mL。现给出下列仪器(配制过程中可能用到的):①100mL量筒 ②10mL量筒 ③50mL烧杯 ④托盘天平 ⑤100mL容量瓶 ⑥胶头滴管 ⑦玻璃棒,按使用仪器的先后顺序排列,正确的是( )
A、④③⑦⑤⑥ B、②⑤⑦⑥ C、①③⑤⑦⑥ D、②③⑦⑤⑥
8.24mL浓度为0.5mol·L-1的Na2SO3溶液恰好与20mL浓度为0.2mol·L-1的K2Cr2O7溶液完全反应,则元素Cr在还原产物中的化合价为( )
A、+6 B、+3 C、+2 D、0
9.把a g铁铝合金粉末溶于足量盐酸中,加入过量NaOH溶液。过滤出沉淀,经洗涤、干燥、灼烧,得到红棕色粉末的质量仍为a g,则原合金中铁的质量分数为( )
A. 70% B. 52.4% C. 47.6% D. 30%
10.为了检验FeCl2溶液是否变质,最好向溶液中加入( )
A.NaOH溶液 B.铁片 C.KSCN溶液 D.石蕊溶液
11.某学生配制0.1mol/L NaOH溶液100ml,下列操作会造成实际浓度偏高的是( )
A.称量烧碱时物品和砝码放反 B.把烧碱放在纸上称量 C.定容时俯视刻度线
D.将烧杯内的氢氧化钠溶液向容量瓶中转移时,未洗涤烧杯和玻璃棒
12.质量均为m g的三氧化硫和二氧化硫,它们所含的( )
A.硫原子个数比为1﹕1 B.氧原子个数比为3﹕2
C.硫原子个数比为5﹕4 D.氧元素的质量比为6﹕5
13.“纳米材料”是指粒子直径在几纳米到几十纳米的材料。如将“纳米材料”分散在液体分散剂中,所得混合物具有的性质是( )
A.所得物质一定为悬浊液 B.所得物质一定为乳浊液
C.有丁达尔效应 D.能透过半透膜
14.在能与Al反应放出H2的无色溶液中一定能大量共存的离子组是( )
A. NH4+、HCO3-、SO42-、Cl- B. Ba2+、K+、Cl-、NO3-
C. Al3+、Cu2+、SO42-、Cl- D. Na+、Ba2+、Cl-、SO42-
15. 根据下列反应判断有关物质还原性由强到弱的顺序是( )
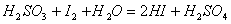
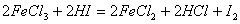
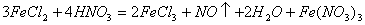
A.H2SO3>I->Fe2+>NO B.I->Fe2+>H2SO3>NO
C.Fe2+>I->H2SO3>NO D. NO>Fe2+>H2SO3>I-
16.下列反应的离子方程式书写正确的是( )
A.氢氧化钡溶液与稀硫酸反应:Ba2+ + SO42- = BaSO4↓
B.稀硫酸与铁粉反应:2Fe + 6H+ = 2Fe3+ + 3H2↑
C. 氯化铜溶液与铁粉反应:Cu2+ + Fe = Fe2+ + Cu
 D.碳酸钡与盐酸反应:CO32- + 2H+ = H2O + CO2↑
D.碳酸钡与盐酸反应:CO32- + 2H+ = H2O + CO2↑
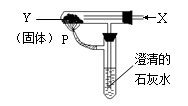
17..按右图装置持续通入气体X,并在管口P处点燃,
实验结果使澄清石灰水变浑浊,则X、Y可能是( )
A.CO2和NaHCO3 B. CO和Na2CO3
C. CO和CuO D. H2和Fe2O3
18.1mol Na、Mg、Al 分别与100ml 5.0mol/L的盐酸充分反应,所得的气体在同温同压下的体积关系正确的是( )
A.相同 B.铝最多,钠最少
C.铝最多,镁和钠相同 D.钠最多,镁、铝相同
第一卷选择题答题卷(共54分)
第二卷 非选择题(共46分)
二、本题共33分
19(4分)现有下列物质:①新制氯水 ②稀硝酸 ③铁 ④铜 ⑤稀硫酸。
(1)将Fe2+转化为Fe3+,可选用的物质有 (填编号)
(2)将Fe3+转化为Fe2+,可选用的物质有 (填编号)
20.(2分)在使用分液漏斗进行分液操作时,如果没有完成以下步骤:“将漏斗上口的玻璃塞打开或塞上的凹槽或小孔对准漏斗口的小孔”,可能出现的现象是
21.(6分)已知铜在常温下能被稀HNO3溶解,反应为:
3Cu+8HNO3===3Cu(NO3)2+2NO↑十4H2O。
(1) __________是还原剂;__________是还原产物。
(2)被还原的HNO3与参加反应的HNO3的物质的量之比为__________。
(3)写出该反应的离子方程式 。
(4)将3.2g铜跟30.0mL10.0mol/LHNO3溶液充分反应,还原产物有NO和NO2,若反应后溶液中有amolH+,则此时溶液中含有NO3-的物质的量为
22(9分)除去下列物质中混有的少量杂质,指明应加入的试剂,写出有关的离子反应方程式。
(1)铁粉中混有铝粉:试剂 离子方程式 。
(2)Na2CO3溶液中混有少量NaHCO3:试剂 离子方程式 。
(3)NaCl溶液中混有Na2CO3:试剂 离子方程式 。
23.(10分)有一瓶溶液只含Cl-、 、
、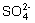 、Na+、
、Na+、 、K+、Mg2+ 七种离子中的某几种。经实验:
、K+、Mg2+ 七种离子中的某几种。经实验:
(1) 原溶液 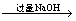 白色沉淀;
白色沉淀;
(2)将(1)所得溶液  放出使紫色石蕊试液变蓝的气体;
放出使紫色石蕊试液变蓝的气体;
(3)原溶液中加BaCl2溶液不产生沉淀。
(4)原溶液中加AgNO3溶液产生白色沉淀,再加稀硝酸白色沉淀不溶解
回答下列问题:
(1)试分析原溶液中一定含有的离子是 ,一定不含有的离子是 , 可能含有的离子是
(2)有同学认为实验(4)可以省略,你认为呢?(填符号:A-可以,B -不可以)
说明理由
三、本题共27分

 24.(8分)在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。应用下列装置,在硬质玻璃管中放入还原性铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。
24.(8分)在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。应用下列装置,在硬质玻璃管中放入还原性铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。
请回答该实验中的问题:
(1) 写出该反应的反应方程式
;
(2)圆底烧瓶中盛装的水,该装置受热后的主要作用是
;烧瓶
底部放置是几片碎瓷片,碎瓷片的作用是 。
(3)试管中收集气体是 ,如果要在A处玻璃管处点燃该气体,则必须对该气体进行 。
(4)酒精灯和酒精喷灯点燃的顺序是
四、计算(本题共7分)
25.全世界铜的年产量约为8×106 t ,工业上由辉铜矿(主要成分为Cu2S)生产铜的主要反应为:Cu2S + O2 = 2Cu + SO2
(1)若采用这种方法冶炼铜,每年需要消耗Cu2S的质量为 吨
(2)每年产生二氧化硫的体积(标准状况下)为 升
26. 100ml 0.6mol/L AlCl3溶液与一定量 0.4mol/L NaOH溶液混合后,得到3.9g沉淀,则NaOH溶液的体积为
参考答案
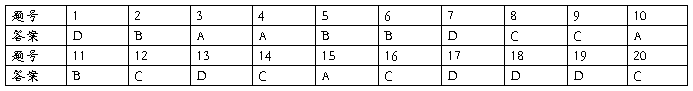
1B 2D 3C 4A 5D 6D 7D 8B 9A 10C 11C 12D 13C1 4D 15A 16C 17C 18D
19 (1)①② (2)③④
20.打开分液漏斗的活塞时漏斗中的液体不能顺利从漏斗下端流出
21 (1)Cu NO (2)1:4
(3)3Cu+8H++2NO3-=3Cu2++2NO+4H2O
(4) (a+0. 1) mol
22 (1)NaOHaq 2Al+2OH--+H2O=2AlO2--+3H2
(2) NaOHaq HCO3-+OH--= H2O-+ CO32-
(3)稀盐酸 CO32-+2H+= H2O+ CO2
23(1) 、Mg2+ Cl-;
、Mg2+ Cl-;  、
、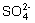 ; Na+、、K+
; Na+、、K+
(2) A 由实验(3) 原溶液中无 、
、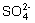 ,根据电荷守恒,原溶液中必含有Cl-
,根据电荷守恒,原溶液中必含有Cl-
24(1)3Fe+4H2O=Fe3O4+3H2
(2)提供反应所需水蒸气 防爆沸
(3)H2 检验H2纯度
(4)先点燃酒精灯再点燃酒精喷灯
25(1)10 (2)1.4×1012
26 375mL或475mL
