第三单元 物质构成的奥秘
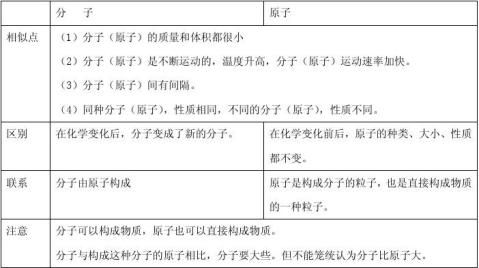
一.分子和原子
1.分子和原子的比较

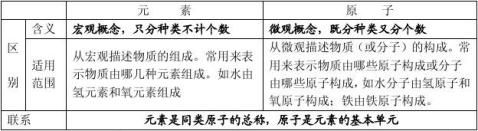
2. 用分子、原子的观点解释混合物和纯净物
纯净物:是由同种分子构成的
由分子构成的物质中
混合物:是由不同种分子构成的
3. 用分子、原子的观点认识物理变化和化学变化
(1)物质在发生物理变化时,物质的分子本身没有变化,没有变成其他物质的分子。
(2)物质在发生化学变化时,分子分成更小的原子,原子又重新组合成新的分子。
4.分子、原子、物质间的联系:
二、原子的构成 1
由居于原子中心的原子核(由质子和中子构成)和核外电子构成。
核电荷数=质子数=核外电子数 氢原子核内只有一个质子,没有中子 不同原子的核内质子数和核电荷数不同 有的原子的质子数等于中子数,有的不相等
三、相对原子质量
(1)概念:以一种碳原子质量的1/12为标准,其他原子的质量跟它相比较所得到的比,作为这种原子的相对原子质量(符号为Ar)
(2)相对原子质量 ==
原子的实际质量
(单位:1)
C12原子的实际?1/12
相对原子质量 == 质子数 + 中子数(原子的质量主要集中在原子核上) 四、元素
(1)定义:具有相同核电荷数(即核内质子数)的一类原子的总称。 (2)注意:A.元素是一个宏观的概念只讲种类不讲个数
B.元素组成物质
C.元素的种类是由原子核内质子数或核电荷数决定的
(4)元素的分类:A.金属元素 B.非金属元素
(5)元素的含量:A.地壳中的元素含量排前四位的是:氧、硅、铝、铁四种元素
B.空气中含量最多的元素:氮元素
C.生物细胞中含量排前四位的是:氧、碳、氢、氮
五、元素符号
用该元素拉丁文名称的第一个大写字母来表示,若几种元素名称的第一个字母相同时,可再附加一个小写字母加以区别。
A.“一大二小” B.表示一种元素;表示该元素的一个原子 C.


(1)核外电子是分层排布的
——核外电子在不同的电子层内运动的现象 A.电子层:核外电子运动经常出现的区域

B

.规律:能量低,离核近,能量高,离核远 能量稍高、离核稍远的叫第二层

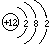
层
(2)原子结构示意图(以镁原子为例)
第一层电子数不超过2个,第二层不超过8个电子,最外层不超过8个电子 8电子稳定结构:原子最外层电子数为8(氦为2)的结构,如:
八、离子的形成
(1)离子:带电荷的原子或原子团
(2)离子化合物:阴、阳离子由于静电作用而形成不带电性的化合物 (3)离子的表示方法:
先写元素或原子团符号,然后在符号右上方先标电荷数值(数值为“1”时省略),后标“+”“-”号 阳离子:带正电的原子 阴离子:带负电的原子
(4)离子符号表示的意义:
① 元素符号右上方的数字:一个离子带的电荷数。
② 离子符号前面的数字:离子的个数
表示每个镁离子带两个单位的正电荷
表示两个镁离子
3
第二篇:20xx人教版九年级-第三单元物质构成的奥秘-知识点总结
第三单元 物质构成的奥秘
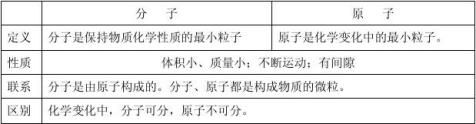
课题1 分子和原子
一、构成物质的微粒:分子、原子等微粒
1、由分子构成的物质:例如水、二氧化碳、氢气、氧气等物质
2、由原子构成的物质:金属、稀有气体、金刚石、石墨等物质
3、物质构成的描述:物质由××分子(或原子)构成。例如:铁由铁原子构成;氧气由氧分子构成。
二、分子
1、基本性质:⑴质量、体积都很小;
⑵在不停地运动且与温度有关。温度越高,运动速率越快 例:水的挥发、品红的扩散; ⑶分子间存在间隔。同一物质气态时分子间隔最大,固体时分子间隔最小 ;物体的热胀冷缩现象就是分子间的间隔受热时增大,遇冷时变小的缘故。
⑷同种物质的分子的性质相同,不同物质的分子的性质不同。
2、分子的构成:分子由原子构成。
分子构成的描述:①××分子由××原子和××原子构成。
例如:水分子由氢原子和氧原子构成
②一个××分子由几个××原子和几个××原子构成。
例如:一个水分子由一个氧原子和二个氢原子构成
3、含义:分子是保持物质化学性质的最小粒子。
例:氢分子是保持氢气化学性质的最小粒子
4、从分子和原子角度来区别下列几组概念
⑴物理变化与化学变化
由分子构成的物质,发生物理变化时,分子种类不变。发生化学变化时,分子种类发生改变。 ⑵纯净物与混合物
由分子构成的物质,纯净物由同种分子构成;混合物由不同种分子构成。
⑶单质与化合物
单质的分子由同种原子构成;化合物的分子由不同种原子构成。
三、原子
1、含义:原子是化学变化中的最小粒子。例:氢原子、氧原子是电解水中的最小粒子
3、化学反应的实质:在化学反应中分子分裂为原子,原子再重新组合成新的分子。
课题2 原子的结构
1、原子的构成
(1)原子结构的认识
(2)在原子中由于原子核带正电,原子核带的正电荷数(即核电荷数)与核外电子带的负电荷数(数值上等于核外电子数)相等,电性相反,所以原子不显电性
因此,对于原子: 核电荷数=质子数=核外电子数
(3)原子的质量主要集中在原子核上
注意:①原子中质子数不一定等于中子数
②并不是所有原子的原子核中都有中子。例如:氢原子核中无中子
2、原子核外电子排布
1—20号元素的核外电子排布
3
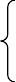


、相对原子质量(A ⑴ 相对原子质量=
⑵相对原子质量与原子核内微粒的关系:
相对原子质量≈质子数+中子数
课题3 离子
一、核外电子的排布 质子数 1、原子结构图:
①圆圈内的数字:表示原子的质子数
②+
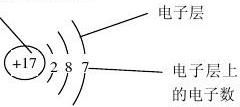
:表示原子核的电性 ③弧线:表示电子层 ④弧线上的数字:表示该电子层上的电子数
2、核外电子排布的规律:
①第一层最多容纳2个电子;
②第二层最多容纳8个电子;
③最外层最多容纳8个电子(若第一层为最外层时,最多容纳2个电子)
3、元素最外层电子数与元素性质的关系
金属元素: 一般最外层电子数<4 容易失电子,形成阳离子
非金属元素:一般最外层电子数≥4 容易得电子,形成阴离子
稀有气体元素:最外层电子数为8(He为2) 不易得失电子
最外层电子数为8(若第一层为最外层时,电子数为2)的结构叫相对稳定结构 因此元素的化学性质主要和由原子的最外层电子数有关。
二、离子
1、概念:带电的原子或原子团
2、分类及形成:阳离子(由于原子失去电子而形成)带正电
阴离子(由于原子得到电子而形成)带负电
注意:原子变为离子时,质子数、元素种类没有改变;电子数、最外层电子数发生了改变。 3、表示方法:在元素符号右上角标明电性和电荷数,数字在前,符号在后。若数字为1时,
+
可省略不写。例如:钠离子:Na。 4、离子符号表示的意义:表示一个某种离子;表示带n个单位某种电荷的离子。例如:Fe3+ :带3个单位正电荷的铁离子
+.5、元素符号右上角的数字的含义:表示一个离子所带的电荷数。例如:Fe3 :3表示一个铁离子带3个单位的正电荷
6、离子中质子数与电子数的关系:
阳离子:质子数>电子数 阴离子:质子数<电子数
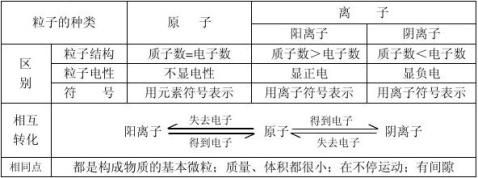
8、离子个数的表示方法:在离子符号前面加系数。例如:2个钠离子:2Na 小结:1、构成物质的微粒:分子、原子、离子 2、物质的组成(宏观上)、构成(微观上)的描述:
①物质的组成:××物质由××元素和××元素组成 例:水由氢元素和氧元素组成 ②物质的构成:××物质由××分子(或原子、离子)构成
例:水由水分子构成;铁由铁原子构成;氯化钠由氯离子和钠离子构成
课题4 元 素
一、元素
1、 含义:具有相同质子数(或核电荷数)的一类原子的总称。 注意:元素是一类原子的总称;这类原子的质子数相同
因此:元素的种类由原子的质子数决定,质子数不同,元素种类就不同。 3、元素的分类:元素分为金属元素、非金属元素和稀有气体元素 4、元素的分布:
①地壳中含量前四位的元素:O、Si、Al、Fe
②空气中前二位的元素:N、O
二、元素符号
1、 书写原则:第一个字母大写,第二个字母小写。
2、 表示的意义:①表示某种元素②表示某种元素的一个原子。例如:“O”表示氧元素,还
表示一个氧原子。
3、 原子个数的表示方法:在元素符号前面加系数。因此当元素符号前面有了系数后,这个
符号就只能表示原子的个数。例如:“2H”只表示2个氢原子。
4、 元素符号前面的数字的含义;表示原子的个数。例如:6N:6表示6个氮原子。
三、元素周期表
1、 发现者:俄国科学家门捷列夫
2、 结构:7个周期16个族(7个横行18个纵行)
3、

4、 对于原子:原子序数=质子数=核电荷数=电子数
