第三部分:传质过程之―:干燥:传质与传热双向过程
基本原理与操作

第二篇:化工原理复习小结
流体流动–––基本概念与基本原理
一、流体静力学基本方程式
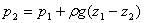
或 
注意:1、应用条件:静止的连通着的同一种连续的流体。
2、压强的表示方法:绝压—大气压=表压 表压常由压强表来测量;
大气压—绝压=真空度 真空度常由真空表来测量。
3、压强单位的换算:
1atm=760mmHg=10.33mH2O=101.33kPa=1.033kgf/cm2=1.033at
4、应用:水平管路上两点间压强差与U型管压差计读数R的关系:
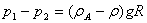
处于同一水平面的液体,维持等压面的条件必须时静止、连续和同一种液体。
二、定态流动系统的连续性方程式––––物料衡算式
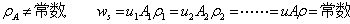
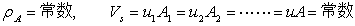
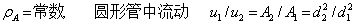
三、定态流动的柏努利方程式––––能量衡算式
1kg流体: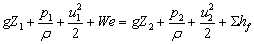 [J/kg]
[J/kg]
讨论点:1、流体的流动满足连续性假设。
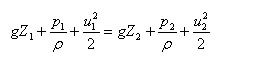
2、 理想流体,无外功输入时,机械能守恒式:
3、可压缩流体,当Δp/p1<20%,仍可用上式,且ρ=ρm。
4、注意运用柏努利方程式解题时的一般步骤,截面与基准面选取的原则。
5、流体密度ρ的计算:
理想气体ρ=pM/RT 混合气体 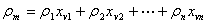
混合液体 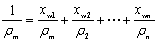
上式中: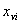 ––––体积分率;
––––体积分率;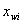 ––––质量分率。
––––质量分率。
6、gz,u2/2,p/ρ三项表示流体本身具有的能量,即位能、动能和静压能。∑hf为流经系统的能量损失。We为流体在两截面间所获得的有效功,是决定流体输送设备重要参数。输送设备有效功率Ne=We·ws,轴功率N=Ne/η(W)
7、1N流体  [m] (压头)
[m] (压头)
1m3流体 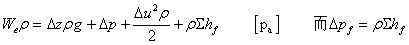 ,
,
四、柏努利式中的∑hf
I. 流动类型:
1、雷诺准数Re及流型 Re=duρ/μ,μ为动力粘度,单位为[Pa·s];
层流:Re≤2000,湍流:Re≥4000;2000<Re<4000为不稳定过渡区。
2、牛顿粘性定律 τ=μ(du/dy)
气体的粘度随温度升高而增加,液体的粘度随温度升高而降低。
3、流型的比较:①质点的运动方式;
②速度分布,层流:抛物线型,平均速度为最大速度的0.5倍;
湍流:碰撞和混和使速度平均化。
③阻力,层流:粘度内摩擦力,
湍流:粘度内摩擦力+湍流应力。
II. 流体在管内流动时的阻力损失
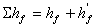 [J/kg]
[J/kg]
1、直管阻力损失hf 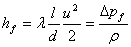 范宁公式(层流、湍流均适用).
范宁公式(层流、湍流均适用).
层流: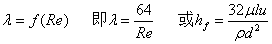 哈根—泊稷叶公式。
哈根—泊稷叶公式。
湍流区(非阻力平方区):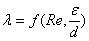 ;高度湍流区(阻力平方区):
;高度湍流区(阻力平方区): ,具体的定性关系参见摩擦因数图,并定量分析hf与u之间的关系。
,具体的定性关系参见摩擦因数图,并定量分析hf与u之间的关系。
推广到非圆型管
注:不能用de来计算截面积、流速等物理量。
2、局部阻力损失h′f ①阻力系数法,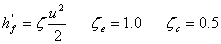
②当量长度法,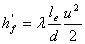
注意:截面取管出口内外侧,对动能项及出口阻力损失项的计算有所不同。
当管径不变时,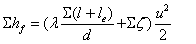
流体在变径管中作稳定流动,在管径缩小的地方其静压能减小。流体在等径管中作稳定流动流体由于流动而有摩擦阻力损失,流体的流速沿管长不变。流体流动时的摩擦阻力损失hf所损失的是机械能中的静压能项。完全湍流(阻力平方区)时,粗糙管的摩擦系数数值只取决于相对粗糙度。
水由敞口恒液位的高位槽通过一管道流向压力恒定的反应器,当管道上的阀门开度减小时,水流量将减小,摩擦系数增大,管道总阻力不变。
五、管路计算
I. 并联管路:1、
2、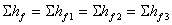 各支路阻力损失相等。
各支路阻力损失相等。
即并联管路的特点是:(1)并联管段的压强降相等;
(2)主管流量等于并联的各管段流量之和;
(3)并联各管段中管子长、直径小的管段通过的流量小。
II.分支管路:1、
2、分支点处至各支管终了时的总机械能和能量损失之和相等。
六、柏式在流量测量中的运用
1、毕托管用来测量管道中流体的点速度。
2、孔板流量计为定截面变压差流量计,用来测量管道中流体的流量。随着Re增大其孔流系数C0先减小,后保持为定值。
3、转子流量计为定压差变截面流量计。注意:转子流量计的校正。
测流体流量时,随流量增加孔板流量计两侧压差值将增加,若改用转子流量计,随流量增加转子两侧压差值将不变。
离心泵–––––基本概念与基本原理
一、工作原理
基本部件:叶轮(6~12片后弯叶片);泵壳(蜗壳)(集液和能量转换装置);轴封装置(填料函、机械端面密封)。
原理:借助高速旋转的叶轮不断吸入、排出液体。
注意:离心泵无自吸能力,因此在启动前必须先灌泵,且吸入管路必须有底阀,否则将发生“气缚”现象。
某离心泵运行一年后如发现有气缚现象,则应检查进口管路是否有泄漏现象。
二、性能参数及特性曲线
1、压头H,又称扬程 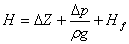
2、有效功率 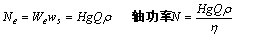
3、离心泵的特性曲线通常包括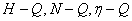 曲线,这些曲线表示在一定转速下输送某种特定的液体时泵的性能。由
曲线,这些曲线表示在一定转速下输送某种特定的液体时泵的性能。由 线上可看出:
线上可看出: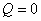 时,
时,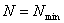 ,所以启动泵和停泵都应关闭泵的出口阀。
,所以启动泵和停泵都应关闭泵的出口阀。
离心泵特性曲线测定实验,泵启动后出水管不出水,而泵进口处真空表指示真空度很高,可能出现的故障原因是吸入管路堵塞。
若被输送的流体粘度增高,则离心泵的压头减小,流量减小,效率减小,轴功率增大。
三、离心泵的工作点
1、泵在管路中的工作点为离心泵特性曲线( )与管路特性曲线(
)与管路特性曲线(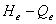 )的交点。管路特性曲线为:
)的交点。管路特性曲线为: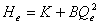 。
。
2、工作点的调节:既可改变 来实现,又可通过改变
来实现,又可通过改变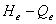 来实现。具体措施有改变阀门的开度,改变泵的转速,叶轮的直径及泵的串、并联操作。
来实现。具体措施有改变阀门的开度,改变泵的转速,叶轮的直径及泵的串、并联操作。
离心泵的流量调节阀安装在离心泵的出口管路上,开大该阀门后,真空表读数增大,压力表读数减小,泵的扬程将减小,轴功率将增大。
两台同样的离心泵并联压头不变而流量加倍,串联则流量不变压头加倍。
四、离心泵的安装高度
为避免气蚀现象的发生,离心泵的安装高度≤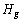 ,注意气蚀现象产生的原因。
,注意气蚀现象产生的原因。
1.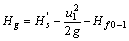
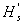 为操作条件下的允许吸上真空度,m
为操作条件下的允许吸上真空度,m
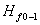 为吸入管路的压头损失,m。
为吸入管路的压头损失,m。
2. 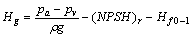
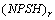 允许气蚀余量,m
允许气蚀余量,m
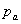 液面上方压强,Pa;
液面上方压强,Pa; 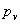 操作温度下的液体饱和蒸汽压,Pa。
操作温度下的液体饱和蒸汽压,Pa。
离心泵的安装高度超过允许安装高度时会发生气蚀现象。
传 热–––基本概念和基本理论
传热是由于温度差引起的能量转移,又称热传递。由热力学第二定律可知,凡是有温度差存在时,就必然发生热从高温处传递到低温处。
根据传热机理的不同,热传递有三种基本方式:热传导(导热)、热对流(对流)和热辐射。热传导是物体各部分之间不发生相对位移,仅借分子、原子和自由电子等微观粒子的热运动而引起的热量传递;热对流是流体各部分之间发生相对位移所引起的热传递过程(包括由流体中各处的温度不同引起的自然对流和由外力所致的质点的强制运动引起的强制对流),流体流过固体表面时发生的对流和热传导联合作用的传热过程称为对流传热(给热);热辐射是因热的原因而产生的电磁波在空间的传递。任何物体只要在绝对零度以上,都能发射辐射能,只是在高温时,热辐射才能成为主要的传热方式。传热可依靠其中的一种方式或几种方式同时进行。
传热速率Q是指单位时间通过传热面的热量(W);热通量q是指每单位面积的传热速率(W/m2)。
一、热传导
1.导热基本方程––––傅立叶定律
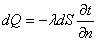
λ––––导热系数,表征物质导热能力的大小,是物质的物理性质之一,单位为W/(m·℃)。纯金属的导热系数一般随温度升高而降低,气体的导热系数随温度升高而增大。
式中负号表示热流方向总是和温度剃度的方向相反。
2.平壁的稳定热传导
单层平壁:

多层(n层)平壁:
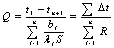
公式表明导热速率与导热推动力(温度差)成正比,与导热热阻(R)成反比。
由多层等厚平壁构成的导热壁面中所用材料的导热系数愈大,则该壁面的热阻愈小,其两侧的温差愈小,但导热速率相同。
2.圆筒壁的稳定热传导
单层圆筒壁:
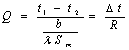 或
或 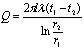
当S2/S1>2时,用对数平均值,即:
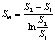
当S2/S1£2时,用算术平均值,即: Sm=(S1+S2)/2
多层(n层)圆筒壁: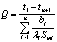

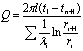
一包有石棉泥保温层的蒸汽管道,当石棉泥受潮后,其保温效果应降低,主要原因是因水的导热系数大于保温材料的导热系数,受潮后,使保温层材料导热系数增大,保温效果降低。
在包有两层相同厚度保温材料的圆形管道上,应该将导热系数小的材料包在内层,其原因是为了减少热损失,降低壁面温度。
二、对流传热
1.对流传热基本方程––––牛顿冷却定律
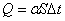
α––––对流传热系数,单位为:W/(m2·℃),在换热器中与传热面积和温度差相对应。
2.与对流传热有关的无因次数群(或准数)
表1 准数的符号和意义

3.流体在圆形直管中作强制湍流流动时的传热膜系数
对气体或低粘度的液体


流体被加热时,n=0.4;液体被冷却时,n=0.3。
定型几何尺寸为管子内径di。
定性温度取流体进、出口温度的算术平均值。
应用范围为Re>10000,Pr=0.7~160,(l/d)>60。
对流过程是流体和壁面之间的传热过程,定性温度是指确定准数中各物性参数的温度。
沸腾传热可分为三个区域,它们是自然对流区、泡状沸腾区和膜状沸腾区,生产中的沸腾传热过程应维持在泡状沸腾区操作。
无相变的对流传热过程中,热阻主要集中在传热边界层或滞流层内,减少热阻的最有效的措施是提高流体湍动程度。
引起自然对流传热的原因是系统内部的温度差,使各部分流体密度不同而引起上升、下降的流动。
用无因次准数方程形式表示下列各种传热情况下诸有关参数的关系:
(1) 无相变对流传热 Nu=f(Re,Pr,Gr)
(2) 自然对流传热 Nu=f(Gr,Pr)
(3) 强制对流传热 Nu=f(Re,Pr)
在两流体的间壁换热过程中,计算式Q=KSΔt,式中Δt表示为两流体温度差的平均值;S表示为泛指传热面,与K相对应。
在两流体的间壁换热过程中,计算式Q=aSΔt,式中Δt=tw-tm 或 Tm-Tw;S表示为一侧的传热壁面。
滴状冷凝的膜系数大于膜状冷凝膜系数。
水在管内作湍流流动时,若使流速提高至原来的2倍,则其对流传热系数约为原来的 20.8倍。若管径改为原来的1/2而流量相同,则其对流传热系数约为原来的40.8×20.2倍。(设条件改变后,仍在湍流范围)
三、间壁两侧流体的热交换
间壁两侧流体热交换的传热速率方程式
Q=KSΔtm
式中K为总传热系数,单位为:W/(m2·℃);Δtm为两流体的平均温度差,对两流体作并流或逆流时的换热器而言,
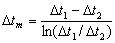
当Δt1/Δt2< 2时,Δtm可取算术平均值,即:Δtm=(Δt1+Δt2)/2
基于管外表面积So的总传热系数Ko

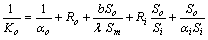
四、换热器
间壁式换热器有夹套式、蛇管式、套管式、列管式、板式、螺旋板式、板翅式等。提高间壁式换热器传热系数的主要途径是提高流体流速、增强人工扰动;防止结垢,及时清除污垢。消除列管换热器温差应力常用的方法有三种,即在壳体上加膨胀节,采用浮头式结构或采用U型管式结构。翅片式换热器安装翅片的目的是增加传热面积;增强流体的湍动程度以提高α。为提高冷凝器的冷凝效果,操作时要及时排除不凝气和冷凝水。
间壁换热器管壁温度tw接近α大的一侧的流体温度;总传热系数K的数值接近热阻大的一侧的α值。如在传热实验中用饱和水蒸气加热空气,总传热系数接近于空气侧的对流传热膜系数,而壁温接近于水蒸气侧的温度。
对于间壁换热器WhCph(T1-T2)=WcCpc(t2-t1)=KSΔtm等式成立的条件是稳定传热、无热损失、无相变化。
列管换热器,在壳程设置折流挡板的目的是增大壳程流体的湍动程度,强化对流传热,提高α值,支撑管子。
在确定列管换热器冷热流体的流径时,一般来说,蒸汽走管外;易结垢的流体走管内;高压流体走管内;有腐蚀性的流体走管内;粘度大或流量小的流体走管外。
蒸 馏––––基本概念和基本原理
利用各组分挥发度不同将液体混合物部分汽化而使混合物得到分离的单元操作称为蒸馏。这种分离操作是通过液相和气相之间的质量传递过程来实现的。
对于均相物系,必须造成一个两相物系才能将均相混合物分离。蒸馏操作采用改变状态参数的办法(如加热和冷却)使混合物系内部产生出第二个物相(气相);吸收操作中则采用从外界引入另一相物质(吸收剂)的办法形成两相系统。
一、两组分溶液的气液平衡
1. 拉乌尔定律
理想溶液的气液平衡关系遵循拉乌尔定律:
pA=pA0xA pB=pB0xB=pB0(1-xA)
根据道尔顿分压定律:pA=PyA 而P=pA+pB
则两组分理想物系的气液相平衡关系:
 ———泡点方程
———泡点方程
 ———露点方程
———露点方程
对于任一理想溶液,利用一定温度下纯组分饱和蒸汽压数据可求得平衡的气液相组成;反之,已知一相组成,可求得与之平衡的另一相组成和温度(试差法)。
2. 用相对挥发度表示气液平衡关系
溶液中各组分的挥发度v可用它在蒸汽中的分压和与之平衡的液相中的摩尔分率来表示,即 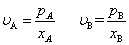
溶液中易挥发组分的挥发度对难挥发组分的挥发度之比为相对挥发度。其表达式有:

对于理想溶液: 
气液平衡方程: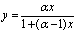
α值的大小可用来判断蒸馏分离的难易程度。α愈大,挥发度差异愈大,分离愈易;α=1时不能用普通精馏方法分离。
3. 气液平衡相图
(1)温度—组成(t-x-y)图
该图由饱和蒸汽线(露点线)、饱和液体线(泡点线)组成,饱和液体线以下区域为液相区,饱和蒸汽线上方区域为过热蒸汽区,两曲线之间区域为气液共存区。
气液两相呈平衡状态时,气液两相温度相同,但气相组成大于液相组成;若气液两相组成相同,则气相露点温度大于液相泡点温度。
(2)x-y图
x-y图表示液相组成x与之平衡的气相组成y之间的关系曲线图,平衡线位于对角线的上方。平衡线偏离对角线愈远,表示该溶液愈易分离。总压对平衡曲线影响不大。
二、精馏原理
精馏过程是利用多次部分汽化和多次部分冷凝的原理进行的,精馏操作的依据是混合物中各组分挥发度的差异,实现精馏操作的必要条件包括塔顶液相回流和塔底产生上升蒸汽。精馏塔中各级易挥发组分浓度由上至下逐级降低;精馏塔的塔顶温度总是低于塔底温度,原因之一是:塔顶易挥发组分浓度高于塔底,相应沸点较低;原因之二是:存在压降使塔底压力高于塔顶,塔底沸点较高。
当塔板中离开的气相与液相之间达到相平衡时,该塔板称为理论板。
精馏过程中,再沸器的作用是提供一定量的上升蒸汽流,冷凝器的作用是提供塔顶液相产品及保证由适宜的液相回流。
三、两组分连续精馏的计算
1.全塔物料衡算
总物料衡算:
易挥发组分: 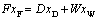
塔顶易挥发组分回收率: 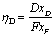
塔底难挥发组分回收率: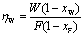
精馏段物料衡算和操作线方程
总物料衡算: 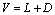
易挥发组分: 
操作线方程: 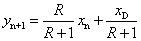
其中:R=L/D——回流比
上式表示在一定操作条件下,精馏段内自任意第n层板下降的液相组成xn与其相邻的下一层板(第n+1层板)上升蒸汽相组成yn+1之间的关系。在x—y坐标上为直线,斜率为R/R+1,截距为xD/R+1。
2.提馏段物料衡算和操作线方程
总物料衡算: 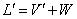
易挥发组分:  W
W
操作线方程: 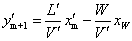
上式表示在一定操作条件下,提馏段内自任意第m层板下降的液相组成x′m与其相邻的下一层板(第m+1层板)上升蒸汽相组成y′m+1之间的关系。L′除与L有关外,还受进料量和进料热状况的影响。
四、进料热状况参数
实际操作中,加入精馏塔的原料液可能有五种热状况:(1)温度低于泡点的冷液体;(2)泡点下的饱和液体;(3)温度介于泡点和露点的气液混合物;(4)露点下的饱和蒸汽;(5)温度高于露点的过热蒸汽。

不同进料热状况下的q值

对于饱和液体、气液混合物和饱和蒸汽进料而言,q值等于进料中的液相分率。
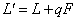
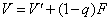
q线方程(进料方程)为: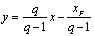
上式表示两操作线交点的轨迹方程。
塔底再沸器相当于一层理论板(气液两相平衡),塔顶采用分凝器时,分凝器相当于一层理论板。由于冷液进料时提馏段内循环量增大,分离程度提高,冷液进料较气液混合物进料所需理论板数为少。
五、回流比及其选择
(1)全回流
R=L/D=∞,操作线与对角线重合,操作线方程yn=xn-1,达到给定分离程度所需理论板层数最少为Nmin。
(2)最小回流比
当回流比逐渐减小时,精馏段操作线截距随之逐渐增大,两操作线位置将向平衡线靠近,为达到相同分离程度所需理论板层数亦逐渐增多。达到恒浓区(夹紧区)回流比最小,所需理论板无穷多。
I.正常平衡线
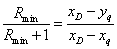
饱和液体进料时:xq=xF
饱和蒸汽进料时:yq=yF
II. 不正常平衡线
由a(xD,yD)或c(xW,xW)点向平衡线作切线,由切线斜率或截距求Rmin。
(3)适宜回流比
R=(1.1~2)Rmin
精馏设计中,当回流比增大时所需理论板数减少,同时蒸馏釜中所需加热蒸汽消耗量增加,塔顶冷凝器中冷却介质消耗量增加,操作费用相应增加,所需塔径增大。
精馏操作时,若F、D、xF、q、R、加料板位置都不变,将塔顶泡点回流改为冷回流,则塔顶产品组成xD变大。
精馏设计中,回流比愈大,操作能耗愈大,随着回流比逐渐增大,操作费和设备费的总和将呈现先减小后增大的过程。
六、板效率和实际塔板数
1.单板效率(默弗里效率)
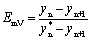

2.全塔效率

精馏塔中第n-1,n,n+1块理论板,yn+1<yn,tn-1<tn,yn>xn-1。
精馏塔中第n-1,n,n+1块实际板,xn*<xn,yn*>yn。
如板式塔设计不合理或操作不当,可能产生液泛、漏液、及雾沫夹带等不正常现象,使塔无法正常工作。
负荷性能图有五条线,分别是雾沫夹带、液泛、漏液、液相负荷上限和液相负荷下限。
吸 收––––基本概念和基本原理
利用各组分溶解度不同而分离气体混合物的单元操作称为吸收。混合气体中能够溶解的组分称为吸收质或溶质(A);不被吸收的组分称为惰性组分或载体(B);吸收操作所用的溶剂称为吸收剂(S);吸收所得溶液为吸收液(S+A);吸收塔排出的气体为吸收尾气。
当气相中溶质的的实际分压高于与液相成平衡的溶质分压时,溶质从气相向液相转移,发生吸收过程;反之当气相中溶质的的实际分压低于与液相成平衡的溶质分压时,溶质从液相向气相转移,发生脱吸(解吸)过程。
一、气–液相平衡–––––––传质方向与传质极限
平衡状态下气相中溶质分压称为平衡分压或饱和分压,液相中的溶质浓度称为平衡浓度或饱和浓度––––––溶解度。
对于同一种溶质,溶解度随温度的升高而减小,加压和降温对吸收操作有利,升温和减压有利于脱吸操作。
亨利定律: p*=Ex––––E为亨利系数,单位为压强单位,随温度升高而增大,难溶气体
(稀溶液) E很大,易溶气体E很小。对理想溶液E为吸收质的饱和蒸气压。
p*=c/H––H为溶解度系数,单位:kmol/(kN·m),H=ρ/(EMs),随温度升高
而减小,难溶气体H很小,易溶气体H很大。
y*=mx––––m相平衡常数,无因次,m=E/P,m值愈大,气体溶解度愈小;
m随温度升高而增加,随压力增加而减小。
Y*=mX–––当溶液浓度很低时大多采用该式计算。
X=x/(1-x); Y=y/(1-y); x, y––––摩尔分率, X,Y––––摩尔比浓度
二、传质理论––––传质速率
分子扩散–––凭借流体分子无规则热运动传递物质的现象。推动力为浓度差,由菲克定律描述: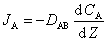
JA––扩散通量,kmol/(m2·s) DAB––扩散系数
涡流扩散–––凭借流体质点的湍动和旋涡传递物质的现象。
等分子反向扩散传质速率:气相内 
液相内 
单相扩散传质速率:
气相内 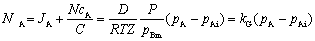
液相内 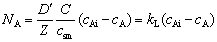
其中 P/pBm >1为漂流因数,反映总体流动对传质速率的影响。
一般而言,双组分等分子反向扩散体现在精馏单元操作中,而一组分通过另一组分的单相扩散体现在吸收单元操作中。
气相中,温度升高物质的扩散系数增大,压强升高则扩散系数降低;液相中粘度增加扩散系数降低。
在传质理论中有代表性的三个模型分别为双膜理论、溶质渗透理论和表面更新理论。
传质速率方程––––传质速率=传质推动力/传质阻力
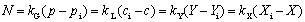
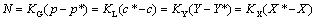
注意传质系数与推动力相对应,即传质系数与推动力的范围一致,传质系数的单位与推动力的单位一致。
吸收系数之间的关系:
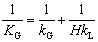

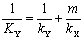
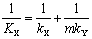
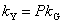


气膜控制与液膜控制的概念
对于易溶气体,H很大,传质阻力绝大部分存在于气膜之中,液膜阻力可以忽略,此时KG≈kG,这种情况称为“气膜控制”;反之,对于难溶气体,H很小,传质阻力绝大部分存在于液膜之中,气膜阻力可以忽略,此时KL≈kL,这种情况称为“液膜控制”。
三、物料衡算––––操作线方程与液气比
全塔物料衡算: 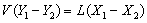 逆流操作
逆流操作
吸收操作线方程:  1––塔底,2––塔顶
1––塔底,2––塔顶
吸收操作时塔内任一截面上溶质在气相中的实际分压总是高于与其接触的液相平衡分压,所以吸收操作线总是位于平衡线的上方。
最小液气比: 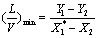 液气比即操作线的斜率
液气比即操作线的斜率
若平衡关系符合亨利定律,则 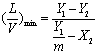
 溶剂改性
溶剂改性
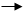 改变平衡关系 降低温度
改变平衡关系 降低温度

 增加传质推动力 提高压力
增加传质推动力 提高压力

 提高吸收效率的途径 增加液气比
提高吸收效率的途径 增加液气比
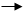
 减小传质阻力 采用新型填料
减小传质阻力 采用新型填料
改变操作条件
增加吸收剂用量,操作线斜率增大,操作线向远离平衡线的方向偏移,吸收过程推动力增大,设备费用减少。
四、填料层高度计算
气液相平衡、传质速率和物料衡算相结合取微元物料衡算求得填料层高度。
填料层高度=传质单元高度×传质单元数
即 
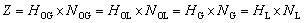
NOG–––气相总传质单元数(气体流经一段填料后其组成变化等于该段填料的总的平均推动力则为一个传质单元)
HOG–––气相总传质单元高度(一个传质单元所对应的填料高度)
1. 平均推动力法(适合平衡线为直线):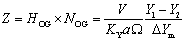
对数平均推动力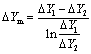
2. 脱吸因数法(平衡线为直线):
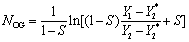
S––––脱吸因数,平衡线与操作线斜率之比(mV/L),反映吸收推动力的大小。S增大,液气比减小,吸收推动力变小,NOG增大
气体吸收中,表示设备(填料)效能高低的一个量是传质单元高度,表示传质任务难易程度的一个量是传质单元数。
干 燥––––基本概念和基本原理
同一物料,如恒速段的干燥速率增加,则临界含水量增大,物料平衡水分随温度升高而减小。
不饱和湿空气当温度升高时,湿球温度升高,绝对湿度不变,相对湿度降低,露点不变,比容增大,焓增大。
区除可除水分与不可除水分的分界点是平衡湿含量。
恒定干燥条件下的干燥速率曲线一般包括恒速干燥阶段(包括预热段)和降速干燥阶段,其中两干燥阶段的交点对应的物料含水量称为临界含水量。恒速干燥阶段也称为表面汽化控制阶段,降速阶段也称为内部迁移控制阶段。
不饱和空气:t>tas(或tw)>td.
饱和空气:t=tas=td.
已知湿空气的下列任一对参数:t-tw,t-td,t-φ,可由湿焓图查得其它参数。
物料中总水分可分为非结合水分与结合水分,也可分为自由水分和平衡水分。物料中水分超过平衡水分的部分水分为自由水分,可用干燥方法除去;水分大于xB*(与φ=100%湿空气接触时的平衡水分)部分为非结合水,小于xB*水分为结合水。
