第一章 气体的pVT关系主要公式及使用条件
1. 理想气体状态方程式

或 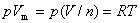
式中p,V,T及n单位分别为Pa,m3,K及mol。  称为气体的摩尔体积,其单位为m3 · mol-1。 R=8.314510 J · mol-1 · K-1,称为摩尔气体常数。此式适用于理想气体,近似地适用于低压的真实气体。
称为气体的摩尔体积,其单位为m3 · mol-1。 R=8.314510 J · mol-1 · K-1,称为摩尔气体常数。此式适用于理想气体,近似地适用于低压的真实气体。
2. 气体混合物
(1) 组成: 摩尔分数 yB (或xB) = 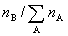
体积分数 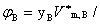
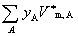
式中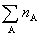 为混合气体总的物质的量。
为混合气体总的物质的量。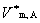 表示在一定T,p下纯气体A的摩尔体积。
表示在一定T,p下纯气体A的摩尔体积。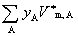 为在一定T,p下混合之前各纯组分体积的总和。
为在一定T,p下混合之前各纯组分体积的总和。
(2) 摩尔质量 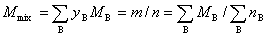
式中  为混合气体的总质量,
为混合气体的总质量,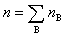 为混合气体总的物质的量。上述各式适用于任意的气体混合物。
为混合气体总的物质的量。上述各式适用于任意的气体混合物。
(3) 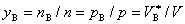
式中pB为气体B,在混合的T,V条件下,单独存在时所产生的压力,称为B的分压力。 为B气体在混合气体的T,p下,单独存在时所占的体积。
为B气体在混合气体的T,p下,单独存在时所占的体积。
3. 道尔顿定律
pB = yBp,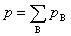
上式适用于任意气体。对于理想气体
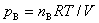
4. 阿马加分体积定律
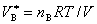
此式只适用于理想气体。
第二章 热力学第一定律
5. 热力学第一定律的数学表示式
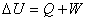
或 
规定系统吸热为正,放热为负。系统得功为正,对环境作功为负。式中 pamb为环境的压力,W’为非体积功。上式适用于封闭体系的一切过程。
6. 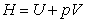 焓的定义式
焓的定义式
7. 焓变
(1) 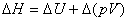
式中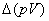 为
为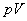 乘积的增量,只有在恒压下
乘积的增量,只有在恒压下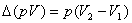 在数值上等于体积功。
在数值上等于体积功。
(2) 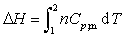
此式适用于理想气体单纯pVT变化的一切过程,或真实气体的恒压变温过程,或纯的液体、固体物质压力变化不大的变温过程。
1. 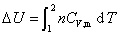 热力学能(又称内能)变
热力学能(又称内能)变
此式适用于理想气体单纯pVT变化的一切过程。
2. 恒容热和恒压热
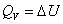
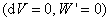

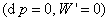
3. 热容的定义式
(1)定压热容和定容热容
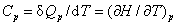
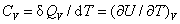
(2)摩尔定压热容和摩尔定容热容
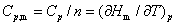
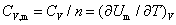
上式分别适用于无相变变化、无化学变化、非体积功为零的恒压和恒容过程。
(3)质量定压热容(比定压热容)
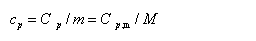
式中m和M分别为物质的质量和摩尔质量。
(4) 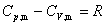
此式只适用于理想气体。
4. 摩尔蒸发焓与温度的关系
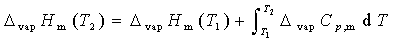
或 
式中 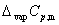 =
= 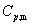 (g) —
(g) —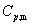 (l),上式适用于恒压蒸发过程。
(l),上式适用于恒压蒸发过程。
5. 体积功
(1)定义式

或 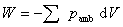
(2)  适用于理想气体恒压过程。
适用于理想气体恒压过程。
(3)  适用于恒外压过程。
适用于恒外压过程。
(4)  适用于理想气体恒温可逆过程。
适用于理想气体恒温可逆过程。
(5)  适用于
适用于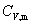 为常数的理想气体绝热过程。
为常数的理想气体绝热过程。
9. 理想气体可逆绝热过程方程
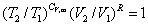
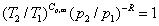

上式中,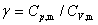 称为热容比(以前称为绝热指数),适用于
称为热容比(以前称为绝热指数),适用于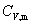 为常数,理想气体可逆绝热过程p,V,T的计算。
为常数,理想气体可逆绝热过程p,V,T的计算。
10. 反应进度

上式是用于反应开始时的反应进度为零的情况,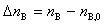 ,
,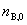 为反应前B的物质的量。
为反应前B的物质的量。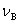 为B的反应计量系数,其量纲为一。
为B的反应计量系数,其量纲为一。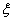 的量纲为mol。
的量纲为mol。
11. 标准摩尔反应焓
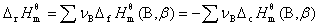
式中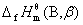 及
及 分别为相态为
分别为相态为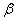 的物质B的标准摩尔生成焓和标准摩尔燃烧焓。上式适用于
的物质B的标准摩尔生成焓和标准摩尔燃烧焓。上式适用于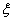 =1 mol,在标准状态下的反应。
=1 mol,在标准状态下的反应。
12.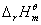 与温度的关系
与温度的关系

式中 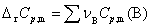 ,适用于恒压反应。
,适用于恒压反应。
13. 节流膨胀系数的定义式
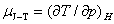
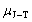 又称为焦耳-汤姆逊系数。
又称为焦耳-汤姆逊系数。
第三章 热力学第二定律
1. 热机效率 
式中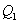 和
和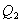 分别为工质在循环过程中从高温热源T1吸收的热量和向低温热源T2放出的热。W为在循环过程中热机中的工质对环境所作的功。此式适用于在任意两个不同温度的热源之间一切可逆循环过程。
分别为工质在循环过程中从高温热源T1吸收的热量和向低温热源T2放出的热。W为在循环过程中热机中的工质对环境所作的功。此式适用于在任意两个不同温度的热源之间一切可逆循环过程。
2. 卡诺定理的重要结论
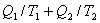


任意可逆循环的热温商之和为零,不可逆循环的热温商之和必小于零。
3. 熵的定义

4. 克劳修斯不等式

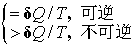

5. 熵判据


式中iso, sys和amb分别代表隔离系统、系统和环境。在隔离系统中,不可逆过程即自发过程。可逆,即系统内部及系统与环境之间皆处于平衡态。在隔离系统中,一切自动进行的过程,都是向熵增大的方向进行,这称之为熵增原理。此式只适用于隔离系统。
6. 环境的熵变
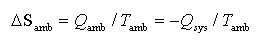
7. 熵变计算的主要公式

对于封闭系统,一切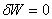 的可逆过程的
的可逆过程的 计算式,皆可由上式导出
计算式,皆可由上式导出
(1)
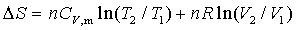
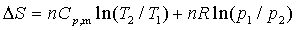
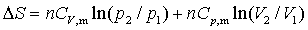
上式只适用于封闭系统、理想气体、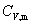 为常数,只有
为常数,只有 变化的一切过程
变化的一切过程
(2) 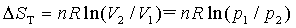
此式使用于n一定、理想气体、恒温过程或始末态温度相等的过程。
(3) 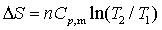
此式使用于n一定、 为常数、任意物质的恒压过程或始末态压力相等的过程。
为常数、任意物质的恒压过程或始末态压力相等的过程。
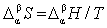 8. 相变过程的熵变
8. 相变过程的熵变
此式使用于物质的量n一定,在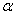 和
和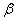 两相平衡时衡T,p下的可逆相变化。
两相平衡时衡T,p下的可逆相变化。
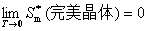 9. 热力学第三定律
9. 热力学第三定律
或 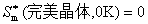
上式中符号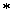 代表纯物质。上述两式只适用于完美晶体。
代表纯物质。上述两式只适用于完美晶体。
10. 标准摩反应熵


上式中 =
=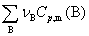 ,适用于在标准状态下,反应进度为1 mol时,任一化学反应在任一温度下,标准摩尔反应熵的计算。
,适用于在标准状态下,反应进度为1 mol时,任一化学反应在任一温度下,标准摩尔反应熵的计算。
11. 亥姆霍兹函数的定义

12. 
此式只适用n一定的恒温恒容可逆过程。
13. 亥姆霍兹函数判据

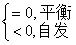
只有在恒温恒容,且不做非体积功的条件下,才可用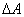 作为过程的判据。
作为过程的判据。
 14. 吉布斯函数的定义
14. 吉布斯函数的定义
15.
此式适用恒温恒压的可逆过程。
16. 吉布斯函数判据
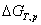
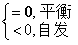
只有在恒温恒压,且不做非体积功的条件下,才可用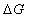 作为过程的判据。
作为过程的判据。
17. 热力学基本方程式

热力学基本方程适用于封闭的热力学平衡系统所进行的一切可逆过程。说的更详细些,它们不仅适用于一定量的单相纯物质,或组成恒定的多组分系统发生单纯p, V, T变化的过程。也可适用于相平衡或化学平衡的系统,由一平衡状态变为另一平衡态的过程。
18. 克拉佩龙方程 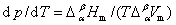
此方程适用于纯物质的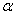 相和
相和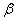 相的两相平衡。
相的两相平衡。
19. 克劳修斯-克拉佩龙方程
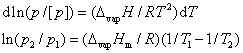
此式适用于气-液(或气-固)两相平衡;气体可视为理想气体;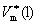 与
与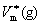 相比可忽略不计,在
相比可忽略不计,在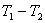 的温度范围内摩尔蒸发焓可视为常数。
的温度范围内摩尔蒸发焓可视为常数。
对于气-固平衡,上式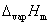 则应改为固体的摩尔升华焓。
则应改为固体的摩尔升华焓。
20. 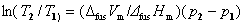
式中fus代表固态物质的熔化。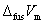 和
和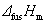 为常数的固-液两相平衡才可用此式计算外压对熔点的T的影响。
为常数的固-液两相平衡才可用此式计算外压对熔点的T的影响。
第四章 多组分系统热力学
1. 偏摩尔量:
定义: 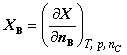 (1)
(1)
其中X为广延量,如V﹑U﹑S......
全微分式: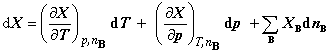 (2)
(2)
总和: 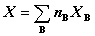 (3)
(3)
2. 吉布斯-杜亥姆方程
在T﹑p 一定条件下,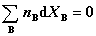 , 或
, 或 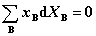 。
。
此处,xB 指B的摩尔分数,XB指B的偏摩尔量。
3. 偏摩尔量间的关系
广延热力学量间原有的关系,在它们取了偏摩尔量后,依然存在。
例:H= U + PV Þ HB= UB + PVB; A= U - TS Þ AB= UB - TSB;
G= H – TS Þ GB= HB - TSB;…
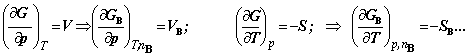
4. 化学势
定义 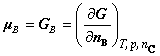
5. 单相多组分系统的热力学公式


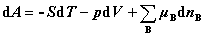


但按定义,只有 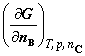 才是偏摩尔量,其余3个均不是偏摩尔量。
才是偏摩尔量,其余3个均不是偏摩尔量。
6. 化学势判据
在dT = 0 , dp = 0 δW’= 0 的条件下,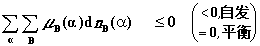
其中, 指有多相共存,
指有多相共存, 指
指  相内的B 物质。
相内的B 物质。
7. 纯理想气体B在温度T﹑压力p时的化学势 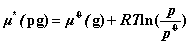
pg 表示理想气体,* 表示纯态, 为气体的标准化学势。真实气体标准态与理想气体标准态均规定为纯理想气体状态,其压力为标准压力
为气体的标准化学势。真实气体标准态与理想气体标准态均规定为纯理想气体状态,其压力为标准压力 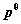 = 100 kPa。
= 100 kPa。
8. 理想气体混合物中任一组分B的化学势
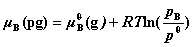
其中,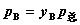 为B的分压。
为B的分压。
9. 纯真实气体B在压力为p时的化学势
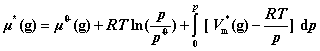
其中, 为纯真实气体的摩尔体积。低压下,真实气体近似为理想气体,故积分项为零。
为纯真实气体的摩尔体积。低压下,真实气体近似为理想气体,故积分项为零。
10. 真实气体混合物中任一组分B的化学势
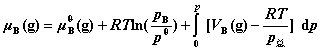
其中,VB(g)为真实气体混合物中组分B在该温度及总压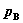 下的偏摩尔体积。低压下,真实气体混合物近似为理想气体混合物,故积分项为零。
下的偏摩尔体积。低压下,真实气体混合物近似为理想气体混合物,故积分项为零。
11. 拉乌尔定律与亨利定律(对非电解质溶液)
拉乌尔定律: 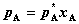
其中,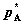 为纯溶剂A之饱和蒸气压,
为纯溶剂A之饱和蒸气压,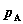 为稀溶液中溶剂A的饱和蒸气分压,xA为稀溶液中A的摩尔分数。
为稀溶液中溶剂A的饱和蒸气分压,xA为稀溶液中A的摩尔分数。
亨利定律: 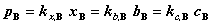
其中,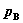 为稀溶液中挥发性溶质在气相中的平衡分压,
为稀溶液中挥发性溶质在气相中的平衡分压,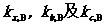 为用不同单位表示浓度时,不同的亨利常数。
为用不同单位表示浓度时,不同的亨利常数。
12. 理想液态混合物
定义:其任一组分在全部组成范围内都符合拉乌尔定律的液态混合物。
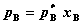
其中,0≤xB≤1 , B为任一组分。
13. 理想液态混合物中任一组分B的化学势 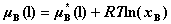
其中,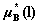 为纯液体B在温度T﹑压力p下的化学势。
为纯液体B在温度T﹑压力p下的化学势。
若纯液体B在温度T﹑压力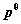 下标准化学势为
下标准化学势为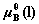 ,则有:
,则有:
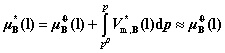
其中,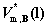 为纯液态B在温度T下的摩尔体积。
为纯液态B在温度T下的摩尔体积。
14. 理想液态混合物的混合性质
① 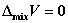 ;
;
② 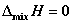 ;
;
③ 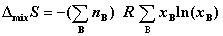 ;
;
④ 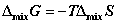
15. 理想稀溶液
① 溶剂的化学势:

当p与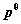 相差不大时,最后一项可忽略。
相差不大时,最后一项可忽略。
② 溶质B的化学势:

我们定义:
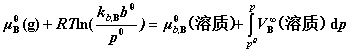
同理,有:
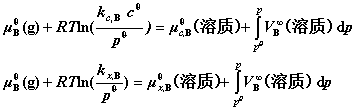
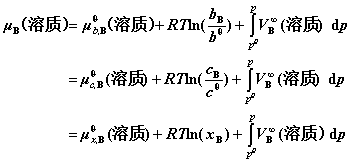
注:(1)当p与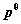 相差不大时,最后一项积分均可忽略。
相差不大时,最后一项积分均可忽略。
(2)溶质B的标准态为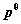 下B的浓度分别为
下B的浓度分别为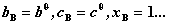 , 时,B仍然遵循亨利定律时的假想状态。此时,其化学势分别为
, 时,B仍然遵循亨利定律时的假想状态。此时,其化学势分别为 ﹑
﹑ ﹑
﹑ 。
。
16. 分配定律
在一定温度与压力下,当溶质B在两种共存的不互溶的液体α﹑β间达到平衡时,若B在α﹑β两相分子形式相同,且形成理想稀溶液,则B在两相中浓度之比为一常数,即分配系数。
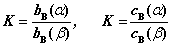
17. 稀溶液的依数性(公式不用记)
① 溶剂蒸气压下降: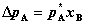
② 凝固点降低:(条件:溶质不与溶剂形成固态溶液,仅溶剂以纯固体析出)

③ 沸点升高:(条件:溶质不挥发)

④ 渗透压: 
18. 逸度与逸度因子
气体B的逸度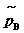 ,是在温度T﹑总压力
,是在温度T﹑总压力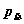 下,满足关系式:
下,满足关系式:
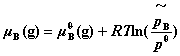
的物理量,它具有压力单位。其计算式为:
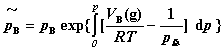
逸度因子(即逸度系数)为气体B的逸度与其分压力之比:
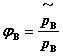
理想气体逸度因子恒等于1 。
19. 活度与活度因子
对真实液态混合物中溶剂:
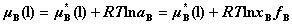 ,且有:
,且有: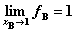 ,其中aB为组分B的活度,fB为组分B的活度因子。
,其中aB为组分B的活度,fB为组分B的活度因子。
若B挥发,而在与溶液平衡的气相中B的分压为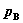 ,则有
,则有
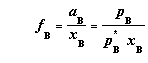 ,且
,且 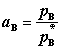
对温度T压力p下,真实溶液中溶质B的化学势,有:
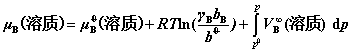
其中,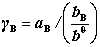 为B的活度因子,且
为B的活度因子,且
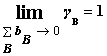 。
。
当p与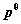 相差不大时,
相差不大时,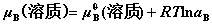 ,对于挥发性溶质,其在气相中分压为:
,对于挥发性溶质,其在气相中分压为: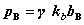 ,则
,则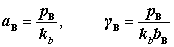 。
。
第五章 化学平衡
1. 化学反应亲和势的定义

A代表在恒温、恒压和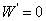 的条件下反应的推动力,A >0反应能自动进行;A=0处于平衡态;A< 0反应不能自动进行。
的条件下反应的推动力,A >0反应能自动进行;A=0处于平衡态;A< 0反应不能自动进行。
2. 摩尔反应吉布斯函数与反应进度的关系

式中的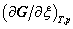 表示在T,p及组成一定的条件下,反应系统的吉布斯函数随反应进度的变化率,称为摩尔反应吉布斯函数变。
表示在T,p及组成一定的条件下,反应系统的吉布斯函数随反应进度的变化率,称为摩尔反应吉布斯函数变。
3. 化学反应的等温方程
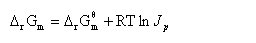
式中 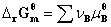 ,称为标准摩尔反应吉布斯函数变;
,称为标准摩尔反应吉布斯函数变;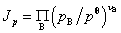 ,称为反应的压力商,其单位为1。此式适用理想气体或低压下真实气体,,在T,p及组成一定,反应进度为1 mol时的吉布斯函数变的计算。
,称为反应的压力商,其单位为1。此式适用理想气体或低压下真实气体,,在T,p及组成一定,反应进度为1 mol时的吉布斯函数变的计算。
4. 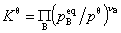 标准平衡常数的表达式
标准平衡常数的表达式
式中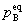 为参加化学反应任一组分B的平衡分压力,γB为B的化学计量数。Kθ量纲为一。若已知平衡时参加反应的任一种物质的量nB,摩尔分数yB,系统的总压力p,也可采用下式计算
为参加化学反应任一组分B的平衡分压力,γB为B的化学计量数。Kθ量纲为一。若已知平衡时参加反应的任一种物质的量nB,摩尔分数yB,系统的总压力p,也可采用下式计算 :
:
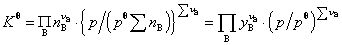
式中 为系统中气体的物质的量之和,
为系统中气体的物质的量之和,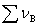 为参加反应的气态物质化学计量数的代数和。此式只适用于理想气体。
为参加反应的气态物质化学计量数的代数和。此式只适用于理想气体。
5. 标准平衡常数的定义式
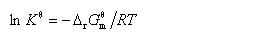
或 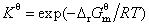
6. 化学反应的等压方程——范特霍夫方程
微分式 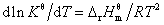
积分式 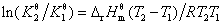
不定积分式 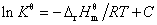
对于理想气体反应,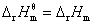 ,积分式或不定积分式只适用于
,积分式或不定积分式只适用于 为常数的理想气体恒压反应。若
为常数的理想气体恒压反应。若 是T的函数,应将其函数关系式代入微分式后再积分,即可得到
是T的函数,应将其函数关系式代入微分式后再积分,即可得到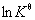 与T的函数关系式。
与T的函数关系式。
第六章 相平衡
1. 吉布斯相律 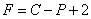
式中F为系统的自由度数(即独立变量数);P为系统中的相数;“2”表示平衡系统只受温度、压力两个因素影响。要强调的是,C称为组分数,其定义为C=S-R-R′,S为系统中含有的化学物质数,称物种数;R为独立的平衡化学反应数;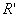 为除任一相中
为除任一相中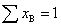 (或
(或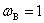 )。同一种物质在各平衡相中的浓度受化学势相等限制以及R个独立化学反应的标准平衡常数
)。同一种物质在各平衡相中的浓度受化学势相等限制以及R个独立化学反应的标准平衡常数 对浓度限制之外,其他的浓度(或分压)的独立限制条件数。
对浓度限制之外,其他的浓度(或分压)的独立限制条件数。
相律是表示平衡系统中相数、组分数及自由度数间的关系。供助这一关系可以解决:(a)计算一个多组分多平衡系统可以同时共存的最多相数,即F=0时,P值最大,系统的平衡相数达到最多;(b)计算一个多组分平衡系统自由度数最多为几,即是确定系统状态所需要的独立变量数;(c)分析一个多相平衡系统在特定条件下可能出现的状况。
应用相律时必须注意的问题:(a)相律是根据热力学平衡条件推导而得的,故只能处理真实的热力学平衡系统;(b)相律表达式中的“2”是代表温度、压力两个影响因素,若除上述两因素外,还有磁场、电场或重力场对平衡系统有影响时,则增加一个影响因素,“2”的数值上相应要加上“1”。若相平衡时两相压力不等,则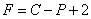 式不能用,而需根据平衡系统中有多少个压力数值改写“2”这一项;(c)要正确应用相律必须正确判断平衡系统的组分数C和相数P。而C值正确与否又取决与R与R‘的正确判断;(d)自由度数F只能取0以上的正值。如果出现F<0,则说明系统处于非平衡态。
式不能用,而需根据平衡系统中有多少个压力数值改写“2”这一项;(c)要正确应用相律必须正确判断平衡系统的组分数C和相数P。而C值正确与否又取决与R与R‘的正确判断;(d)自由度数F只能取0以上的正值。如果出现F<0,则说明系统处于非平衡态。
2. 杠杆规则
杠杆规则在相平衡中是用来计算系统分成平衡两相(或两部分)时,两相(或两部分)的相对量,如图6-1所示,设在温度为T下,系统中共存的两相分别为α相与β相。
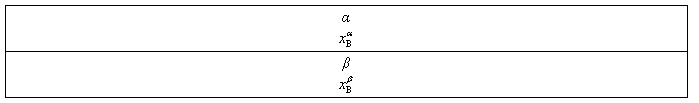

图6-1 说明杠杆规则的示意图
图中M,α,β分别表示系统点与两相的相点;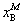 ,
,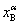 ,
,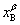 分别代表整个系统,α相和β相的组成(以B的摩尔分数表示);
分别代表整个系统,α相和β相的组成(以B的摩尔分数表示);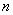 ,
,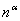 与
与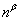 则分别为系统点,α相和β相的物质的量。由质量衡算可得
则分别为系统点,α相和β相的物质的量。由质量衡算可得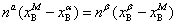
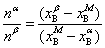 或
或
上式称为杠杆规则,它表示α,β两相之物质的量的相对大小。如式中的组成由摩尔分数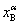 ,
,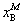 ,
,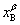 换成质量分数
换成质量分数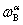 ,
, ,
,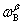 时,则两相的量相应由物质的量
时,则两相的量相应由物质的量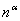 与
与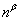 (或
(或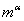 与
与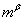 )。由于杠杆规则是根据物料守恒而导出的,所以,无论两相平衡与否,皆可用杠杆规则进行计算。注意:若系统由两相构成,则两相组成一定分别处于系统总组成两侧。
)。由于杠杆规则是根据物料守恒而导出的,所以,无论两相平衡与否,皆可用杠杆规则进行计算。注意:若系统由两相构成,则两相组成一定分别处于系统总组成两侧。
溶液组成的表示法:(1)物质的量分数: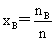 (2)质量摩尔浓度:
(2)质量摩尔浓度: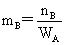 (3)物质的量浓度:
(3)物质的量浓度: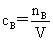 (4)质量浓度
(4)质量浓度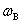
拉乌尔定律 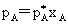 亨利定律:
亨利定律: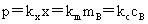
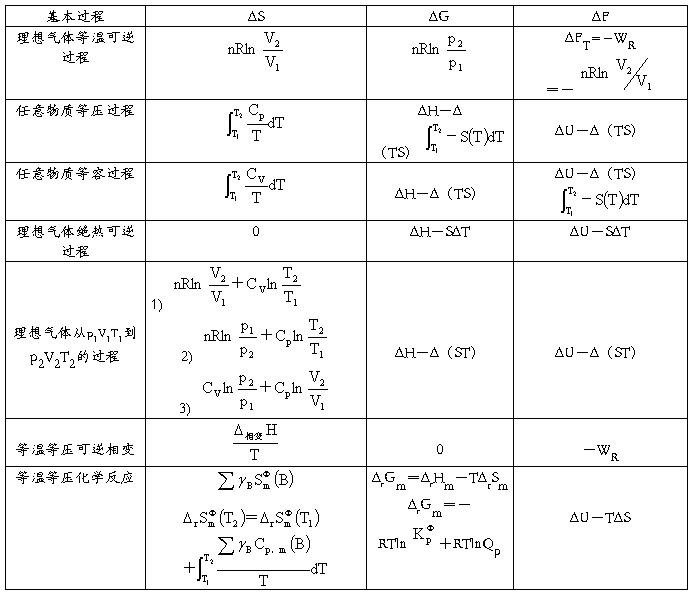
一些基本过程的ΔS、ΔG、ΔF的运算公式(Wf=0)
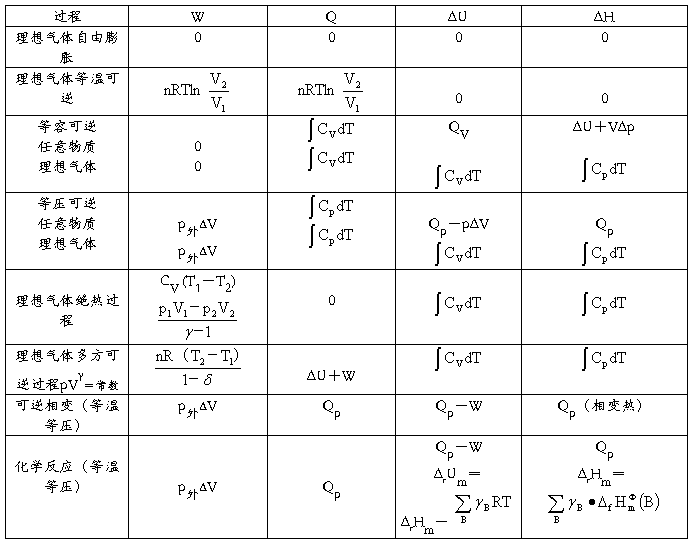
一些基本过程的W、Q、ΔU、ΔH的运算公式(Wf=0)
胶体分散体系和大分子溶液
布朗运动公式: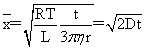 (D为扩散系数)
(D为扩散系数)
球形粒子的扩散系数: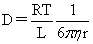
渗透压: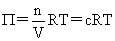 渗透力:F=
渗透力:F=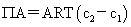 扩散力=-F
扩散力=-F
沉降平衡时粒子随高度分布公式: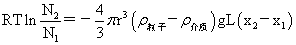
瑞利公式: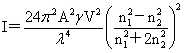
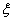 电势 表面电势
电势 表面电势 Stern电势
Stern电势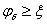 电解质浓度增加
电解质浓度增加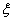 电势减小。
电势减小。
电泳速度: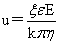 k=6时为电泳,k=4时为电渗。
k=6时为电泳,k=4时为电渗。
大分子稀溶液渗透压公式:
