高二化学选修5实验教学计划(人教版)
学校: 天祝二中 备课组: 高二化学备课组
第二篇:人教版高二化学选修四实验专题
高二化学实验专题
一、中和热及其实验测定
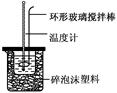
 1.50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和反应的反应热。回答下列问题:(1)从实验装置上看,图中尚缺少的一种玻璃用品是____________。
1.50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和反应的反应热。回答下列问题:(1)从实验装置上看,图中尚缺少的一种玻璃用品是____________。
(2)烧杯间填满碎纸条的作用是__________________。
(3)大烧杯上如不盖硬纸板,求得的中和热的数值________(填“偏大”“偏小”或“无影响”)。
(4)实验中改用60 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”),所求中和热________(填“相等”或“不相等”);简述理由:____________________________________。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和反应的反应热的数值会________;用50 mL 0.50 mol·L-1NaOH溶液进行上述实验,测得的中和反应的反应热的数值会__________(填“偏大”“偏小”或“无影响”)。
 2、实验室利用如图装置进行中和热的测定,请回答下列问题:
2、实验室利用如图装置进行中和热的测定,请回答下列问题:
(1)该图中有两处未画出,它们是________,________。
(2)在操作正确的前提下,提高中和热测定准确性的关键是_______________________。
(3)如用0.5 mol/L的盐酸与NaOH固体进行实验,则实验中测得的“中和热”数值将________(填“偏大”、“偏小”、“不变”);原因是__________________________________。
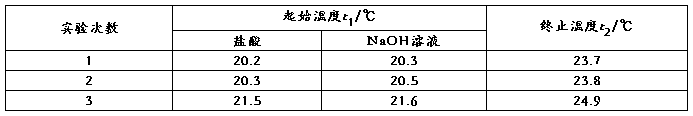
3、实验室用50 mL 0.50 mol·L-1盐酸、50 mL 0.55 mol·L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:
 完成下列问题:
完成下列问题:
(1)实验时用环形玻璃搅拌棒搅拌溶液的方法是____________,不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是__________________。
(2)经数据处理,t2-t1=3.4℃。则该实验测得的中和热ΔH=________[盐酸和NaOH溶液的密度按1 g·cm-3计算,反应后混合溶液的比热容(c)按4.18 J·(g·℃)-1计算]。
4、实验室进行中和热测定的实验时除需要大烧杯(500 mL)、小烧杯(100 mL)外,所用的其他仪器和试剂均正确的一组是( )
A.0.50 mol·L-1盐酸,0.50 mol·L-1NaOH溶液,100 mL量筒1个
B.0.50 mol·L-1盐酸,0.55 mol·L-1NaOH溶液,100 mL量筒2个
C.0.50 mol·L-1盐酸,0.55 mol·L-1NaOH溶液,50 mL量筒1个
D.0.50 mol·L-1盐酸,0.55 mol·L-1NaOH溶液,50 mL量筒2个
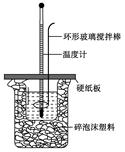 5、(8分)用50 mL 0.50 mol·L-1的盐酸与50 mL 0.55 mol·L-1的氢氧化钠溶液在如下图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
5、(8分)用50 mL 0.50 mol·L-1的盐酸与50 mL 0.55 mol·L-1的氢氧化钠溶液在如下图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)烧杯间填满碎泡沫塑料的作用是____________________________;
(2)环形玻璃搅拌棒能否用环形铁质搅拌棒代替?_________________
(填“能”或“不能”),其原因是_______________________________;
(3)为什么氢氧化钠溶液的浓度要用0.55 mol·L-1? ___________________________;
实验中若改用60 mL 0.50 mol·L-1的盐酸与50 mL 0.55 mol·L-1的氢氧化钠溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”),若实验操作均正确,则所求中和热____________________________________(填“相等”或“不相等”);
(4)已知在稀溶液中,强酸和强碱发生中和反应生成1 mol H2O时,放出57.3 kJ的热量,则上述反应的热化学方程式为:_______________________________________________;
(5)若某同学利用上述装置做实验,有些操作不规范,造成测得的结果偏低,请你分析结果偏低的原因可能是________(填字母代号)。
a.测量盐酸的温度后,温度计没有用水冲洗干净
b.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
c.做本实验的当天室温较高
d.将50 mL 0.55 mol·L-1的氢氧化钠溶液取成了50 mL 0.55 mol·L-1的氨水
e.在量取盐酸时仰视读数
f.大烧杯的盖板中间小孔太大
二、化学反应速率的测定
某化学兴趣小组的甲、乙两位同学对测定化学反应速率非常感兴趣,为此进行了有关的实验探究,实验记录如下。
[实验目的] 测量锌和稀硫酸反应的速率
[实验用品]
锥形瓶、双孔塞、分液漏斗、直角导管、50 mL注射器、铁架台、秒表、锌粒、1 mol·L-1的H2SO4、4 mol·L-1的H2SO4。
[实验步骤] (1)甲同学取一套如图装置,加入40 mL 1 mol·L-1的H2SO4,测量收集10 mL H2所需的时间。
(1)甲同学取一套如图装置,加入40 mL 1 mol·L-1的H2SO4,测量收集10 mL H2所需的时间。
(2)乙同学取另一套同样的装置,加入40 mL 4 mol·L-1的H2SO4,测量收集10 mL H2所需的时间。
回答下列问题:
(1)Zn与稀H2SO4反应的离子方程式为_________________________________________。
(2)收集10 mL H2所需时间:甲________乙(填“大于”、“小于”或“等于”)。反应速率:甲________乙(填“大于”、“小于”或“等于”)。
(3)下列说法正确的是________。
A.本实验中甲、乙两同学所用锌粒的表面积要相同
B.装置气密性要好
C.40 mL的H2SO4要迅速加入
D.测量气体体积还可以用排水法
E.若用98%的浓H2SO4,则反应最快
(4)测定Zn和稀H2SO4反应的速率还可用的方法有:
 ①__________________; ②__________________。
①__________________; ②__________________。
三、弱电解质
1、(1)某化学兴趣小组用如图所示的装置测1 mol·L-1
的CH3COOH溶液和1 mol·L-1 HCl溶液的导电能力,接
通电源后发现与HCl溶液相连的灯泡较亮,有同学认为
乙酸是弱电解质,你________(填“同意”或“不同意”)他的观点,通过该现象你得到的结论是____________________________________________________。
(2)他们又用上述装置测物质的量浓度相同的CuSO4溶液和NaOH溶液的导电能力,接通电源后发现与CuSO4溶液相连的灯泡较亮,有同学认为NaOH是弱电解质,你________(填“同意”或“不同意”)他的观点,通过该现象你得到的结论是________。
(3)通过上述探究实验,你能得到的结论是____________________________________
________________________________________________________________________。
2、有一学生甲在实验室测某溶液的pH,实验时,他先用蒸馏水润湿pH试纸,然后用洁净干燥的玻璃棒蘸取试样进行检测。学生乙对学生甲的操作的评价为:操作错误,测定结果一定有误差。学生丙对学生甲操作的评价为:操作错误,但测定结果不一定有误差。
(1)你支持________(填“乙”或“丙”)同学的观点,原因是
________________________________________________________________________
________________________________________________________________________。
(2)若用此法分别测定c(H+)相等的盐酸和醋酸溶液的pH,误差较大的是________,原因是________________________________________________________________________。
(3)只从下列试剂中选择实验所需的物品,你________(填“能”或“不能”)区分0.1 mol/L的硫酸和0.01 mol/L的硫酸.若能,简述操作过程。
________________________________________________________________________
________________________________________________________________________.
①紫色石蕊试液 ②酚酞试液 ③甲基橙试液
④蒸馏水 ⑤BaCl2溶液 ⑥pH试纸
四、酸碱中和滴定
1、用中和滴定法测定烧碱的纯度,若烧碱中含有与酸不反应的杂质,试根据实验回答:
(1)将准确称取的4.3 g烧碱样品配成250 mL待测液,需要的主要仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有__________________________________________________。
(2)取10.00 mL待测液,用________式滴定管量取。
(3)用0.200 0 mol·L-1标准盐酸滴定待测烧碱溶液,滴定时左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视________,直到滴定终点。
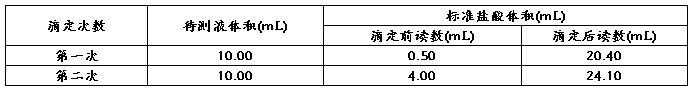
(4)根据下列数据,烧碱的纯度为________。
2、用中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:
(1)准确称量8.2 g 含有少量中性易溶杂质的样品,配成500 mL 待测溶液。称量时,样品可放在________(填编号字母)称量。
A.小烧杯中 B.洁净纸片上 C.托盘上
(2)滴定时,用0.200 0 mol/L的盐酸来滴定待测溶液,不可选用________(填编号字母)作指示剂。
A.甲基橙 B.石蕊
C.酚酞 D.甲基红
(3)滴定过程中,眼睛应注视________________________________________________;
在铁架台上垫一张白纸,其目的是___________________________________________。
(4)根据下表数据,计算被测烧碱溶液的物质的量浓度是________mol/L,烧碱样品的纯度是________。

3、某学生用0.200 0 mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线稍下,并记下读数
④移取20 .00 mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数
请回答:
(1)以上步骤有错误的是(填编号)________,该错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”)________。
(2)步骤⑤中,在记下滴定管液面读数时,滴定管尖嘴有气泡,测定结果________。
(填“偏大”、“偏小”或“无影响”)
(3)判断滴定终点的现象是:________________________________________________
4、用氧化还原滴定法测定TiO2的质量分数;一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。
(1)配制NH4Fe(SO4)2标准溶液时,使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要下图中的______(填字母代号)。

(2)滴定终点的现象是______________________________________________________。
(3)滴定分析时,称取TiO2(摩尔质量为M g/mol)试样w g,消耗c mol/L NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数表达式为________________。
5、某学生用0.200 0 mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线以下某一刻度,并记下读数
④移取20.00 mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数
请回答:
 (1)以上步骤有错误的是(填编号)______________,该错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”____________。
(1)以上步骤有错误的是(填编号)______________,该错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”____________。
(2)判断滴定终点的现象是:锥形瓶中溶液从________色变为________色,
且半分钟内不变色。
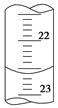
(3)如图是某次滴定时的滴定管中的液面,其读数为________ mL。
(4)根据下列数据:请计算待测盐酸溶液的浓度为____________ mol·L-1。

一、中和热及其实验测定
1.[解析] 这是一道有关中和反应的反应热测定的题目,要求弄清实验仪器和操作要求,并要注意实验中必须有一种反应物过量才能保证生成水的量。[答案](1)环形玻璃搅拌棒(2)减少实验过程中的热量损失(3)偏小(4)不相等相等因为中和热是指酸跟碱发生中和反应生成1 mol H2O所放出的能量,与酸碱的用量无关(5)偏小偏小
2、解析:(1)由装置图可知,装置缺少搅拌用的环形玻璃搅拌棒和保温使用的泡沫塑料板或硬纸板。(2)该实验关键是对温度的测定,在操作正确的前提下要提高装置的保温效果。(3)因为固体氢氧化钠溶于水要放热,则该实验测出“中和热”的数值偏大。答案:(1)环形玻璃搅拌棒 泡沫塑料板或硬纸板(2)提高装置的保温效果(3)偏大 氢氧化钠固体溶于水放热
3、解析:(1)对于本实验,让氢氧化钠溶液和盐酸尽可能完全反应是减小误差的一个方面,所以实验时用环形玻璃搅拌棒上下搅动,以防将温度计损坏。做好保温工作是减小误差的另一个重要方面,所以选用环形玻璃搅拌棒,而不是铜丝搅拌棒。
(2)ΔH=-[100 g×4.18×10-3 kJ·(g·℃)-1×3.4℃]÷0.025 mol=-56.8 kJ·mol-1。
答案:(1)上下搅动(或轻轻搅动)Cu传热快,热量损失大(2)-56.8 kJ·mol-1
4、答案:D
5、解析 (1)(2)填充大量泡沫、使用玻璃搅拌器都是防止热量的损失;
(3)中由于参加反应的盐酸(60 mL 0.50 mol·L-1)与氢氧化钠(50 mL 0.55 mol·L-1)完全反应后生成的水的物质的量(50 mL×0.55 mol·L-1)比原来(50 mL×0.50 mol·L-1)多,所以放出的热量多,但中和热不变;
(5)中a.测量盐酸的温度后,温度计没有用水冲洗干净,使参加反应的盐酸的量减小,所测定的热量减少,计算的中和热偏低;b.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓会造成热量损耗,使计算结果偏低;c.做本实验的当天室温较高对所测定的热量无影响;d.将50 mL 0.55 mol·L-1的氢氧化钠溶液取成50 mL 0.55 mol·L-1的氨水,由于NH3·H2O为弱电解质,其电离需要吸热,导致反应产生的热量少,测得中和热偏低;e.在量取盐酸时仰视读数,使所取盐酸的体积大于50.0 mL,反应放热多,计算时中和热偏高;f.大烧杯的盖板中间小孔太大,热量损失,中和热偏低。
答案 (1)减少热量损失 (2)不能 ①铁会和盐酸反应,②铁导热性好,热量损失较大 (3)为了确保盐酸完全被中和 不相等 相等 (4)NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1 (5)abdf
二、化学反应速率的测定
解析:(1)Zn与稀H2SO4反应离子方程式为:Zn+2H+===Zn2++H2↑
(2)因为甲同学所用H2SO4的浓度比乙同学所用H2SO4的浓度小,故反应速率小,所用时间长。(3)因为本实验是测定浓度对化学反应速率的影响,故要保证其它因素是相同的,如所用锌粒的表面积相同,A正确;本实验是根据测定收集10 mL H2所需的时间长短来判断反应速率的,故装置气密性要好,为减少实验误差,加入H2SO4时要迅速,B、C正确;测量气体的体积还可用排水法测量,D正确;因为Zn与98%的浓H2SO4反应生成ZnSO4、SO2和H2O,反应的实质改变,E错误。(4)还可利用等质量的Zn完全溶解所用时间不同以及H2SO4浓度的变化等来测量化学反应速率。答案:(1)Zn+2H+===Zn2++H2↑(2)大于 小于(3)A、B、C、D(4)测定等质量的Zn完全溶解所需要的时间;单位时间内H2SO4浓度的变化
三、弱电解质
1、解析:(1)已知HCl在水中能完全电离,通过导电能力的不同可以判断出CH3COOH在水溶液中不能完全电离,使溶液中自由移动离子的浓度比盐酸中的小,即CH3COOH是弱电解质;(2)通过NaOH溶液和CuSO4溶液导电能力的实验可知,自由移动离子浓度相同时,电解质溶液的导电能力与离子所带电荷数目有关;(3)综合(1)和(2)即可得出正确结论。
答案:(1)同意 阴、阳离子所带电荷数目相同时,单位体积内自由移动离子数目越多,电解质溶液的导电能力越强(2)不同意 当单位体积内自由移动离子数目相同时,阴、阳离子所带电荷数目越多,电解质溶液的导电能力越强(3)电解质溶液的导电能力是由单位体积内自由移动离子的数目和离子所带电荷数目共同决定的
2、解析:(1)用pH试纸测溶液的pH时,试纸不能润湿,否则,相当于将溶液稀释,酸性溶液的pH偏大,碱性溶液的pH偏小,但中性溶液的pH无影响。(2)用湿润的pH试纸测量溶液的pH时,对强电解质溶液pH的影响更大,因弱电解质溶液在稀释过程中要继续电离,稀释后的弱电解质溶液中离子浓度比强电解质溶液中离子浓度更接近未稀释时的离子浓度。(3)0.1 mol/L的硫酸和0.01 mol/L的硫酸浓度差别较大,可直接用pH试纸鉴别。
答案:(1)丙 当溶液呈中性时,则不产生误差;否则将产生误差(2)盐酸 原因是在稀释过程中醋酸继续电离产生H+,使得溶液中c(H+)的变化比盐酸小,误差较小(3)能 用玻璃棒分别醮取两种溶液点在两张pH试纸上,与标准比色卡比较其pH,pH较大的为0.01 mol/L的硫酸
四、酸碱中和滴定
1、[解析] (1)配制一定物质的量浓度的溶液需要用一定规格的容量瓶、胶头滴管等。
(2)待测液为碱液,用碱式滴定管量取。 (3)第一次V1(盐酸)=19.90 mL,第二次V2(盐酸)=20.10 mL,两次均平均V(盐酸)=20.00 mL。
设烧碱的纯度为x,
× mol=0.02 L×0.200 0mol·L-1,
x=0.9302,即其纯度为93.02%。
[答案] (1)250 mL容量瓶、胶头滴管 (2)碱 (3)锥形瓶内溶液颜色变化 (4)93.02%
2、解析:(1)称量氢氧化钠等易潮解、腐蚀性强的试剂时,样品应放在小烧杯中;
(2)酸碱中和滴定时,一般应选甲基橙、酚酞、甲基红等颜色变化较明显的指示剂,石蕊在酸或碱溶液中颜色变化不明显,易造成误差;
(4)根据c(NaOH)=分别求第一、二次的值,再求平均值,解得c(NaOH)=0.400 0 mol/L;样品纯度为NaOH%=×100%=97.6%。
答案:(1)A (2)B(3)锥形瓶内溶液颜色变化 便于观察锥形瓶溶液颜色的变化,减小滴定误差(4)0.400 0 97.6%
3、解析:(1)碱式滴定管必须用待装液润洗。若不润洗则相当于稀释NaOH溶液,则会使结果偏大。(3)滴定终点由无色变为红色且半分钟内不变色。
答案:(1)① 偏大 (2)偏小 (3)滴入最后一滴NaOH溶液,混合液由无色变为红色且半分钟内不变色
4、答案:(1)ac(2)溶液变为红色,且半分钟溶液颜色不发生变化
(3)(或%)
5、解析 (1)①用蒸馏水洗涤碱式滴定管后,不能立即注入NaOH溶液,应先用NaOH溶液润洗;否则所用NaOH溶液的体积偏大,导致测定盐酸的浓度偏大。(2)酚酞试剂在酸性溶液中呈无色,当溶液呈弱碱性时,溶液呈粉红色。(4)取前两次所用NaOH溶液体积的平均值(第三次误差较大,舍去),然后代入公式进行计算:c(酸)V(酸)=c(碱)V(碱),故c(酸)=c(碱)V(碱)/V(酸)。
答案 (1)① 偏大 (2)无 粉红 (3)22.60(4)0.200 0
