必修1 第一章 第二节化学计量在实验中的应用 检测题
一:选择题
1:从500mL1mol/L NaOH溶液中取出100mL溶液,对这100mL溶液的叙述中正确的是 ( )
A.物质的量浓度为1mol/L B.溶液中含1mol NaOH
C.溶液中含4gNaOH D.物质的量浓度为0.2 mol/L
2:.物质的量浓度相同的NaCl、MgCl2、AlCl3三种溶液,当溶液的体积比为3∶2∶1时,三种溶液中Cl-的物质的量浓度之比为 ( )
A.1∶1∶1 B.1∶2∶3 C.3∶2∶1 D.3∶4∶3
3:设NA为阿伏加德罗常数,下列对0.3mol/LK2SO4溶液的不正确说法是 ( )。
A.1L溶液中含有0.3NA个K+离子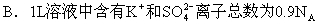
C.2L溶液中含K+的物质的量浓度为1.2mol/L

4:20mLCaCl2溶液加水稀释至100mL,稀释后的溶液中Cl-离子的物质的量浓度为1mol/L,则稀释前CaCl2的物质的量浓度为( )
A.2.5mol/L B.5mol/L C.1.25 mol/L D.2mol/L
5:200mL0.3mmol/L的盐酸和100mL0.6 mol/L的盐酸相混,所得溶液的物质的量浓度约是 ( )
A.0.3 mol/L B.0.4 mol/L
C.0.5 mol/L D.0.6 mol/L
6:下列溶液中的Cl-离子的物质的量浓度与50mL1mol/LFeCl3溶液中的Cl-离子的物质的量浓度相同的是 ( )
A.150mL1 mol/L NaCl溶液 B.75mL2 mol/L NH4Cl溶液
C.150mL3 mol/L KCl溶液 D.75mL1 mol/L AlCl3溶液
7:20℃时,NaCl的溶解度36g,此时NaCl饱和溶液的密度为1.12g/cm3,在此温度下NaCl饱和溶液的物质的量浓度为( )
A.0.15mol/L B.1.36mol/L C.5.07mol/L D.6.15mol/L
8:0.5L 1mol/L FeCl3溶液与0.2L1mol/L KCl溶液中的Cl-的数目之比为( )
A.1∶3 B.3∶1 C.5∶2 D.15∶2
9:将30mL 0.5 mol/L NaOH溶液加水稀释到500mL,稀释后溶液中NaOH的物质的量浓度为 ( )
A.0.03 mol/L B.0.3 mol/L C.0.05 mol/L D.0.04 mol/L
10:50mL H2SO4的质量分数为35%、密度为1.24g/cm3的硫酸中,H2SO4的物质的量浓度为 ( )
A.0.044 mol/L B.0.44 mol/L C.4.4mol/L D.44mol/L
11:配制2L1.5mol/LNa2SO4溶液,需要固体Na2SO4( )
A.213g B.284g C.400g D.426g
12:用10mL的0.1mol/LBaCl2溶液恰好使相同体积的硫酸铁,硫酸锌,和硫酸钾三种溶液中的硫酸根离子完全转化为硫酸钡沉淀,则三种硫酸盐溶液的物质的量浓度之比是 ( )
A.3∶2∶2 B.1∶2∶3 C.1∶3∶3 D.3∶1∶1
13:下列说法中不正确的是 ( )
A.1mol任何物质都含有约6.02×1023个原子
B.0.012kg12C含有约6.02×1023个碳原子
C.1个氧原子的实际质量约为32/6.02×1023g
D.3molOH-的质量为51g
14:0.1mol某元素的单质直接与氯气反应后,质量增加7.1g,这种元素可能是 ( )
A.Ca B.Na C.Al D.Mg
15:从1mol/LNaOH溶液2L中取出100mL,有关这100mL溶液的叙述中不正确的是 ( )
A.物质的量浓度为0.1mol/L B.物质的量浓度为1mol/L
C.含NaOH 40g D.含NaOH0.1mol
16:将7.45g氯化钾和11.1g氯化钙组成的混合物溶于水配成200mL溶液,此溶液中Cl-离子的物质的量浓度是 ( )
A.3mol/L B.1.5mol/L C.0.3mol/L D.0.2mol/L
17:下列各组物质中,两种物质分子数相同的是 ( )
A.1gH2和8gO2 B.18gH2O和22.4LCO2(标准状况)
C.1molHCl和11.2LCO(20℃101kPa时) D.6.02×1023个H2分子和0.5molN2
18:若以NA代表阿伏加德罗常数,下列说法中正确的是( )
A.2.3g金属钠变成Na+时共失去0.1NA个电子 B.18g水所含电子数为NA
C.32g氧气所含原子数为2NA D.11.2LN2所含原子数为NA
19:下列数量的各物质所含原子数按由大到小顺序排列是 ( )
①4℃时144mL水 ②34g氨气 ③标准状况下224L氢气 ④1.1mol硫酸
A.④③②① B.①②③④ C.③①④② D.①③②④
20:下列溶液中的Cl-的物质的量浓度与50mL1mol/L AlCl3溶液中Cl-物质的量浓度相等的是( )
A.150mL 1 mol/L氯化钠 B.75mL 2 mol/L氯化铵
C.150mL 3 mol/L氯化钾 D.75mL 1 mol/L氯化铁
二:填充题
1:欲配制1mol/L的Na2CO3溶液250mL,完成下列步骤:
(1)用天平称取NaOH固体____g,做法是先在托盘天平的两盘上各放__
,把天平调整好。在____盘上用_____放_____g砝码,并将游码移到适当的位置上,用_____取Na2CO3粉末 g放于___ __盘上。
(2)将称量好的NaOH固体放入__ __中加_ ___ 蒸馏水将其溶解,待__ _后,将溶液沿___ _移入__ __mL 的容量瓶中。
(3)用少量蒸馏水冲洗___ _次,将冲洗液移入_ ___中,在操作过程中不能损失点滴液体。否则会使溶液的浓度偏___ _(低或高)
(4)向容量瓶内加水至刻度线___ _时,改用__ __小心加水至溶液凹液面与刻度线相切,若加水超过刻度线,会造成溶液浓度偏__ __,应该___ _。
最后盖好瓶塞,倒转,振荡,摇匀。
2:1 mol CO2的质量约是1个CO2分子质量的__ ___倍,1mol CO2的质量与CO2的相对分子质量相比,两者__ ___相同,但前者以__ __为单位,后者以___ _为标准。某瓶CO2中含有1.204×1024个CO2分子,这些CO2的质量为__ __g。2molCO2中所含的氧原子数为__ __个。5mol CO32-质量为____g,它和___ _molMg2+质量相同,它和___ _gSO42-含有相同的离子数
三;计算题
1:将4mL37%的浓盐酸(密度为1.19g/cm3)加水稀释至200mL求稀释后盐酸的物质的量浓度。
第二节检测题参考答案
一:选择题

二:填充题:
1:(1)10 、一张等重的纸,右,镊子、10、左
(2)烧杯,少量,冷却,玻璃棒,250
(3)2~3,容量瓶,低
(4)2~3cm,胶头滴管,低,重新配制
(5)摇匀,试剂瓶
2:6.02×1023;数值;g;碳-12 质量的1/12;
88;2.408×1024;300g;12.5;480
三:计算题
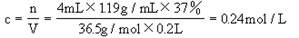 1:
1:
第二篇:高中化学《化学计量在实验中的应用》教案 新人教版必修1
第一章 第二节 化学计量在实验中的应用
第一课时 物质的量
岚县高级中学 康翻连
教学目标:
知识与能力:
1、使学生认识摩尔是物质的量的基本单位,了解物质的量与微观粒子之间的关系;了解摩尔质量的概念。
2、了解提出摩尔这一概念的重要性和必要性,懂得阿伏加德罗常数的涵义。
3、使学生了解物质的量、摩尔质量、物质的质量之间的关系。能用于进行简单的化学计算。
过程与方法:初步培养学生演绎推理、归纳推理、逻辑推理和运用化学知识进行计算的能力。
情感目标:通过对概念的透彻理解,培养学生严谨、认真的学习态度,体会定量研究的方法对研究和学习化学的重要作用。
教学方法:启发、诱导、分析、对比、归纳、自学等方法。
教学重点、难点:物质的量及其单位。
教具准备:投影仪
教学过程:
〖复习回顾〗指出C + O2 =CO2指出化学方程式的意义。
C + O2 =CO2
宏观(质量) 12g 32g 44g
微观(粒子数) 1 1 1
〖讲述〗在实验中,我们可以取12gC和32gO2反应,而无法只取1个C原子和1个氧分子反应,
〖过渡〗可称量物质与分子、原子和离子这些微观的看不见的粒子之间有什么联系?能否用一定数目的离子集体为单位来计量它们之间的关系。答案是肯定的。国际科学界建议采用“物质的量”将它们联系的。
一 、物质的量及其单位—摩尔
〖讲解〗物质的量也是与质量、长度一样的物理量是国际单位制中的7个基本物理量之一。符号为n。单位为摩尔,符号为mol。
〖投影〗 国际单位制(SI)的7个基本单位

〖强调〗1、物质的量表示物质所含微粒的多少,这四个字是一个整体,不得简化或增添任何字,是一个专有名词。
2、物质的量只能描述分子、原子、离子、中子、质子等微观粒子,不能描述宏观物质。
3.用摩尔为单位表示某物质的物质的量时,必须指明物质微粒的名称、符号或化学式。如:1 mol H、1 mol H+、 1 mol H2 ,不能用 “1 mol 氢”这样含糊无意义的表示。
4.物质的量的数值可以是整数,也可以是小数。
〖思考〗 1mol到底含有多少个粒子呢?
1 摩尔的标准:1 mol粒子集体所含的粒子数 = 0.012 kg12C中所含的碳原子数
实践体验:已知一个12C原子的质量为1.993×10-26 kg,问 0.012 kg12C中有多少个碳原子?
〖回答〗结果:都是约6.02×1023个。
〖讲述〗大量实验证明,任何粒子或物质的质量以克为单位,在数值上与该粒子的相对原子质量相等时,所含的微粒数目都是约6.02×1023个。
二、阿伏加德罗常数:1 mol 任何粒子的粒子数。
科学上规定为:0.012 Kg 12C 中所含的碳原子数。解释为:如果某物质含有与 0.012 Kg 12C 中所含的碳原子数相同的粒子数,该物质的物质的量为1mol 。
符号: NA 单位: mol-1 数值:约为6.02×1023
注意:不能认为 6.02×1023就是阿伏加德罗常数也不能认为1mol粒子=6.02×1023个
〖练习〗判断正误:(1)摩尔是七个物理量之一。(2)摩尔是物质的质量单位。
(3) 1摩尔大米含有 6.02×1023个米粒。(4)1mol氢
三、物质的量、阿伏加德罗常数与粒子数间的关系
〖提问〗如果知道粒子的物质的量(n)怎样求粒子数(N)
(1)1mol碳原子含有 ( ) 个碳原子
(2)0.3mol硫酸分子含有( )个酸分子
(3)10mol钠离子含有( ) 个钠离子
〖结论〗微粒数目(N)=物质的量(n)×阿伏伽德罗常数( NA )
可推出:n=N/ NA〖设问〗物质的量是联系微观粒子和宏观物质的桥梁,那么如何通过物质的量求出物质的质量呢?也就是说1mol物质的质量到底有多大呢?看图1-11: 1mol不同物质所含的粒子数是相同的,但由于不同粒子的质量不同, 1mol不同物质的质量也不同。
〖实践体验〗我们先填写下面的表格,看是否可以从这些数据中的出有用的结论。
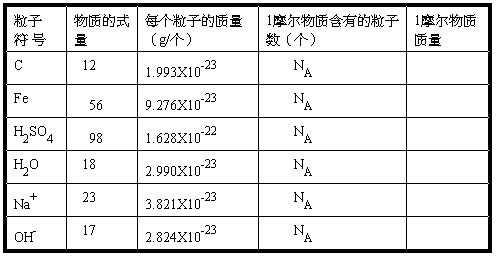
〖结论〗1mol任何粒子的质量在数值上等于这种粒子的式量。
四、摩尔质量:
概念:单位物质的量的物质的质量,符号M
单位:克/摩 符号:g/mol,Kg/mol
数值:等于物质的原子量、分子量、原子团的式量。
〖练习〗
(1)H2SO4的相对分子质量为多少?
(2)H2SO4的摩尔质量是多少?
(3)1molH2SO4 的质量是多少?
〖提问〗根据摩尔质量的定义,摩尔质量、质量、物质的量之间有什么关系呢?
五、物质的质量、物质的量、摩尔质量之间的关系
〖结论〗由M=m/n得n=m/M 或 m=n×M
六、质量、物质的量、摩尔质量、阿伏伽德罗常数、粒子数之间的关系
M× ×NA



 质量 物质的量 粒子数
质量 物质的量 粒子数
(m) ÷M (n) NA ÷ (N)
〖例题〗 49g H2SO4 的物质的量是多少?所含 H2SO4分子的个数是多少?
〖注意〗 规范解题格式
〖小结〗物质的量作为一个桥梁将参加反应肉眼看不到的一定数目的原子、分子和离子等微观粒子的粒子数和宏观可称量的物质的质量联系起来了。
〖作业〗 完成《练习册》第一章第二节第一课时习题
