混合物的化学分离和提纯方法归纳
河北省宣化县第一中学 栾春武
物质的分离是指将混合物中的不同物质分开,而且各物质还要保持原来的化学成分和物理状态;物质的提纯是指将混合物净化除去其杂质,得到混合物中的主体物质,提纯后的杂质不必考虑其化学成分和物理状态。
混合物的分离方法有许多种,但根据其分离的本质可分为两大类,一类是化学分离法,另一类就是物理法,一般情况下,利用物理方法无法分离的混合物,就考虑利用化学方法分离,下面就混合物的化学分离和提纯方法归纳如下:
一、分离和提纯的原则:
1.引入的试剂一般只跟杂质反应。
2.后续的试剂应除去过量的前加的试剂。
3.不能引进新物质。
4.杂质与试剂反应生成的物质易与被提纯物质分离。
5.过程简单,现象明显,纯度要高。
6.尽可能将杂质转化为所需物质。
7.除去多种杂质时要考虑加入试剂的合理顺序。
8.如遇到极易溶于水的气体时,要防止倒吸现象的发生。
二、分离和提纯常用的化学方法:
1.加热法:当混合物中混有热稳定性差的物质时,可直接加热,使热稳定性差的物质分解而分离出去。如NaCl中混有NH4Cl,Na2CO3中混有NaHCO3等均可直接加热除去杂质。
2.沉淀法:在混合物中加入某种试剂,使其中一种以沉淀的形式分离出去的方法。使用该方法一定要注意不能引入新的杂质。若使用多种试剂将溶液中不同微粒逐步沉淀时,应注意后加试剂的过量部分除去,最后加的试剂不引入新的杂质。如加适量的BaCl2溶液可除去NaCl中混有的Na2SO4;再如NaCl溶液中混有MgCl2、CaCl2杂质,可先加入过量的NaOH,使Mg2+转化为Mg(OH)2沉淀而除去(同时引入了OH-杂质);然后加入过量的Na2CO3,使Ca2+转化为CaCO3沉淀而除去(同时引入了CO32-杂质);最后加入足量的盐酸,并加热除去OH-及CO32-(加热的目的是赶走溶液中存在的CO2及HCl),并调节溶液的pH至中性。
3.酸碱法:被提纯的物质不与酸碱反应,而杂质可与酸碱反应,用酸碱作除杂试剂。如用盐酸除去SiO2中的CaCO3,用氢氧化钠溶液除去铁粉中的铝粉等。
4.氧化还原反应法:如果混合物中混有还原性杂质,可加入适当的氧化剂使其被氧化为被提纯物质。如将适量的氯气通入混有FeCl2的FeCl3溶液中,以除去FeCl2杂质;同样如果混合物中混有氧化性杂质,可加入适当的还原剂使其被还原为被提纯物质。如将过量的铁粉加入混有FeCl3的FeCl2溶液中,以除去FeCl3杂质。
5.转化法:不能通过一次达到分离目的的,需要经过多次转化,将其转化成其它物质才能分离,然后再将转化的物质恢复为原物质。如分离Fe3+和Al3+时,可加入过量的NaOH溶液,生成Fe(OH)3和NaAlO2,过滤后,再加入盐酸重新生成 Fe3+和Al3+。在转化的过程中尽量减少被分离物质的损失,而且转化物质要易恢复为原物质。
6.调节pH法:通过加入试剂来调节溶液的pH,使溶液中某组分沉淀而分离的方法。一般是加入相应的难溶或微溶物来调节。如在CuCl2溶液中含有FeCl3杂质,由于FeCl3的水解,溶液是酸性溶液,就可采用调节pH的方法将Fe3+沉淀出去,为此,可向溶液中加入CuO、Cu(OH)2、CuCO3或Cu2(OH)2CO3。
7.电解法:利用电解原理来分离提纯物质,如电解精炼铜,就是将粗铜作阳极,精铜作阴极,用含铜离子的溶液作电解液,在直流电的作用下,粗铜中比铜活泼的杂质金属失去电子,在阴极只有铜离子得到电子析出,从而提纯了铜。
【例题1】除去下列括号内杂质的试剂或方法错误的是
A.HNO3溶液(H2SO4),适量BaCl2溶液,过滤
B.CO2(SO2),酸性KMnO4溶液、浓硫酸,洗气
C.KNO3晶体(NaCl),蒸馏水,结晶
D.C2H5OH(CH3COOH),加足量CaO,蒸馏
解析:此题考查了物质的提纯知识。HNO3溶液中混有H2SO4时,加入氯化钡使得硝酸中又混入了HCl杂质,应加入硝酸钡溶液过滤,A错;SO2有还原性,可悲高锰酸钾氧化为硫酸除去,B对;硝酸钾的溶解度随温度升高变大,但食盐的溶解度随温度变化较小,一般用结晶或重结晶法分离,C错;乙酸具有酸性其能和氧化钙反应,但乙醇不能,故加足量氧化钙蒸馏可以分离两者,D对。
答案:A
点拨:进行物质的提纯操作时要遵循的两个原则是:一是不能将要得到的目标产物除掉,二是不能引入新的杂质,像此题中A选项就是引入了新杂质。
【例题2】下列实验设计和结论相符的是
 A.将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中
A.将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中
 B.某气体能使湿润的红色石蕊试纸变蓝,该气体水溶液一定显碱性
B.某气体能使湿润的红色石蕊试纸变蓝,该气体水溶液一定显碱性
 C.某无色溶液中加Ba(NO3)2溶液,再加入稀盐酸,沉淀不溶解,则原溶液中一定有SO42-
C.某无色溶液中加Ba(NO3)2溶液,再加入稀盐酸,沉淀不溶解,则原溶液中一定有SO42-
 D.在含FeCl2杂质的FeCl3溶液中通足量Cl2后,充分加热,除去过量的Cl2,即可得到较纯净的FeCl3溶液
D.在含FeCl2杂质的FeCl3溶液中通足量Cl2后,充分加热,除去过量的Cl2,即可得到较纯净的FeCl3溶液
解析:乙醇不可以作为萃取剂,A项错;石蕊变蓝,则肯定为碱性,B项正确。若原溶液中含有SO32 -,生成BaSO3,再加入HCl,则与溶液的NO3- 结合,相当于HNO3,则可以氧化BaSO3至BaSO4,沉淀不溶解,C项错;加热时,FeCl3会水解,D项错。
答案:B
【例题3】下列除去杂质的方法正确的是
 A.除去CO2中混有的CO:用澄清石灰水洗气
A.除去CO2中混有的CO:用澄清石灰水洗气
 B.除去BaCO3固体中混有的BaSO4:加过量盐酸后,过滤、洗涤
B.除去BaCO3固体中混有的BaSO4:加过量盐酸后,过滤、洗涤
 C.除去FeCl2溶液中混有的FeCl3:加入过量铁粉,过滤
C.除去FeCl2溶液中混有的FeCl3:加入过量铁粉,过滤
 D.除去Cu粉中混有的CuO:加适量稀硝酸后,过滤、洗涤
D.除去Cu粉中混有的CuO:加适量稀硝酸后,过滤、洗涤
 解析:CO2可以被澄清石灰水吸收,而CO不可以,故A项错。盐酸可以将BaCO3反应除去,而不能溶解BaSO4,故B项错;C项,2FeCl3 + Fe = 3FeCl2,过量的铁过滤,即可除去,正确;Cu和CuO均可以被HNO3溶解,故D项错。
解析:CO2可以被澄清石灰水吸收,而CO不可以,故A项错。盐酸可以将BaCO3反应除去,而不能溶解BaSO4,故B项错;C项,2FeCl3 + Fe = 3FeCl2,过量的铁过滤,即可除去,正确;Cu和CuO均可以被HNO3溶解,故D项错。
 答案:C
答案:C
【例题4】 下列说法正确的是
下列说法正确的是
 A.仅用AgNO3溶液便可鉴别亚硝酸钠和食盐
A.仅用AgNO3溶液便可鉴别亚硝酸钠和食盐
 B.重结晶时,溶液冷却速度越慢得到的晶体颗粒越大
B.重结晶时,溶液冷却速度越慢得到的晶体颗粒越大
 C.乙酸与乙醇的混合溶液可用分液漏斗进行分离
C.乙酸与乙醇的混合溶液可用分液漏斗进行分离
 D.用盐酸标准溶液滴定待测的氢氧化钠溶液时,水洗后的酸式滴定管未经标准润洗,则测定结果偏低
D.用盐酸标准溶液滴定待测的氢氧化钠溶液时,水洗后的酸式滴定管未经标准润洗,则测定结果偏低
解析:A项,还需要用稀HNO3,看沉淀是否溶解,故错;B项,冷却速度慢,则易析出晶体,越慢晶体析出越大,正确。C项,乙醇和乙酸是互溶的,不分层,所以无法用分液法分离,故错;D项,未润洗酸式滴定管,相当稀释了盐酸,所用标准HCl体积增大,则计算出的NaOH浓度偏大,故错。
答案:B
【例题5】下列化学实验事实及其解释都正确的是
 A.向碘水中滴加CCl4,振荡静置后分层,CCl4层呈紫红色,说明可用CCl4从碘水中萃取碘
A.向碘水中滴加CCl4,振荡静置后分层,CCl4层呈紫红色,说明可用CCl4从碘水中萃取碘
 B.向SO2水溶液中滴加盐酸酸化的BaCl2溶液,有白色沉淀生成,说明BaSO3难溶于盐酸
B.向SO2水溶液中滴加盐酸酸化的BaCl2溶液,有白色沉淀生成,说明BaSO3难溶于盐酸
 C.向0.1mol·L-1FeSO4溶液中滴加少量酸性KMnO4溶液,KMnO4溶液褪色,说明Fe2+具有氧化性
C.向0.1mol·L-1FeSO4溶液中滴加少量酸性KMnO4溶液,KMnO4溶液褪色,说明Fe2+具有氧化性
 D. 向2.0mL浓度均为0.1mol·L-1的KCl、KI混合溶液中滴加1~2滴0.01mol·L-1AgNO3 溶液,振荡,沉淀呈黄色,说明AgCl的Ksp比AgI的Ksp大
D. 向2.0mL浓度均为0.1mol·L-1的KCl、KI混合溶液中滴加1~2滴0.01mol·L-1AgNO3 溶液,振荡,沉淀呈黄色,说明AgCl的Ksp比AgI的Ksp大
解析:A项,是高中化学必修1中的一个很重要的实验——萃取实验;B项的叙述是错误的,在该实验中根本得不到白色沉淀,因为亚硫酸不可能制取盐酸;C项只能说明Fe2+具有还原性,因为KMnO4具有强氧化性,常做氧化剂。D项,沉淀呈黄色,说明沉淀是AgI,也就意味着AgCl的Ksp比AgI的大。
答案:A、D w
w
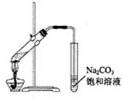 【例题6】下列有关试验操作的叙述正确的是
【例题6】下列有关试验操作的叙述正确的是
 A. 实验室常用左图所示的装置制取少量的乙酸乙酯
A. 实验室常用左图所示的装置制取少量的乙酸乙酯
 B. 用50mL酸式滴定管可准确量取25.00mLKMnO4溶液
B. 用50mL酸式滴定管可准确量取25.00mLKMnO4溶液
 C. 用量筒取5.00mL 1.00mol·L-1盐酸于50mL容量瓶中,加水稀释至刻度,可配制0.100 mol·L-1盐酸
C. 用量筒取5.00mL 1.00mol·L-1盐酸于50mL容量瓶中,加水稀释至刻度,可配制0.100 mol·L-1盐酸
 D. 在苯萃取溴水中的溴,分液时有机层从分液漏斗的下端放出
D. 在苯萃取溴水中的溴,分液时有机层从分液漏斗的下端放出
解析:A项,导气管深入到饱和碳酸钠溶液中去了,这样容易产生倒吸,所以该装置不适合用于制备乙酸乙酯;B项,准确量取一定体积的溶液,用的仪器室滴定管,滴定管有两种:酸式和碱式,具体使用范围是:酸式滴定管不得用于装碱性溶液,因为玻璃的磨口部分易被碱性溶液侵蚀,使塞子无法转动。碱式滴定管不宜于装对橡皮管有侵蚀性的溶液,如碘、高锰酸钾和硝酸银等。所以量取高锰酸钾溶液用酸式滴定管。C项,有两点错误之处,第一点量筒只能精确到小数点后一位,第二点在配制一定物质的量浓度的溶液时,溶解操作应在烧杯内溶解,不允许在容量瓶内溶解。D项,苯的密度比水小,飘在水上面,故有机层应该从上口倒出。
答案:B w
w
【例题7】工业废水中常含有不同类型的污染物,可采用不同的方法处理。以下处理措施和方法正确的是

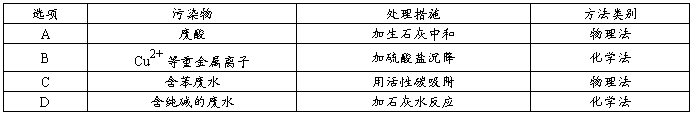
 解析:废酸与碱中和属于化学法,A项错;Cu2+不可能用SO42 -沉降,B项错;活性碳无法吸收苯,C项错;
解析:废酸与碱中和属于化学法,A项错;Cu2+不可能用SO42 -沉降,B项错;活性碳无法吸收苯,C项错;
Na2CO3 + Ca(OH)2 CaCO3↓+ 2NaOH,是复分解法,属于化学法,D项正确。
CaCO3↓+ 2NaOH,是复分解法,属于化学法,D项正确。
 答案:D
答案:D
第二篇:初三化学物质的分离和提纯知识点总结
初三化学物质的分离和提纯知识点总结
化学常用的物质的分离方法是:
1.溶解过滤法:一种物质易溶于水,另一种物质难溶于水,可以将这两种物质的混合物溶于水,然后过滤,就可以分离出这两种物质。
2.冷却热饱和溶液法:根据两种物质的在水中的溶解度有较大的差异。将这两种物质的混合物配制成混合溶液,然后突然降低温度,溶解度较小的那种物质就结晶析出了,因此,就将这两种物质分离出来了。
3.物质溶解特性法(萃取法):两种物质的混合物中,有一种物质不容于有机溶剂,而另一种物质易溶于有机溶剂,且这两种物质都不和有机溶剂反应,可根据这种特性,先将其中的一种物质溶解在这种有机溶剂中,产生分层的现象,然后分离出它们。
4.气体沉淀法:两种物质的混合物中,有一种物质能和其它的物质发生反应,产生沉淀或者是气体,而另一种物质不反应,利用这种性质,将这两种物质分离出来。
物质的分离是把原混合物中各成份一一分开,并恢复原样品。物质的提纯(除杂)就是除去物质中混有的杂质,从而得到纯净的某物质,其基本方法有:
一、 物理方法
1、 过滤法:适用于不溶于液体的固体与液体的分离或提纯。
2、 结晶法:适用于可溶性固体与液体的分离和提纯。具体方法有两种。
① 降温结晶法:适用于溶解度受温度变化影响较大的固态物质的分离或提纯。
② 蒸发结晶法:适用于溶解度受温度变化影响不大固体物质的分离或提纯。
二、 化学方法:
1、 原则:
①“不增、不减、易分”:
不增即最终不能引入新的杂质;
不减是除杂结果不应使所需物质减少;
易分是加入试剂后,使杂质转化为沉淀、气体和水等与所需物质易于分离。
②先除杂后干燥。
2、 方法:(以下括号里的均为杂质)
① 吸收法:如一氧化碳混有二氧化碳可用氢氧化钠等碱性溶液吸收;
② 沉淀法:如氯化钾中混有氯化镁可加氢氧化钾溶液,再过滤;
③ 溶解法:如铜中混有氧化铜可加入过量的盐酸,再过滤;
④ 转化法:如铜中混有锌可加硫酸铜溶液再过滤;
⑤ 气化法:如氯化钠中混有碳酸钠可加入过量盐酸,再蒸发结晶;
⑥ 加热法:如氧化钙中混有碳酸钙可高温灼烧;
⑦ 综合法:当含有多种成分的杂质时,分离提纯往往不仅仅使用一种方法,而是几种方法交替使用。
三、知识解析:物质的分离与除杂(提纯)从内容上看,它包含着常见酸、碱、盐及其他重要物质的性质及特殊化学反应的知识;从过程上看,它是一个原理确定、试剂选择与实验方案确定、操作实施的过程。其考查点和趋势是:
1、 考查物质的分离和提纯原理。根据除杂质的原则,自选或从题给试剂中选出除杂试剂。判断题给试剂的正误等。
2、 考查物质提纯的实验设计。根据物质分离和提纯的原则设计正确的实验方案。
3、 考查评价物质分离和提纯的实验方案。对题给试、步骤、操作、效果等进行评价、比较,从中选出最佳方案。
4、 除去混合物中杂质,不仅要考虑反应原理正确可行,而且要考虑实际操作简便易行,同时还要注意实验的安全性和药品、能源的节约等其它问题。
