新版GSP认证过程--经验大分享
一、新版GSP与旧版相比,是理念的变化,考验企业员工素质的高低。强调所有部门参与。
二、提问三类人员:
1、首次会议结束后,对企业负责人提问。
2、检查过程中,对照制度、对照计算机流程,对各岗位人员提问。
3、对财务的提问
需要注意的事项:加强全员培训,熟悉操作流程,检查组查看各岗位人员的计算机上机操作。
三、GSP认证检查过程:检查三天。
第1天,首次会议结束后,企业负责人介绍企业情况,提问企业方针目标的内容,提问相关制度,提问内审的内容;
信息部介绍计算机模块功能;
体系文件结合计算机逐个提问,对采购、收货、验收等岗位的提问,看现场操作,提问各岗位职责。
第2天,现场检查,冷链设备检查,抽查5-6个品种。
检查冷链验证、温湿度自动校验、
检查方针目标的分解、检查风险评估、检查电子监管预警的处理。
第3天,继续第二天检查内容,检查组内部讨论,评审缺陷条款;下午末次会议总结。
四、现场问询内容:
1、收货员提问,如何获取承运信息,如何收货
2、采购:新版增加的采购内容
3、运输人员:冷链操作过程、提问冷链制度
五、新版GSP认证实施过程中的注意事项:
1、修订完善质量管理体系文件,岗位实际操作与制订的操作流程不符,为缺项。体系文件与企业实际相符。体系文件制订的制度应涵盖企业整个经营过程。如印章管理、人事薪酬制度、采购#5@p管理、预付款管理、采购合同管理等。
2、制订岗位操作流程,结合计算机系统制订,与现场的操作一致。如70条质量制度,30 1
条非质量制度,60个操作流程。各岗位应有相关的制度。
3、岗位职责 32个岗位。应有所有人员的岗位职责,如企业有采购内勤,采购助理、采购
员等采购人员,应设以上岗位的职责。
4、单列体外验收制度,疫苗验收制度。涉及许可经营范围的,应设相应制度。如终止妊娠
制度、含麻制度、蛋肽制度、精神药品制度。严禁做一套,写一套。
5、查岗位计算机权限,随机抽查某岗位,系统界面有无无关的权限、模块出现。该岗位人
员应熟悉计算机操作。质管部对各部门负责人的培训,各部门负责人应加强本部门员工的培
训。
6、计算机系统,检查1天。
(1)检查内容:核对系统功能是否齐全,管控点是否有效,与企业介绍的功能模块是否吻合。
(2)检查各岗位的操作要点,各岗位管控点;
(3)提问岗位人员遇到质量问题时,在计算机系统上的操作流程。系统75项整改。
(4)严禁外挂式功能,用报表代替系统应有的功能。
(5)收货员操作界面,应有物流的承运信息,如在途时间、承运时间。承运信息由采购订单
传递到收货员界面。
(6)冷链品种的收货时间控制、温湿度控制。
(7)信息部介绍、演示系统的基础数据,如品种分类,管控点的范围包括上下游经营范围控
制,委托书时效,质保协议时效、资质时效,系统具备药品过期的拦截功能,提示功能。
(8)采购订单界面,承运信息:承运方式,承运单位、发运地点、在途时限、启动时间、运
输方式。收货员勾兑采购订单,核实承运信息。
(9)体系文件的操作流程应与计算机流程相符。
(10)基础数据,包括品种信息、供应商信息,质管部负责录入、更新。
(11)经营数据的修改,应作风险评估,修改在质管 部监督下进行。
(12)岗位操作权限设置,由质管部授权,离职、新增人员,进入系统应重新授权。根据岗位
授权设置相应的权限,如收货员无分配货位号的权限(验收员权限),关闭与收货员岗位无
关的查询模块。
7、温湿度监控系统的布点。质量负责人、质管部、仓储负责人需了解布点方案、布点的要
求、设备的校验。
(1)了解校验报告、校验方案。
2
(2)一般情况下,温湿度系统不与ERP对接。
(3)冷链药品的验证。验证报告,验证实施时间应与图表时间一致。对验证过程的拍照取证。验证项目按类别进行,完成一个项目后再进行另一个项目的验证,不能穿叉进行。 冷链数据偏差纠正。
冷藏车厢内划线,限高堆放。
开门作业的时间限制。应有开门作业的说明流程
8、方针目标的分解。包括分解项目、内容、措施、实施人员、实施时间。
比如,项目:基础数据管理,质量目标:准确率百分百。采取措施:首营企业信息录入后核对百分百,及时更新百分百。
比如经营数据修改的合法性百分百,采取措施:数据修改作风险评估率100%,数据修改的审核率百分百,修改的监督率百分百。
9、风险评估。各个部门寻找风险点,质管部汇总。评估方式可以用文字形式评估,或报表形式。评估内容应包括评估项目、评估要求、潜在的风险,风险后果,风险严重性,风险原因,控制预防风险的措施、责任人。
举例:计算机管控的风险,系统设计的功能不全面,对某个环节管控失效。原因分析:人员不了解新版的要求、系统功能设计未经相关部门审核、审核人不熟悉系统。
10、内审。按企业制度的规定要求进行。比如体系文件修改进行专项内审、场所变更专项内审、ERP升级专项内审、经营范围增加专项内审。以上各项内容变更,变更时间在两个月内的,可集中统一内审;变更时间跨度大于半年以上的,应分别进行专项内审。
11、进货评审。评审时间,按季度进行动态评审。比如业务例会,质管部应参与,提出质量上的评审意见,或对例会进行综合的评审。评审方式:会议纪要方式。动态评审区别于年度进货评审,仅针对某个方面存在的问题进行评审。
12、销售评审。按季度进行动态评审。
13、人员要求:设收货岗位、验收岗位,养护员可兼职。
14、温控系统要有运行2个月以上的数据,待系统稳定运行后,申报GSP认证。避免由于系统不稳定引起的故障。
15、门禁安装,不建议用探头进行事后管理,应采取门卫、门禁系统等事前控制。
16、首营品种,索取生产批件,包装标签说明书不作要求,药典有收载的质量标准,不需收集,品种资料盖质管部印章。
17、首营企业,加盖公章。收集印章留样,电子扫描存档;收货员核对备案资料,核对随货 3
凭证的印章,验收员核对随货单样式。
六、GSP认证现场检查工作程序
(一)在检查员到达的当天,企业必须向检查员提供以下材料(每个检查员各一套):
1、企业申请GSP认证申请材料
2、企业质量管理文件(含质量管理制度、工作程序、岗位 职责)
3、企业所有从业人员花名册
*花名册的人员按部门顺序依次排列
*花名册的内容包括姓名、性别、出生年月、职务(位)、职称、工作岗位、学历、所学专业、从事本岗位工作时间
*包含正式员工和聘用的员工。
(二)认证现场检查工作的第一天,召开首次会议。
首次会议参会人员:
*检查员
*企业所在地市药品监督管理局派出的观察员
*企业领导班子所有成员
*企业中层以上部门的负责人及分支机构负责人
首次会议内容是:
1、检查组与公司代表会面,介绍检查员及观察员,宣读认证检查通知;
2、企业主要负责人介绍企业参会人员,公司简要汇报药品GSP实施情况(控制在15分钟之内);
3、检查组宣读GSP认证现场检查方案、认证检查纪律和注意事项
(三)检查组对企业总部及被抽查的分支机构(或连锁药店)进行现场检查。
现场检查的内容是:
1、硬件设施;办公场所、营业场所、库区环境、库房条件、设施设备及辅助、办公用房情况;药品的库存管理及出入库现场管理;
4
2、文件资料:管理文件、档案资料、证明文件、原始记录(在认证检查企业的各种制度、凭证和记录等材料时,企业应将各种文件材料集中到一个场所,并按检查员的分工情况派相关人员协助检查。检查员要求企业提供的材料应在30分钟之内提供,否则,不予认可。)
3、过程控制:抽查药品、工作过程、操作方法、资料核实。
4、机构人员:部门设置、人员配备 企业档案 *员工档案:人事、教育、健康
*客户档案:供货方、购货方
*药品档案:药品质量、药品养护
*设备档案
*质量资料档案:原始记录、票据凭证、工作文件 认证检查的方法是:观察、提问、取证、验证、记录 。
(四)现场检查工作完成后,检查组汇总检查情况,做出综合评定,填写检查报告、不合格项目情况表、缺陷项目记录表和检查评定表,此间,观察员及企业的所有人员回避。
(五)检查组完成检查报告后,召开末次会议。 末次会议参会人员:与首次会议相同。 末次会议内容:
1、检查组组长宣读认证检查报告、企业不合格项目、提出建议,责成市药品监督管理局监督整改,并要求:
⑴通过现场检查的企业在认证结束后7个工作日内,将整改报告报局GSP认证中心,同时抄报所在地市药品监督管理局;
⑵限期整改的企业,在接到整改通知后的3个月内向自治区药品监督管理局和认证中心报送整改报告,提出复查申请;
⑶不通过现场检查的企业,在接到通知的6个月后,重新申请GSP认证;
2、企业法定代表人或质量负责人讲话;
3、企业所在地市药品监督管理局观察员讲话。
(六)GSP认证现场检查工作结束。
现场检查的有关注意事项:
1、现场检查中避免的做法
*竭力渲染企业的“优秀”做法,搪塞差的和不足之处;
5
*不接收任何批评,固执已见,轻视检查人员意见;
*尽可能少说话,不回答问题;
*一问三不知,不清楚之处用方言搪塞;
*高谈阔论,纠缠问题拖延时间;
*对问题百般辩解,拒不承认。
2、其他事宜
*接待准备工作(包括接待人员、住宿、车辆和就餐安排等);
*明确首次会议及末次会议参加人员;
*确定检查路线;
*现场检查陪同人员;
*检查软件时总体协调人及各部门联络员;
*企业提交申报材料后如有需要变更或补充说明的事项,在认证检查结束前交检查组。 *在GSP认证检查过程中,不允许被检查企业之外的任何单位和个人参与认证检查或认证观摩,我局派出的观摩员和被检查企业所市药监局派出的观察员除外。
*要积极配合检查员开展认证检查工作,不得妨碍或阻挠认证工作。
*在认证检查过程中,所有人员都应在岗。
七、GSP认证管理程序
1、市级药监局受理初审(10个工作日)
2、省级药监局审查(25个工作日、3个工作日)
3、认证中心审查,并制定现场检查方案(15个工作日)
4、现场检查(一般为3个工作日)
5、认证中心审核检查报告(10个工作日)
6、省级药监局审查,并作出结论(15个工作日)
7、媒体公示10天
8、省级药监局颁发《药品经营质量管理规范认证证书》
9、公布名单
10、跟踪检查(获证书后的24个月之内)
6
八、GSP认证现场检查的主要依据:
1、《GSP认证现场检查工作程序》
2、《GSP认证现场检查评定标准》
3、《GSP认证现场检查评定项目》
九、现场检查结果
1、合格
2、不合格
3、限期整改(3个月之内)
4、中止认证检查 (指在认证检查过程中,发现企业有违法经营行为的)
7
第二篇:GSP认证指南
一、 法律依据
1、《药品管理法》
2、《药品管理法实施条例》
3、《药品经营质量管理规范》(国家食品药品监督管理局令第9号)
二、申办条件
1、申请人应依法取得《药品经营许可证》、《营业执照》,且是属于以下情形之一的药品经营企业: ①具有企业法人资格的药品经营企业;
②非专营药品的企业法人下属的药品经营企业;
③不具有企业法人资格且无上级主管单位的药品经营实体。
2、企业经过内部评审基本符合《药品经营质量管理规范》及其实施细则规定的条件和要求;
3、在申请GSP认证前12个月内企业没有因违法违规经营造成的经销假劣药品问题;
4、新开办的药品经营企业,自取得《药品经营许可证》之日起30日内申请GSP认证。
三、受理时间
周一至周五
四、申请材料
1、《药品经营质量管理规范认证申请书》(由所在地市局对经营假劣药品情况进行核查认定并加盖市局公章);
2、《药品经营许可证》副本和《营业执照》复印件;
3、实施GSP情况的自查报告;
4、企业负责人和质量管理人员情况表,药品验收、养护人员情况表;
5、经营设施、设备情况表;
6、企业所属药品经营单位(法人企业除外)情况表;
7、药品经营质量管理文件系统目录;
8、企业管理组织机构、质量机构的设置与职能框图;
9、经营场所平面布局图;
10、企业非违法违规经销假劣药品问题的说明;
11、承诺书;
12、 申办人身份证复印件;法定代表人委托书;
注:1.申请材料用A4纸打印,制作封面和目录,按以上顺序排列,装订成册,并加盖企业公章。
五、办理程序
1、申请。申请人向所在地市食品药品监督管理局窗口提交认证申请[《药品经营质量管理规范认证申请书》(零售)]和其他申请材料。
2、受理。5个工作日内完成申请材料受理审查。符合要求的,予以受理,出具受理通知书;不符合要求的,出具不予受理(补正材料)通知书。
3、审查。按照《药品经营质量管理规范》、《辽宁省药品经营质量管理规范认证现场检查工作程序》等有关规定进行审查,组织现场检查。需要补充资料的,申请人应在规定限期内报送需要补充或说明的资料,逾期未说明或资料仍不符合要求的予以退审。(药品零售连锁企业认证抽查门店的比例为:门店数量小于或等于30家的,按20%抽查,但不得小于3家;大于30家的,按10%抽查,但不得小于6家)
现场检查合格的企业,通过媒体向社会公示10天。
4、决定。根据现场检查结论和公示结果,作出认证是否合格或限期整改的决定。认证合格的核发《药品经营质量管理规范认证证书》,在辖区内公告;认证不合格的,作出限期整改或认证不合格的决定,说明理由书面通知申请人。
5、许可文本制作及送达。省局受理办制作、送达《药品经营质量管理规范认证证书》。
六、审批、送达时限:
审批时限:自申请受理至作出是否同意发给《药品经营质量管理规范认证证书》决定日止3个月。 送达时限:《药品经营质量管理规范认证证书》自同意核发的决定作出之日起,10日内送达。
七、收费标准:
收费依据:辽价发[2006]3号
收费标准:
1、有分支机构的批发或零售连锁企业,受理申请费标准为每个企业300元,审核费标准为每个企业12000元(含一个分支机构),每增加一个分支机构加收1200元;
2、无分支机构的批发或大型零售企业,受理申请费标准为每个企业200元,审核费标准为每个企业10000元;
3、中型零售企业,受理申请费标准为每个企业100元,审核费标准为每个企业5000元;
4、小型零售企业,受理申请费标准为每个企业100元,审核费标准:城市(含县城)每个企业3000元,乡镇以下每个企业2000元。
八、受理机构
市食品药品监督管理局窗口
九、办事咨询:
市局受理窗口电话:6618586 市场监督处电话:2826860
附:《药品经营质量管理规范认证申请书》
零售 受理编号:
药品经营质量管理规范认证申请书
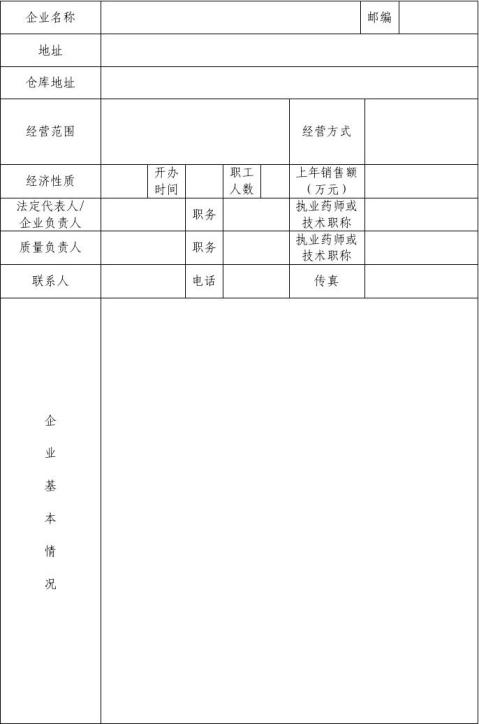
申请单位: (公章)
填报日期: 年 月 日
受理日期: 年 月 日
辽宁省食品药品监督管理局制
填 报 说 明
1、内容填写应准确、完整,不得涂改和复印。
2、报送认证申请书及其他申报情况表时,按有关栏目填写执业药师或专业技术职称和学历的情况,应附有执业药师注册证书或专业技术职称证书和学历证书的复印件。
3、认证申请书以及其他申报资料,应统一使用A4型纸张,标明目录及页码并装订成册。
GSP认证申报资料审查表
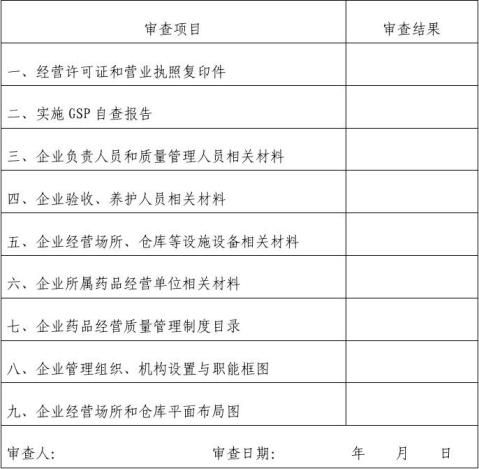
注:本表由审查机关根据审查结果填写。“审查结果”栏根据实际情况填写“合格”或“合理缺项”字样。
GSP认证受理审批表
受理编号:

