第四章 非金属及其化合物
 【内容结构】
【内容结构】
【知识要点】
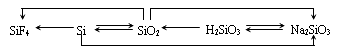
一、硅及其化合物的相互转化
二、氯及其化合物的相互转化

 三、硫及其化合物的相互转化
三、硫及其化合物的相互转化

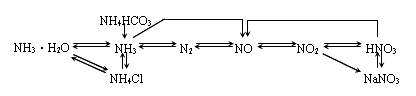
四、氮及其化合物的相互转化
二、本章知识结构梳理
(一) 硅及其化合物
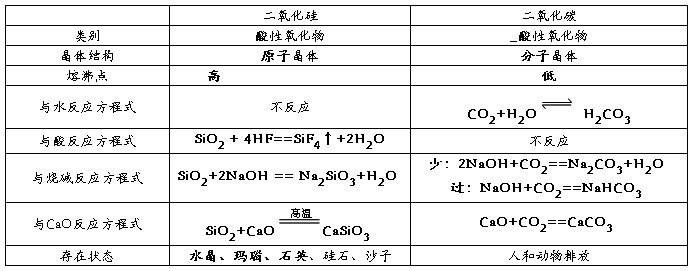
1、二氧化硅和二氧化碳比较
2、硅以及硅的化合物的用途

(二) 氯
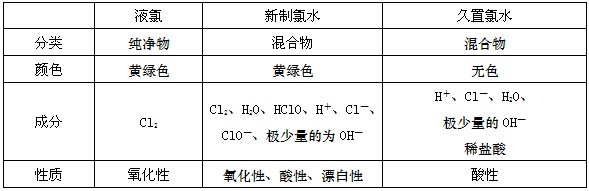
1、液氯、新制的氯水和久置的氯水比较

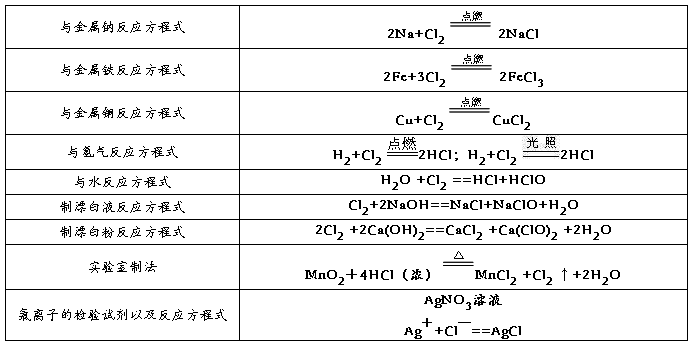
2、氯气的性质
(三) 硫、氮
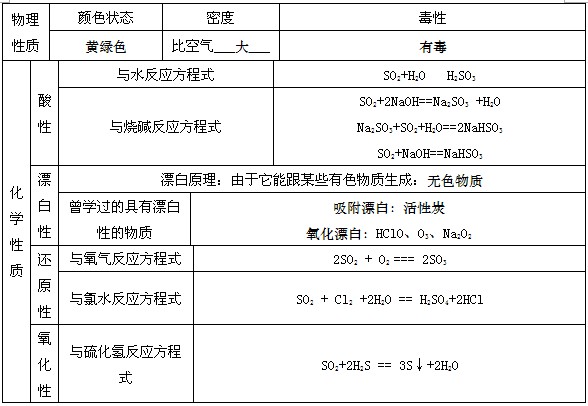
1、二氧化硫的性质

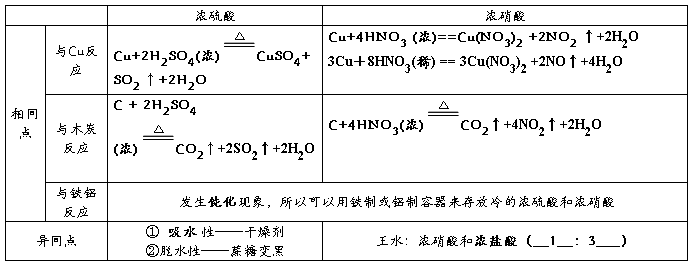
2、浓硫酸和浓硝酸的性质
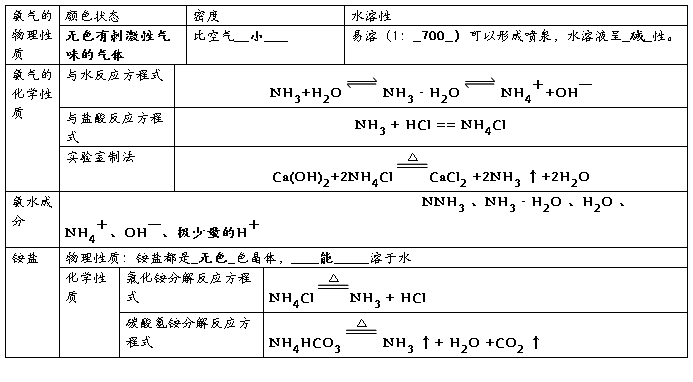
3、氨气、氨水与铵盐的性质
高中化学必修一第四章 非金属及其化合物
二氧化硅
1结构:二氧化硅晶体是由氧原子和硅原子构成的,在二氧化硅晶体中无二氧化硅晶体。在晶体中每个硅原子与四个氧原子结合,每个氧原子与两个硅原子结合,向空间网状结构,即二氧化硅晶体由硅原子和氧原子按1:2的比例组成的空间网状结构晶体
2物理性质:二氧化硅具有硬度大、熔点高、不溶于水、不导电等性质,纯净的二氧化硅晶体无色透明
3化学性质:
① 二氧化硅是酸性氧化物,能与碱和碱性氧化物反应,
如:
② 弱氧化性:
③ 特性二氧化硅是酸性氧化物,却能与氢氟酸发生反应:
4用途:制备高性能通讯材料光导纤维;制备石英玻璃、石英钟;制造电子工业中的重要部件、光学仪器、精密仪器、轴承、耐磨器皿;装饰品
硅酸:硅酸是一种弱酸,比碳酸还弱,切难溶于水。通过复分解反应制的硅酸形成胶体溶液,进一步形成凝胶,硅酸凝胶经干燥脱水可形成常用作干燥剂的“硅胶”
硅酸的制备:
硅酸盐
1硅酸盐是由硅、氧和金属组成的化合物的总称。硅酸盐是一类结构复杂的物质,一般都不溶于水。化学性质稳定,是地壳岩石的主要成分
2最简单最常用的硅酸盐是硅酸钠,其水溶液熟称水玻璃,其化学性质稳定,不能燃烧,不易被腐蚀,热稳定性强,有粘性。可用作建筑材料、纸张粘合剂,木材织物的防腐剂、防火剂
3硅酸盐由于组成比较复杂,通常用二氧化硅和金属氧化物的形式表示其组成。如:Na2SiO3→Na2O.SiO2
氯气
氯气通常状况下呈黄绿色,是一种具有强烈刺激性气味的有毒气体,化学性质活泼,具有较强的氧化性
1氯气与金属反应(除金、铂外)
① 产生黄色的火焰和大量白烟
② 产生大量棕色气体
③ 产生大量棕色的烟
2氯气与氢气反应
方程式:
氢气在氯气中燃烧,发出苍白火焰。氢气燃烧结束后,抽去盖在集气瓶口处的毛玻璃片,及其瓶口处有白雾
3氯气和水反应
氯气的水溶液叫氯水。氯气与水反应生成盐酸和次氯酸,氯气既是氧化剂又是还原剂
方程式:
① 氯水的成分:三分子(水分子,氯气、次氯酸分子)四离子(氢离子、氯离子、次氯酸根离子、少量氢氧根离子)
② 颜色:新制的饱和的氯水呈浅黄绿色
③ 因含有盐酸和次氯酸而成酸性,但主要是由于盐酸
④ 沉淀性:与银离子反应生成沉淀
⑤ 强氧化性因含有次氯酸和氯气而呈强氧化性,但氧化性主要由次氯酸决定,氯气的强氧化性决定它具有漂白性
⑥ 不稳定性:由于次氯酸:
4氯气与碱反应:
方程式:
① 吸收多余的氯气用氢氧化钠
② 漂白粉的有效成分是次氯酸钙
5氯气与某些还原性物质的反应
氯气具有强氧化性,可与二氧化硫,亚硫酸根,硫离子、溴离子、碘离子、亚铁离子等具有还原性的微粒发生氧化还原反应
6氯气的用途:自来水杀菌;制造盐酸;制造漂白剂;合成塑料、橡胶、人造纤维;农药、燃料、药品。
氯气的实验室制法
方程式:
制得的气体含有盐酸和水,因此分别通过饱和食盐水、浓硫酸(氯化钙)等进行除杂。气体用向上排空气法或排饱和食盐水法收集。尾气用氢氧化钠吸收。
卤素
1卤素包括氟氯溴碘
2卤素均具有强氧化性,并且氟>氯>溴>碘>爱
3化学性质:
① 与金属反应:卤素都能与金属反应生成金属卤化物
② 都与氢气反应生成对应的酸
③ 与水反应:
④ 与碱反应:
二氧化硫:
1物理性质:无色、有刺激性气味的有毒气体,密度比空气大,易于液化
2化学性质:
① 与水反应生成显酸性的物质,具有漂白作用,但漂白后新物质不稳定,受热易恢复原色
② 常见的能被二氧化硫漂白的物质有:品红溶液、白纸浆、毛、丝、草帽辫。但二氧化硫不能漂白酸碱指示剂
③ 二氧化硫的氧化性和还原性
与氧气反应: 与氯气反应:
与溴反应: 与碘反应:
与硫化氢反应:
亚硫酸根与氯气反应:
亚硫酸与氯气反应:
亚硫酸根与氧气反应:
亚硫酸与氧气反应:
氮的重要氧化物NO和NO2
1 一氧化氮:无色无味气体,不溶于水,易被氧气氧化,方程式:
(反应现象:无色气体变成红棕色有刺激性气味的气体),有毒,能与血红蛋白结合2二氧化氮:红棕色气体,有刺激性气味,有毒,刺激呼吸器官导致呼吸道、肺部病变,浓度大时引起死亡
化学性质:
与水反应方程式:
雷雨发庄稼的化学原理:
氨
1物理性质:无色有刺激性气味气体,密度较小,极易溶于水,易液化
2化学性质:
① 与水反应:
② 与氯化氢反应:
3氨的实验室制备
方程式:
收集方法:向下排空气法 尾气处理:用稀硫酸吸收
验满方法:用湿润的红色石蕊试纸检验:试纸变蓝;用浓盐酸检验:产生大量白烟
干燥方法:碱石灰干燥
氨的用途:肥料、化工合成、制冷剂
铵盐
1物理性质:晶体,易溶于水
2化学性质:
① 受热易分解:
氯化铵分解: 碳酸铵分解:
碳酸氢铵分解:
硝酸铵分解:
② 铵盐与碱反应:(铵盐的特征反应)
硫酸铵与氢氧化钠反应:
硝酸铵与氢氧化钠反应:
硝酸
1硝酸与金属铜反应
铜与稀硝酸反应:
铜与浓硝酸反应:
硝酸是一种强氧化剂,几乎能与所有金属反应(金、铂)除外,但是与铝、铁在冷的浓硝酸中会发生钝化现象。浓度越大,氧化性越大。一旦沾在皮肤上,用小苏打水或肥皂水洗涤
2硝酸与非金属反应
硝酸与碳反应:
硫酸
1浓硫酸的物理性质
纯净的硫酸是无色粘稠油状液体,沸点较高,不易挥发,密度大于水,溶于水时放出大量的热
2浓硫酸的三大特性:吸水性、脱水性、强氧化性
① 浓硫酸的吸水性:由于浓硫酸有吸水性常可以作为干燥剂,但是浓硫酸不能干燥碱性气体,氨,还原性气体,如:硫化氢、溴化氢、碘化氢
② 浓硫酸的脱水性:脱水性是化学变化
③ 浓硫酸的氧化性:
a浓硫酸具有很强的氧化性,可以把还原性很弱的银氧化,但遇到铝、铁发生钝化
b在做氧化剂时一般会还原为二氧化硫
浓硫酸与碳反应:
第二篇:【人教版】高中化学必修1知识点总结:第四章非金属及其化合物
第四章 非金属及其化合物
课标要求
1.了解氯、氮、硫、硅等非金属及其重要化合物的主要性质
2.认识其在生产中的应用和对生态环境的影响。
要点精讲
一、本章知识结构框架

二、本章知识结构梳理
(一)硅及其化合物
1、二氧化硅和二氧化碳比较

2、硅以及硅的化合物的用途

(二)氯
1、液氯、新制的氯水和久置的氯水比较
2、氯气的性质

(三)硫、氮
1、二氧化硫的性质
硫
硫黄晶体色黄, 火山口处有埋藏。
二硫化碳去溶解,扔在河中水底淌。
无色有毒味刺激,易溶于水易液化。
二氧化硫
此气无色有毒性,容易液化坏环境。
与水与氧或漂白,反应都可逆进行。
2、浓硫酸和浓硝酸的性质
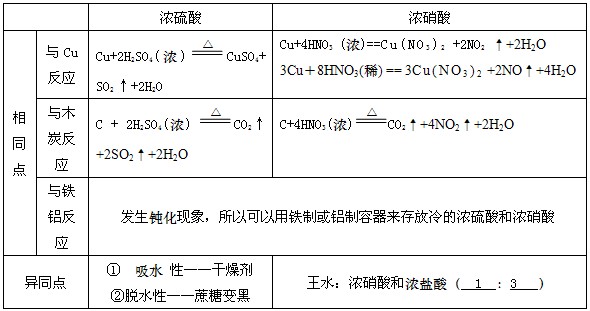
浓硫酸
硫酸稳定沸点高,制酸试剂多奇招。
加热与铜碳反应,强氧化性本领高。
硫酸吸水又脱水,干燥剂中大英豪。
碱性气体需回避,还原物质逃不掉。
硝酸
挥发分解都容易,金属反应无氢气。
能把碳硫来氧化,常温铁铝做容器。
3、氨气、氨水与铵盐的性质

氮气
性质稳定空气中,特殊条件也作用。
放电氧化续二度,有水硝酸也生成,
氨
气轻味臭易液化,液氨气化温骤下。
铵盐与碱共制取,混合一起把热加。
易溶于水成喷泉,氨成氨水弱碱显。
靠近盐酸白烟起,可制氮肥酸式盐。
