学好高中化学的三大心得
关键词
学习兴趣 ; 一念一图二性二法三表四式五方程六理论 ;
重视化学实验
摘要:笔者认为高中化学应采取以下几点做法:1、培养学习兴趣。2、对一念一图二性二法三表四式五方程六理论的掌握。3、须重视化学实验。
本人在高中化学教学一线任教多年,就高中生怎样学好高中化学积累了一些经验,现将自己的心得提出,以飨读者。仅供同行参考,亦希望对学生有所帮助。
心得一、 培养学习兴趣
我国古代教育学家孔子曾经说过:”知之者不如好之者,好之者不如乐之者"。 兴趣是最好的老师,那么如何培养学习兴趣呢?
1、明确学习目的
今天的努力学习固然是在高考中要取得好成绩,鲤跃龙门,实现父母的期望和自己的梦想,但亦需要广大莘莘学子用自己所学的科学文化知识报效祖国,为中国梦的实现尽一份责任。我国制碱的先驱者—侯德榜,留学海外,毕业后会到祖国,面对外国的技术封锁,克服了各种,终于在塘沽碱厂生产出洁白纯碱,并荣获美国费城万国博览会金奖。这一成就令世人刮目相看,为新中国的建设做出了巨大贡献。他永远是莘莘学子们学习的榜样。
2、领略学习带来的喜悦
当我们对化学新的知识熟练掌握后,会有收获般的喜悦感,这样越学越有兴趣,越学越有信心,天长日久,学习就变成了一种乐事,而不再是一种负担和包袱,一种苦差事。
3、正确对待学习的内容。
需要掌握学习的内容有易有难。遇到容易的题的时候,不要骄傲;遇到难题的时候也不要气馁。只要我们持之以恒,一切问题都会迎刃而解。
心得二、一念一图二性二法三表四式五方程六理论
一概念
化学中基本概念一定要准确掌握,否则很容易错误理解我们所研究的物质。比如电解质是在水溶液中或在熔融状态下就能够导电的化合物。它的研究对象是化合物,如果记忆为电解质是在水溶液中或在熔融状态下就能够导电的物质。则会将铁、铜、盐酸等归类为电解质。又比如酚的通式为ROH,是指芳香烃中苯环上的氢原子被羟 基取代所生成的化合物,意思是苯环和羟基直接相连,如果只根据通式为ROH,很容易将 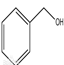 归为酚类物质。
归为酚类物质。
一图
掌握物质间的转化关系图,是我们认识物质的化学性质和物质间的衍变关系以及在高考中做好推断题的基础。例如在钠元素单质及化合物关系图中


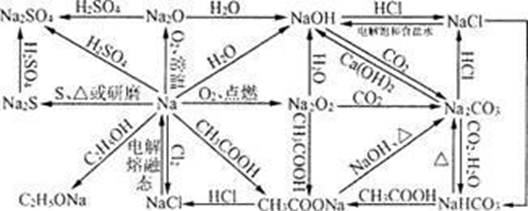
以下重要的方程式必须掌握
2Na + O2 Na2O2(淡黄色)
Na2O2(淡黄色)
2Na +2H2O == 2NaOH + H2↑
Na2O +H2O == 2NaOH
2Na2O2+2H2O ==4NaOH + O2↑
2NaOH +CO2 == Na2CO3 + H2O
Na2CO3 + HCl == NaCl + NaHCO3
Na2CO3 + 2HCl == 2NaCl + H2O+ CO2↑
2NaHCO3 (足量)+ Ca(OH)2 == 2H2O + CaCO3 ↓+ Na2CO3
NaHCO3 (不足量)+ Ca(OH)2 == H2O + CaCO3↓+ NaOH
NaHCO3 + NaOH == Na2CO3 + H2O
Na2CO3 + H2O + CO2 == 2NaHCO3
二性质
性质分为物理性质和化学性质,它是我们认识物质的基础,有关知识贯穿整个化学学科,是学好化学的基础。物质的物理性质如:颜色、气味、状态、解溶性和有无毒性五大特性。在观察、闻取、识记的基础上必须掌握。然后了解其是否易融化、凝固、升华、挥发等。化学性质是物质在化学变化中表现出来的性质。如所属物质类别的化学通性:酸性、碱性、氧化性、还原性、热稳定性及一些其它特性。最好理解其结构,然后在实验的基础上必须掌握,特别是它参与的重要化学反应的方程式及其条件.
二法
代表物的工业制法和实验室制法必须掌握,它是理论和实际生产的纽带,涉及了重要的化学反应原理和理论,如氨气的工业制法,就是高考考查的重点。
三表
1、物质(酸、碱、盐)的溶解性表
掌握物质的溶解性是正确书写化学和离子方程式以及解决离子共存问题的基础,为了便于记忆,总结口诀如下
酸不溶硅与原硅酸 碱中只溶钾钠钡氨
钾钠硝铵盐均可溶,盐酸盐不溶氯化银,
硫酸盐不溶钡和铅,碳硅磷硫和亚硫盐,
它们只溶钾钠铵。
同时掌握四种微溶物:Ca(OH)2 CaSO4 Ag2SO4 MgCO3
微溶物在反应物中,强调其澄清的一面,则拆分成离子。在产物中,强调其浑浊的一面,则保留为化学式。
2、金属活动性顺序表
金属活动性顺序既是规律性的知识,又是必备的工具性的知识
按钾 钙 钠 镁 铝 锌 铁 锡 铅 氢 铜 汞 银 铂 金的变化顺序:金属失电子能力减弱,单质的还原性减弱,其对应阳离子的氧化性增强。
3、元素周期表
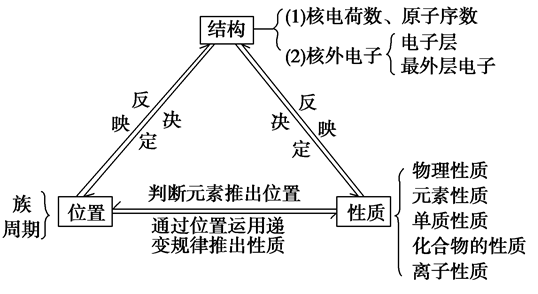
(1) 电子层数=周期数。
(2) 质子数=原子序数。
(3) 最外层电子数=主族序数。
(4) 主族元素的最高正价=族序数,负价=主族序数-8。
(5) 同主族元素的原子半径越大,失电子越易,还原性越强,金属性越强,形成的最高价氧化物对应水化物的碱性越强,其离子的氧化性越弱。
(6) 同周期中原子半径越小,得电子越易,氧化性越强,非金属性越强,形成的气态氢化物越稳定,形成最高价氧化物对应水化物的酸性越强,其离子的还原性越弱。
在掌握位构性相关知识的同时,应注意以下几点:
最外层电子数大于或等于3而又小于8的元素一定是主族元素;最外层电子数为1或2的元素可能是主族、副族或0族(He)元素;最外层电子数为8的元素是稀有气体元素(He例外)。
在周期表中,元素的原子序数差别因周期表结构出现以下两种情况:
(1)同主族,相邻周期元素原子序数之差的判断。
①第ⅠA、ⅡA族元素,相差上一周期元素所在周期
所含元素的种数。②第ⅢA~ⅦA族元素,相差下一周期元素所在周期含有的元素的种数。
(2)同周期相邻主族元素原子序数之差的判断。
①ⅠA、ⅡA元素或ⅢA~ⅦA相邻元素相差1。②ⅡA、ⅢA元素:若为第二或第三周期相差1,若为第四或第五周期相差11,若为第六或第七周期相差25。
例1.X、Y、Z和W代表原子序数依次增加的四种短周期元素,在周期表中,Z与Y相邻,Z与W也相邻,Y、Z和W三种元素的原子最外层电子数之和为17,X能分别与Y、Z形成电子总数相等的分子A、B。下列有关判断正确的是( )
A.Y与W的非金属性均比磷元素弱
B.原子半径由大到小的顺序为:W>Z>Y
C.化合物B中含有的化学键均为非极性共价键
D.X的单质是一种有广阔前景的新能源
解析:本题考查的是元素周期表中位构性知识,难度中等。由题意这四种元素分别为H,C,O,F(或Cl),则AB分别为CH4和H2O,由此可以判断D正确。答案:D
四式
掌握物质四式:分子式、结构式、结构简式、电子式,特别是有机物的代表物的正确书写。
五方程
正确书写化学方程式、离子方程式、电离方程式、电极方程式、热化学方程式。否则根基不稳,一切都是徒劳的。正确书写方程式的方法 1.抓住反应规律 2.联系实验现象.3.理解反应原理。
六理论
1、质量守恒定律
参加化学反应的物质的质量总和等于反应后生成的物质的质量总和。其实质是化学反应前后元素的种类和原子的个数不发生改变。它不仅是化学反应配平的基础,有时在计算中直接应用质量守恒定律将十分方便。如
例2 有一在空气里暴露过的KOH固体样品,经分析其含水7.65%,含K2CO3 4.32%。其余是KOH。若将ag样品放入b mL 1mol/L的盐酸中,使其充分作用后,多余酸用25.25mL c mol/L的KOH溶液恰好中和完全。蒸发所得溶液,得到固体质量的表达式中(单位g)( )
A.只含有a B.只含有b C.可能含有b D.一定有a、b和c
[解析] 本题如使用Cl原子守恒的方法可大大简化解题步骤。由题意,反应后溶液为KCl溶液,其中的Cl-来自盐酸,所以所得KCl固体的物质的量与HCl的物质的量相等,即为0.001bmol,质量为0.0745bg。 正确答案为:C。
2、阿伏加德罗定律
在同温同压下,同体积的气体含有相同的分子数。这类题的解法:
①状况条件:考查气体时经常给非标准状况如常温常压下,1.01×105Pa、25℃时等。
②物质状态:考查气体摩尔体积时,常用在标准状况下非气态的物质来迷惑考生,如H2O、SO3、已烷、辛烷、CHCl3等。
③物质结构和晶体结构:考查一定物质的量的物质中含有多少微粒(分子、原子、电子、质子、中子等)时常涉及稀有气体He、Ne等为单原子组成和胶体粒子;晶体结构:P4、金刚石、石墨、二氧化硅等结构。
例3下列说法正确的是(NA表示阿伏加德罗常数) ( )
⑴常温常压下,1mol氮气含有NA个氮分子
⑵标准状况下,以任意比例混合的甲烷和丙烷混合气体22.4L,所含的气体的分子数约为NA个
⑶标准状况下,22.4LNO和11.2L氧气混合,气体的分子总数约为1.5NA个
⑷将NO2和N2O4分子共NA个,降温至标准状况下,其体积为22.4L
⑸常温下,18g重水所含中子数为10NA个
⑹常温常压下,1mol氦气含有的核外电子数为4NA
⑺常温常压下,任何金属和酸反应,若生成2g 氢气,则有2NA电子发生转移
⑻标准状况下,1L辛烷完全燃烧后,所生成气态产物的分子数为
⑼31g白磷分子中,含有的共价单键数目是NA个
⑽1L1 mol?L-1的氯化铁溶液中铁离子的数目为NA
【点拨】⑴正确,1mol氮气的分子数与是否标准状况无关。
⑵正确,任意比例混合的甲烷和丙烷混合气体 22.4L,气体的总物质的量为1mol,因此含有NA个分子。
⑶不正确,因为NO和氧气一接触就会立即反应生成二氧化氮。
⑷不正确,因为存在以下平衡:2NO2 N2O4(放热),降温,平衡正向移动,分子数少于1mol,标准状况下,其体积小于22.4L
N2O4(放热),降温,平衡正向移动,分子数少于1mol,标准状况下,其体积小于22.4L
⑸不正确,重水分子(D2O)中含有10个中子,相对分子质量为 20,18g重水所含中子数为:10×18g/20g· mol-1=9mol。
⑹正确,1个氦原子核外有4个电子,氦气是单原子分子,所以1mol氦气含有4mol电子,这与外界温度和压强无关。
⑺正确,不论在任何条件下,2g氢气都是1mol,无论什么金属生成氢气的反应均可表示为:2H++2e=H2↑,因此,生成1mol氢气一定转移 2mol电子。
⑻不正确,标准状况下,辛烷是液体,不能使用标准状况下气体的摩尔体积22.4L/mol这一量,所以1L辛烷的物质的量不是1/22.4mol。
⑼不正确,白磷分子的分子式为P4,其摩尔质量为124g/mol,31g白磷相当于0.25mol,
白磷的分子结构为正四面体,一个白磷分子中含有6个P-P共价键,所以,0.25mol白磷中含有1.5NA个P-P共价键。
⑽不正确,Fe3+在溶液中水解。
本题答案为⑴⑵⑹⑺
3、氧化还原理论
关键是要掌握基本概念
升失氧,降得还。若问剂,两相反。什么剂,什么性。化合价升高失去电子的反应为氧化反应,化合价降低得到电子的反应为还原反应。物质发生氧化反应的为还原剂,对应产物为氧化产物。发生还原反应的为氧化剂。对应产物为还原产物。氧化剂具有氧化性,还原剂具有还原性。在掌握概念的基础上比较氧化性、还原性的强弱。
高价氧,低价还,中间价态两头转。
物质中元素具有最高价,该元素只有氧化性;物质中元素具有最低价,该元素只有还原性;物质中元素具有中间价,该元素既有氧化性又有还原性。对于同一种元素,价态越高,其氧化性就越强;价态越低,其还原性就越强。
例4已知反应:
①Cl2+2KBr = 2KCl+Br2,
②KClO3+6HCl = 3Cl2+KCl+3H2O,
③2KBrO3+Cl2=Br2+2KClO3,下列说法正确的是 ( )
A.上述三个反应都有单质生成,所以都是置换反应
B.氧化性由强到弱顺序为KBrO3>KClO3>Cl2>Br2
C.反应②中还原剂与氧化剂的物质的量之比为6∶1
D.③中1 mol还原剂反应则氧化剂得到电子的物质的量为2 mol
解析 该题主要考查氧化还原反应的规律、氧化剂和还原剂的判断、对化学计量数的理解以及得失电子守恒的简单应用。
4、勒夏特列原理(平衡移动原理)
如果改变影响平衡的一个条件,平衡就会向着减弱这种改变的方向移动。“减弱”“改变”不是“消除”,更不能使之“逆转”。例如,当原平衡体系中气体压强为P时,若其它条件不变,将体系压强增大到2P,当达到新的平衡时,体系压强不会减弱至P甚至小于P,而将介于P~2P之间。
5、盖斯定律
不管化学反应是一步完成或分几步完成,其反应热是相同的。换句话说,化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。这就是盖斯定律。
盖斯定律的应用价值在于可以根据已准确测定的反应热来求知实验难测或根本无法测定的反应热,可以利用已知的反应热计算未知的反应热。
6、电化学理论
原电池是由正负极组成,负极失电子,发生氧化反应,(负对氧)。正极得电子,发生还原反应(正对还)。所以在外电路,电子是负极流向正极,在电解液中,阳离子流向正极,阴离子流向负极,从而构成闭合电路。
电解池是由阴阳极组成,有外接电源,阴极得电子,发生还原反应(阴获还)。阳极失电子,发生氧化反应,(氧失阳)。在外电路中,电子由阳极流向阴极。在电解液中,阳离子流向阴极,阴离子流向阳极,从而构成闭合电路。
心得三、重视化学实验
化学实验不但能培养学生观察、思维、动手等能力,还能加深对相关知识的认识和理解,所以必须重视化学实验。平时做实验,要多问几个为什么,思考如何做,为什么要这样做,还可以怎样做,从而达到“知其然,也知其所以然”的目的。化学实验题按其知识点主要分为:常用化学仪器和实验基本操作;物质的制备、分离、提纯、检验;实验设计和综合实验。如综合实验思维过程:原理→反应物→仪器装置→现象→结论→作用意义→联想。如:①实验是根据什么性质和原理?实验目的是什么?②所用反应物名称、状态、代替物(据实验目的和相关的化学反应原理,进行全面分析比较和推理,并合理选择)。③有关装置:性能、使用方法、适用范围、注意问题、是否有替代装置可使用、仪器规格。④有关操作:技能、操作顺序、注意事项或操作错误的后果。⑤实验现象:自下而上,自左至右全面观察。⑥实验结论:直接结论,导出结论。
以上心得是自己认为怎样学好高中化学的一些浅见,请大家多多包涵并指正。
参考文献 王爽 对化学学科中研究性学习的几点思考[J];化学教与学;20##年06期
第二篇:如何学好高中化学[1]
如何学好高中化学

