1、理想气体反应的等温方程:D rGm = D rGmq +RTlnJp
其中:压力商 Jp=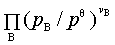
注意:对于多相反应,通常只考虑气相组分,固相或液相的活度近似认为为1。
2、DrGmq = -RT ln Kq
3、化学反应方向判据:
Jp < Kq 时,反应正向进行
Jp > Kq 时,反应逆向进行
Jp = Kq 时,反应达到平衡
4、温度一定时,DrGmq和Kq都是常数。化学反应中各物质均处于标准态时,Jp= 1, DrGm = DrGmq,化学反应达到平衡时,Jp = Kq, DrGm = 0。
5、温度对化学平衡常数的影响:
DrHmq为常数时, ln(K2q / K1q) = -(D rHmq /R)(1/T2 - 1/T1)
6.平衡常数的计算的四种方法:
(1)由D rGmq计算:Kq=exp(-D rGmq /RT)
(2)由平衡组成计算:Kq=JP(平衡)
(3)由相关反应的平衡常数进行计算
(4)由Kq(T1)计算Kq(T2):利用等压方程。
7、化学平衡的移动
增加反应物浓度(或分压),Jp减少,Kq不变,反应平衡正向移动
增加生成物浓度(或分压),Jp增大,Kq不变,反应平衡逆向移动
以气体分子数减少的反应为例:
(1)增大压力,Jp减少,Kq不变,反应平衡正向移动
(2)在总压不变的情况下充入惰性气体,相当于系统的分压降低,Jp增大,Kq不变,反应平衡逆向移动
(3)在体积不变的情况下充入惰性气体,对反应平衡无影响。
以放热反应为例(DrHmq<0):
升高温度:Jp不变,Kq减小,反应平衡逆向移动
8、分解温度:
该温度时,产生的所有气体的总压等于环境压力
9、转化率的概念
10、计算题解题方法示例:
aA(s) + bB(g) = yY(g) + zZ(g)
 始: n
1 mol n
2 mol 0 mol
始: n
1 mol n
2 mol 0 mol
平衡: n1-b mol n2+y mol z mol
平衡分压: (n1-b)*p/n (n2+y)*p/n zp/n
将平衡分压代到Jp的表达式:
[(n2+y)*p/n/p?]y[zp/n/p?]z
[(n1-b)*p/n/p?]b
令K? = Jpeq
注意:只计气体!
第二篇:化学平衡图像总结
化学平衡图像
一.化学平衡图象常见类型
注意:(1)首先要看清楚横轴和纵轴意义(特别是纵轴。表示转化率和表示反应物的百分含量情况就完全相反)以及曲线本身属等温线还是等压线。(当有多余曲线及两个以上条件时,要注意“定一议二”)
(2)找出曲线上的特殊点,并理解其含义。(如“先拐先平数值大”)
(3)根据纵轴随横轴的变化情况,判定曲线正确走势,以淘汰错误的选项。
1、速率—时间图
 此类图象定性地揭示了v正、v逆随时间(含条件改变对速率的影响)而变化的规律,体现了平衡的“动、等、定、变”的基本特征,以及平衡移动的方向.
此类图象定性地揭示了v正、v逆随时间(含条件改变对速率的影响)而变化的规律,体现了平衡的“动、等、定、变”的基本特征,以及平衡移动的方向.
例1:对达到平衡状态的可逆反应X+Y Z+W,在其他条件不变的情况下,增大压强,反应速率变化图象如图1所示,则图象中关于X、Y、Z、W四种物质的聚集状态为( )
Z+W,在其他条件不变的情况下,增大压强,反应速率变化图象如图1所示,则图象中关于X、Y、Z、W四种物质的聚集状态为( )
A.Z、W均为气体,X、Y中有一种是气
B.Z、W中有一种是气体,X、Y皆非气体
C.X、Y、Z、W皆非气体
D.X、Y均为气体,Z、W中有一种为气体
专练1:A(g)+3B(g)  2C(g)+Q(Q>0)达到平衡,改变下列条件,正反应速率始终增大,直达到新平衡的是( )
2C(g)+Q(Q>0)达到平衡,改变下列条件,正反应速率始终增大,直达到新平衡的是( )
A.升温 B.加压 C.增大c(A) D.降低c(C) E.降低c(A)
2、浓度—时间图
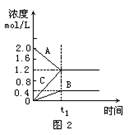 此类图象能说明各平衡体系组分(或某一成分)在反应过程中的变化情况.解题时要注意各物质曲线的折点(达平衡时刻)。
此类图象能说明各平衡体系组分(或某一成分)在反应过程中的变化情况.解题时要注意各物质曲线的折点(达平衡时刻)。
例2:图2表示800℃时A、B、C三种气体物质的浓度随时间
的变化情况,t1是到达平衡状态的时间.试回答:
(1)该反应的反应物是______;
(2)反应物的转化率是______;
(3)该反应的化学方程式为______.
3、含量—时间—温度(压强)图
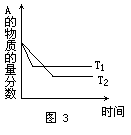 例3:同压、不同温度下的反应:A(g)+B(g)
例3:同压、不同温度下的反应:A(g)+B(g) C(g);△HA的含量和温度的关系如图3所示,下列结论正确的是 ( )
C(g);△HA的含量和温度的关系如图3所示,下列结论正确的是 ( )
A.T1>T2,△H>0 B.T1<T2,△H>0 C.T1>T2,△H<0 D.T1<T2,△H<0
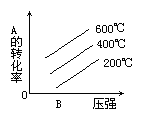
专练3:现有可逆反应A(g)+2B(g) nC(g);△H<0,在相同温度、不同压强时,A的转化率跟反应时间(t)的关系如图4,其中结论正确的是()
nC(g);△H<0,在相同温度、不同压强时,A的转化率跟反应时间(t)的关系如图4,其中结论正确的是()
A.p1>p2,n>3 B.p1<p2,n>3
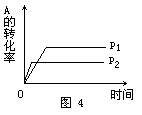 C.p1<p2,n<3 D.p1>p2,n=3
C.p1<p2,n<3 D.p1>p2,n=3
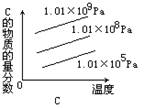
4、恒压(温)线
该类图象的纵坐标为物质的平衡浓度或反应物的转化率,横坐标为温度或压强.
例4:对于反应2A(g)+B(g) 2C(g);△H<0,下列图象正确的是 ( )
2C(g);△H<0,下列图象正确的是 ( )


例5:速率—温度(压强)图
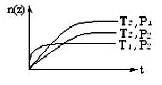 11.反应2X(气)+Y(气)
11.反应2X(气)+Y(气)  2Z(气)(正反应为放热反应),在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量[n(z)]与反应时间(t)的关系如图所示。下列判断正确的是( )
2Z(气)(正反应为放热反应),在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量[n(z)]与反应时间(t)的关系如图所示。下列判断正确的是( )
A.T1<T2,P1<P2 B.T1<T2,P1>P2
C.T1>T2,P1>P2 D.T1>T2,P1<P2
小结:
一看轴(纵、横坐标的意义);
二看线(线的走向和变化趋势);
三看点(起点、折点、交点、终点、零点的意义);
四看要不要作辅助线(等温线、等压线、平衡线);
五看量的变化(如浓度变化、温度变化等);
六想规律(外界条件对反应速率的影响规律和化学平衡移动规律);
七作判断,做出答案。
