第二章化学反应速率和化学平衡
一、可逆反应
⑴定义:在同一条件下,同时向正逆两个方向进行的化学反应。
⑵可逆反应中所谓的正反应、逆反应是相对的,一般把向右进行的反应叫做正反应,向左进行的反应叫做逆反应。
⑶在不同条件下能向两个方向进行的反应不叫可逆反应。
⑷可逆反应不能进行到底,在一定条件下只能进行到一定程度后达到平衡状态。
二、化学反应的限度
⑴化学反应的限度就是研究可逆反应在一定条件下所能达到的最大限度。
⑵反应的转化率
反应物的转化率:α=
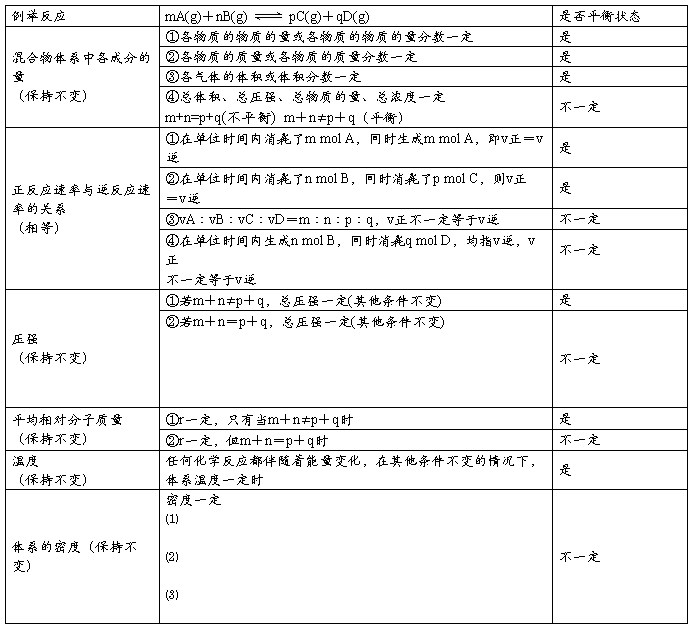
三、化学平衡
⑴化学平衡状态:在一定条件下,当可逆反应的正、逆反应速率相等时,体系中各种物质的含量(物质的量、浓度、体积分数、质量分数等)保持恒定的状态。
①化学平衡的微观标志(即本质):v正=v逆
②化学平衡的宏观标志:反应混合物中各组分的浓度和体积分数保持不变。
⑵化学平衡的特征
①逆:化学平衡研究的对象是可逆反应。
②动:化学平衡是动态平衡,反应处于平衡态时,化学反应仍在进行,反应并没有停止。
③等:化学反应处于化学平衡状态时,正反应速率等于逆反应速率,且都不等于零。④定:化学反应处于化学平衡状态时,反应混合物中各组分的浓度保持一定,体积分数保持一定。对反应物,有一定的转化率,对生成物,有一定的产率。
⑤变:化学平衡是有条件的平衡,当外界条件变化,原有的化学平衡被破坏,在新的条件下,平衡发生移动,最终又会建立新的化学平衡。
⑥同:可逆反应无论从正反应开始,还是从逆反应开始,或正、逆反应同时开始,都能达到化学平衡。
四、判断可逆反应达到平衡的标志
1、直接标志
⑴v正=v逆。
具体可以是:①A、B、C、D中任一种在单位时间内的生成个数等于反应掉的个数。
②单位时间内生成m mol A(或n molB),同时生成p molC(或q molD)。
⑵各物质的质量或物质的量不再改变。
⑶各物质的百分含量(物质的量分数、体积分数、质量分数)不再改变。
⑷各物质的浓度不再改变。
2、间接标志
⑴若某一反应物或生成物有颜色,颜色稳定不变。
⑵当m+n≠p+q时,恒容下总压强不再改变。(m+n=p+q时,总压强不能作为判断依据)
特别提醒:
①化学平衡的实质是v(正)=v(逆)≠0时,表现为平衡体系中各组分的物质的量或物质的量分数不再变化,因此v(正)=v(逆)>0是化学平衡判断的充要条件。
②运用v(正)=v(逆)≠0时,注意方向和数量关系。
③学会“变”与“不变”判断。“变”就是到达平衡过程中量“变”,而到达平衡后“不变”。否则,不一定平衡。
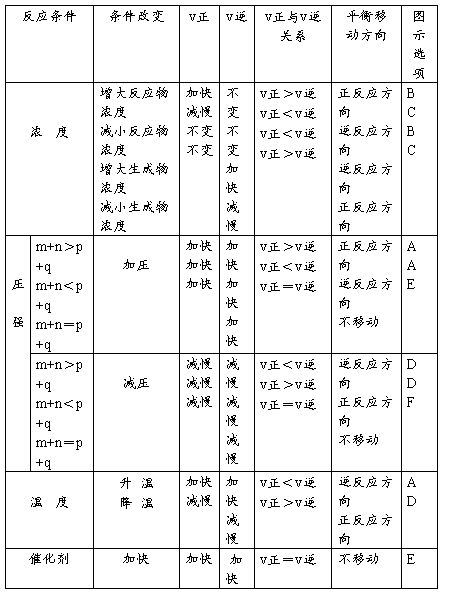
五、平衡移动
(一)对于可逆反应:mA(g) + nB(g)  pc(g) + qD(g) (正反应放热)
pc(g) + qD(g) (正反应放热)
【总结】
1)增大反应物浓度或减小生成物浓度,化学平衡向正反应方向移动;减小反应物浓度或增大生成物浓度,化学平衡向逆反应方向移动。
2)增大压强,化学平衡向系数减小的方向移动;减小压强,平衡会向系数增大的方向移动。
3)升高温度,平衡向着吸热反应的方向移动;降低温度,平衡向放热反应的方向移动。
4)催化剂不改变平衡移动
(二)勒夏特列原理(平衡移动原理)
如果改变影响平衡的一个条件,平衡就会向着减弱这种改变的方向移动。具体地说就是:增大浓度,平衡就会向着浓度减小的方向移动;减小浓度,平衡就会向着浓度增大的方向移动。增大压强,平衡就会向着压强减小的方向移动;减小压强,平衡就会向着压强增大的方向移动。升高温度,平衡就会向着吸热反应的方向移动;降低温度,平衡就会向着放热反应的方向移动。平衡移动原理对所有的动态平衡都适用,如对后面将要学习的电离平衡,水解平衡也适用。
六、有关化学平衡的计算
1、主要类型有:①求起始浓度、转化浓度、平衡浓度。
②求某反应物的转化率、平衡气体混合物中各成分的体积分数等。
2、化学平衡的计算模式—三段式法
设a(mol·L-1)、b(mol·L-1)分别为A、B两物质的起始浓度,mx(mol·L-1)为反应物A的转化浓度,nx(mol·L-1)为反应物B的转化浓度,则
mA(g) + nB(g)  pC(g) + qD(g)
pC(g) + qD(g)
c始(mol·L-1) a b 0 0
Δc(mol·L-1) mx nx px qx
C平(mol·L-1)a-mx b-nx px qx
物质浓度的变化关系
反应物:平衡浓度=起始浓度-转化浓度
生成物:平衡浓度=起始浓度+转化浓度
以上三种浓度中,只有转化浓度之比等于化学方程式中计量数之比
七、化学平衡常数
1.概念:对于一定条件下的可逆反应(aA+bB cC+dD),达到化学平衡时,生成物浓度的乘幂的乘积与反应物浓度的乘幂的乘积之比为一常数,记作Kc,称为化学平衡常数(浓度平衡常数)。
cC+dD),达到化学平衡时,生成物浓度的乘幂的乘积与反应物浓度的乘幂的乘积之比为一常数,记作Kc,称为化学平衡常数(浓度平衡常数)。
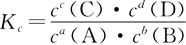

2.平衡常数的意义
平衡常数的大小反映了化学反应进行的程度(也叫反应的限度)。
(1)K值越大,表示反应进行得越完全,反应物转化率越大。
【一般认为,K>105时,该反应进行得就基本完全了。】
(2)K值越小,表示反应进行得越不完全,反应物转化率越小。
3.注意事项
(1)化学平衡常数只与温度有关,与反应物或生成物的浓度无关。
(2)化学平衡常数是指某一具体反应的平衡常数。若反应方向改变,则平衡常数改变。
若方程式中各物质的系数等倍扩大或缩小,尽管是同一反应,平衡常数也会改变。
(3)在平衡常数表达式中:反应物或生成物中固体、纯液体、稀溶液中水的浓度不写。
C(s)+H2O(g)  CO(g)+H2(g),K=c(CO)·c(H2)/c(H2O)
CO(g)+H2(g),K=c(CO)·c(H2)/c(H2O)
FeO(s)+CO(g)  Fe(s)+CO2(g),K=c(CO2)/c(CO)
Fe(s)+CO2(g),K=c(CO2)/c(CO)
7.化学反应进行的方向

第二篇:九年级化学第三章知识点总结
第三单元 物质构成的奥秘
第一节 分子和原子
一、 分子和原子的异同

二、 验证分子运动的探究实验
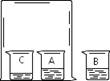 【实验操作】如右图,取适量的酚酞溶液,分别倒入A、B两个小烧杯中,另取一个小烧杯C,加入约5mL浓氨水。用一个大烧杯罩住A、C两个小烧杯,烧杯B置于大烧杯外。观察现象。
【实验操作】如右图,取适量的酚酞溶液,分别倒入A、B两个小烧杯中,另取一个小烧杯C,加入约5mL浓氨水。用一个大烧杯罩住A、C两个小烧杯,烧杯B置于大烧杯外。观察现象。
【实验现象】烧杯A中的酚酞溶液由上至下逐渐变红。
【实验结论】分子是不断运动的。
【注意事项】浓氨水显碱性,能使酚酞溶液变红。浓氨水具有挥发性,能挥发出氨气。
三、 从微观角度解释问题
1. 用分子观点解释由分子构成的物质的物理变化和化学变化
物理变化:没有新分子生成的变化。(水蒸发时水分子的间隔变大,但水分子本身没有变化,故为物理变化)
化学变化:分子本身发生变化,有新分子生成的变化。(电解水时水分子变成了新物质的分子,故为化学变化)
2. 纯净物和混合物(由分子构成的物质)的区别:纯净物由同种分子构成,混合物由不同种分子构成。
3. 分子和原子的联系:分子是由原子构成的,同种原子结合成单质分子,不同种原子结合成化合物分子。
4. 分子和原子的本质区别:在化学变化中,分子可以再分,而原子不能再分。
5. 化学变化的实质:在化学变化过程中,分子裂变成原子,原子重新组合,形成新物质的分子。
第二节 原子的结构
1. 原子的构成
原子一般是由质子、中子和电子构成,有的原子不一定有中子,质子数也不一定等于中子数。
原子的种类由核电荷数(质子数)决定。
2. 构成原子的各种粒子间的关系
在原子中,原子序数=核电荷数=核内质子数=核外电子数。
由于原子核所带的正电荷与核外电子所带的负电荷的电量相等,电性相反,所以原子整体不显电性。
3. 相对原子质量
以一种碳原子(碳12)质量的1/12(1.66×10-27kg)为标准,其他原子的质量跟它相比较所得到的比,作为这种原子的相对原子质量,符号为Ar。相对原子质量是通过比较得出的比值,单位为“1”。
原子中质子和中子的质量接近碳原子质量的1/12,而电子的质量约为质子质量的1/1836,可以忽略不计,所以原子的质量集中在原子核上,即相对原子质量≈质子数+中子数
第三节 元素
1. 定义:元素就是具有相同电荷数(即核内电子数)的一类原子的总称。
元素与原子的区别和联系:

2. 元素之最
地壳中含量(质量分数)排在前五位的元素:氧、硅、铝、铁、钙
地壳中含量最多的金属元素:铝
地壳中含量最多的非金属元素:氧
生物细胞中含量最多的元素:氧
人体中含量最多的金属元素:钙
3. 元素的分类:金属元素、非金属元素、稀有气体元素
4. 元素符号:元素用元素符号表示。元素符号是用元素拉丁文名称的第一个字母表示的,如果第一个字母相同,则再附加一个小写字母加以区别。
5. 元素符号的意义:元素符号不仅表示一种元素,还表示这种元素的一个原子。如果物质由原子构成,元素符号还可以表示一种物质。
如果元素符号前加上系数,就只表示该原子的个数,只具有微观意义。
如:H表示氢元素、1个氢原子。2H表示2个氢原子。Cu表示铜元素、一个铜原子、金属铜。
6. 描述物质宏观组成和微观构成:
① 宏观组成(描述物质的组成时用元素叙述):铁是由铁元素组成的。二氧化碳是由碳元素、氧元素组成的。
② 微观构成(描述物质的构成时用分子、原子、离子叙述)铁是由铁原子构成的。二氧化碳是由二氧化碳分子构成的。
(描述分子的构成时用原子叙述)1个二氧化碳分子是由1个碳原子和2个氧原子构成的。
7. 元素周期表:元素周期表的每一横行叫做一个周期,共7个周期;每一纵行叫做一个族,共16个族。
周期的变化规律:从左到右,原子序数由少变多。除第一周期以外,每一周期都是以金属元素开始,逐渐过渡到非金属元素,最后以稀有气体元素结束,从左到右金属性逐渐减弱。
同一周期元素的原子的电子层数相等。
8. 核外电子的排布
在含有很多电子的原子里,电子的能量并不相同,能量高的通常在离核较远的区域运动,能量低的电子通常在离核较近的区域运动,就像分了层一样。这样的运动,我们称为分层运动或分层排布。
现在发现的元素,原子核外电子最少的有1层,最多的有7层。电子层序数越大,层内电子的能量越大,离原子核距离越远。
规律:① 核外电子总是尽先排在能量最低的电子层里,第一层排满才能排第二层,第二层排满才能排第三层。
② 每个电子层最多能容纳2n2个电子(n为层序数,第一层n=1,第二层n=2)。
③ 最外层电子数不超过8个(第一层为最外层时,不超过2个)。
9. 原子结构示意图:一个氯原子的原子结构示意图如下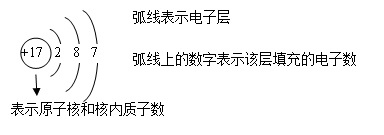
10. 元素的种类
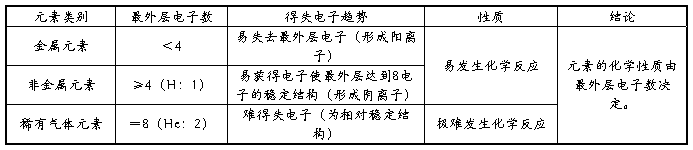
① 金属元素:原子的最外层电子数一般少于4个(是不稳定结构),在化学变化中易失去最外层电子,而使次外层成为最外层,形成稳定结构。这种性质叫做金属性。
② 非金属元素:原子的最外层电子数一般多于或等于4个(是不稳定结构),在化学变化中易获得电子,而使最外层达到8电子的稳定结构。这种性质叫做非金属性。
③ 稀有气体元素:原子的最外层有8个电子(He为2个),为相对稳定结构。
11. 离子的形成:带电的原子或原子团叫做离子。
在化学反应中,金属元素原子失去最外层电子,非金属元素原子得到电子,从而使参加反应的原子带上电荷。
带电荷的原子叫做离子。带正电荷的原子叫做阳离子,带负电荷的原子叫做阴离子。
阴、阳离子由于静电作用互相吸引,结合形成稳定的、不带电性的化合物。
12. 离子内质子数不等于核外电子数,离子的最外层电子一般是8(氢是0)个电子的稳定结构。
原子通过得失电子变成离子,离子也可以通过得失电子变回原子。
13. 离子符号
离子用离子符号表示:在原子团或元素符号的右上角标出离子所带的电荷的多少及电荷的正负(数字在前,符号在后),当离子所带电荷数为1时,1可以不写。如Na+(钠离子)、Ca2+(钙离子)、H+(氢离子)、Cl-(氯离子)、O2-(氧离子)、OH-(氢氧根离子)等。
离子符号表示的意义:Mg2+表示1个镁离子带2个单位的负电荷。2O2-表示2个氧离子。
离子符号只有微观含义,没有宏观含义。
14. 一定带正电的粒子:质子、原子核、阳离子
一定带负电的粒子:电子、阴离子
不带电的粒子有:中子、原子、分子
15. 物质与其构成粒子之间的关系:
① 原子直接构成物质。如汞、金刚石直接由原子构成。
② 金属元素原子和非金属元素原子分别形成阳离子和阴离子。如氯化钠是由氯离子和钠离子构成的。
③ 非金属元素离子和非金属元素离子各提供电子形成共用电子对,结合成分子。如氧气是由氧分子构成的。
