分子结构与性质
共价键:原子间通过共用电子对形成的化学键。

极性键和非极性键判别规律:
极性键:正电中心和负电中心不重合;
非极性键:正电中心和负电中心重合;
分子极性与非极性判别:
极性:中心原子最外层电子未全部成键;
非极性:中心原子最外层电子全部成键;
氢键:氢键是由已经与电负性很强的原子(如N、F、O)形成共价键的氢原子与另一个分子中或同一分子中电负性很强的原子之间的作用力。
氢键对物质性质的影响
(1)当形成氢键时,物质的熔、沸点将升高。
(2)氢键不属于化学键;
σ键、π键判别规律:
1.共价单键全部都是σ键;
2.共价双键中一个是σ键,一个是π键;
3.共价三键中一个是σ键,两个是π键;
价层电子对互斥理论:
价层电子对数目=(中心原子的价电子数+配位原子提供的电子数)/2
a、如果是离子团,离子的价电子对数应考虑离子所带的电荷:
(1) 负离子的价电子数=中心原子的价电子数+所带的负电子数;
(2) 正离子的价电子数=中心原子的价电子数-所带的正电荷数;
b、如果成键原子是配位原子,与中心原子之间的化学键是单键时,配位原子提供的价电子数是1,如H、卤素原子;双键时,配位原子提供的价电子数为0,如氧原子,三键时,配位原子提供的原子为-1,如乙炔。双键、三键都当做一个配位原子。
c、σ键电子对数:由分子式确定。如H2O、NH3、CH4分子中的中心原子O、N、C分别含有2、3、4对σ键电子对。
d、中心原子上的孤对电子数:为 ,式中a为中心原子的价电子数(主族元素的价电子数就是最外层电子数);x为与中心原子结合的原子数;b为与中心原子结合的原子最多能接受的电子数(氢为1,其他原子等于“8-该原子的价电子数”)
,式中a为中心原子的价电子数(主族元素的价电子数就是最外层电子数);x为与中心原子结合的原子数;b为与中心原子结合的原子最多能接受的电子数(氢为1,其他原子等于“8-该原子的价电子数”)
分子构型

杂化类型判断:无机化合物
价层电子对数为2时,sp杂化;
价层电子对数为3时,sp2杂化;
价层电子对数为4时,sp3杂化;
有机化合物:碳原子与几个原子相连,两个为sp杂化,三个为sp2杂化,四个为sp3杂化。
配合物:由提供的孤对电子的配体与接受孤对电子的中心离子或原子以配位键结合而成的化合物。
配位键:孤电子对由一个原子单方面提供、而另一个原子提供空轨道而形成的化学键。
配合物的组成
等电子体:原子总数相等、价电子总数相等的分子。例:CO和N2。
晶体结构与性质
1.晶体的基本类型与性质
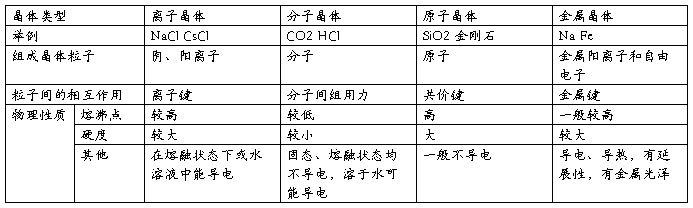
2.根据晶体的结构确定晶体的化学式
晶胞:描述晶体结构的基本单元。
化学式:只表示每个晶胞中各类原子的最简整数比。
晶胞中粒子数目的计算:均摊法
(1)某个粒子为n个晶胞所共有,则该粒子有1/n属于这个晶胞。
(2)审题时一定要注意是分子结构还是晶体结构,若是分子结构,其化学式由图中所有实际存在的原子个数决定,且原子个数比可以不约简。
3根据晶体晶胞的结构特点和有关数据,求算晶体的密度或晶体晶胞的体积

 求一个晶胞质量
求一个晶胞质量
晶胞的密度
 晶胞边长 求一个晶胞的体积
晶胞边长 求一个晶胞的体积
得关系式:ρ=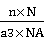 (a表示晶胞边长,ρ表示密度,NA表示阿伏伽德罗常数,n表示1摩尔晶胞所含基本粒子或特定组合的物质的量,M表示摩尔质量)
(a表示晶胞边长,ρ表示密度,NA表示阿伏伽德罗常数,n表示1摩尔晶胞所含基本粒子或特定组合的物质的量,M表示摩尔质量)
常见晶体结构类型:
第二篇:高中化学有机物知识总结
一、有机代表物质的物理性质 1. 状态 固态:饱和高级脂肪酸、脂肪、TNT、萘、苯酚、葡萄糖、果糖、麦芽糖、淀粉、纤维素、醋(16.6℃以下)气态:C4以下的烷烃、烯烃、炔烃、甲醛、一氯甲烷;液态:油 状:硝基苯、溴乙烷、乙酸乙酯、油酸
粘稠状:石油、乙二醇、丙三醇 2. 气味 ;无味:甲烷、乙炔(常因混有PH3、H2S和AsH3而带有臭味)) 稍有气味:乙烯 特殊气味:苯及苯的同系物、萘、石油、苯酚 刺激性:甲醛、甲酸、乙酸、乙醛
甜味:乙二醇(甘醇)、丙三醇(甘油)、蔗糖、葡萄糖
香味:乙醇、低级酯 苦杏仁味:硝基苯 3. 颜色 ;白色:葡萄糖、多糖 淡黄色:TNT、不纯的硝基苯 黑色或深棕色:石油 4. 密度 ;比水轻的:苯及苯的同系物、一氯代烃、乙醇、低级酯、汽油 比水重的:硝基苯、溴苯、乙二醇、丙三醇、CCl4、氯仿、溴代烃、碘代烃5. 挥发性:乙醇、乙醛、乙酸 6. 升华性:萘、蒽 7. 水溶性: 不溶:高级脂肪酸、酯、硝基苯、溴苯、烷烃、烯烃、炔烃、苯及苯的同系物、萘、蒽、石油、卤代烃、TNT、氯仿、CCl4 能溶:苯酚(0℃时是微溶) 微溶:乙炔、苯甲酸 易溶:甲醛、乙酸、乙二醇、苯磺酸 与水混溶:乙醇、苯酚(65℃以上)、乙醛、甲酸、丙三醇 二、有机物之间的类别异构关系
1. 分子组成符合CnH2n(n≥3)的类别异构体:烯烃和环烷烃2. 分子组成符合CnH2n-2(n≥4)的类别异构体:炔烃和二烯烃3. 分子组成符合CnH2n+2O(n≥3)的类别异构体:饱和一元醇和饱和醚4. 分子组成符合CnH2nO(n≥3)的类别异构体:饱和一元醛和饱和一元酮5. 分子组成符合CnH2nO2(n≥2)的类别异构体:饱和一元羧酸和饱和一元酯6. 分子组成符合CnH2n-6O(n≥7)的类别异构体:苯酚的同系物、芳香醇及芳香醚 如n=7,有以下五种:邻甲苯酚、间甲苯酚、对甲苯酚、苯甲醇、苯甲醚7. 分子组成符合CnH2n+2O2N(n≥2)的类别异构体:氨基酸和硝基化合物
三、能发生取代反应的物质
1. 烷烃与卤素单质:卤素单质蒸汽(如不能为溴水)。条件:光照2. 苯及苯的同系物与(1)卤素单质(不能为水溶液):条件:Fe作催化剂 (2)硝化:浓硝酸、50℃—60℃水浴 (3)磺化:浓硫酸,70℃—80℃水浴3. 卤代烃的水解: NaOH的水溶液 4. 醇与氢卤酸的反应:新制氢卤酸 5. 乙醇与浓硫酸在140℃时的脱水反应 7. 酸与醇的酯化反应:浓硫酸、加热8. 酯类的水解:无机酸或碱催化 9. 酚与 1)浓溴水 2)浓硝酸
四、能发生加成反应的物质
1. 烯烃、炔烃、二烯烃、苯乙烯的加成:H2、卤化氢、水、卤素单质2. 苯及苯的同系物的加成: H2、Cl23. 不饱和烃的衍生物的加成:(包括卤代烯烃、卤代炔烃、烯醇、烯醛、烯酸、烯酸酯、烯酸盐等)4. 含醛基的化合物(包括葡萄糖)的加成: HCN、H2等 5. 酮类、油酸、油酸盐、油酸某酯、油(不饱和高级脂肪酸甘油酯)等物质的加成:H2
注意:凡是有机物与H2的加成反应条件均为:催化剂(Ni)、加热 五、六种方法得乙醇(醇)
1. 乙醛(醛)还原法:
2. 卤代烃水解法:
3. 某酸乙(某)酯水解法:
4. 乙醇钠水解法:
5. 乙烯水化法:
6. 葡萄糖发酵法:
六、能发生银镜反应的物质(含-CHO)
1. 所有的醛(RCHO) 2. 甲酸、甲酸盐、甲酸某酯 3. 葡萄糖、麦芽糖、葡萄糖酯、 (果糖)
能和新制Cu(OH)2反应的除以上物质外,还与酸性较强的酸(如甲酸、乙酸、丙酸、盐酸、硫酸等)发生中和反应。
七、分子中引入羟基的有机反应类型
1. 取代(水解)反应:卤代烃、酯、酚钠、醇钠、羧酸钠
2. 加成反应:烯烃水化、醛+ H2 3. 氧化:醛氧化 4. 还原:醛+ H2 八、能跟钠反应放出H2的物质 (一)、 有机物
1. 醇(也可和K、Mg、Al反应)) 2. 有机羧酸 3. 酚(苯酚及苯酚的同系物) 4. 苯磺酸 5. 苦味酸(2,4,6-三硝基苯酚) 6. 葡萄糖(熔融) 7. 氨基酸 (二)、无机物
1. 水及水溶液 2. 无机酸(弱氧化性酸) 3. NaHSO4 九、能与溴水反应而使溴水褪色或变色的物质 (一)、有机物
1. 不饱和烃(烯烃、炔烃、二烯烃、苯乙烯、苯乙炔),不饱和烃的衍生物(包括卤代烯、烯醇、烯醛、烯酸、烯酯、油酸、油酸盐、油酸某酯、油等)。即含有碳碳双键或碳碳叁键的有机物。 2. 石油产品(裂化气、裂解气、裂化汽油等)
3. 苯酚及其同系物(因为能和溴水取代而生成三溴酚类沉淀) 4. 含醛基的化合物 (醛基被氧化) 5. 天然橡胶(聚异戊二烯) (二)、无机物
1.S(-2):硫化氢及硫化物 2. S(+4):SO2、H2SO3及亚硫酸盐 3. Fe2+ 例: 6FeSO4 + 3Br2 = 2Fe2(SO4)3 + 2FeBr2
6FeCl2 + 3Br2 = 4FeCl3 + 2FeBr3 2FeI2 + 3Br2 = 2FeBr3 + 2I2
4. Zn、Mg、Fe等单质如 Mg + Br2 = MgBr2
(此外,其中亦有Mg与H+、Mg与HBrO的反应) 5. I-:氢碘酸及碘化物 变色
6. NaOH等强碱:因为Br2 +H2O = HBr + HBrO 加入NaOH后 平衡向右移动 7. Na2CO3等盐:因为 Br2 +H2O = HBr + HBrO
2HBr + Na2CO3 = 2NaBr + CO2 + H2O HBrO + Na2CO3 = NaBrO + NaHCO3
8. AgNO3
十、能萃取溴而使溴水褪色的物质
上层变无色的(ρ>1):卤代烃(CCl4、氯仿、溴苯等)、CS2等
下层变无色的(ρ<1):低级酯、液态饱和烃(如己烷等)、苯及苯的同系物、汽油 十一、最简式相同的有机物
1. CH:C2H2、C6H6和C8H8(苯乙烯或环辛四烯) 2. CH2:烯烃和环烷烃
3. CH2O: 甲醛、乙酸、甲酸甲酯、葡萄糖
4. CnH2nO:饱和一元醛(或饱和一元酮)与二倍于其碳原子数的饱和一元 羧酸或酯. 例: 乙醛(C2H4O)与丁酸及异构体(C4H8O2) 5. 炔烃(或二烯烃)与三倍于其碳原子数的苯及苯的同系物 例: 丙炔(C3H4)与丙苯(C9H12) 十二、有毒的物质 (一)、 毒气
F2、Cl2、HF、H2S、SO2、CO、NO、NO2等,其中CO和NO使人中毒的原因相同,均是与血红蛋白迅速结合而丧失输送氧的能力. (二)、毒物
液溴、白磷、偏磷酸(HPO3)、水银、亚硝酸盐、除BaSO4外的大多数钡盐、氰化物(如KCN)、重金属盐(如铜盐、铅盐、汞盐、银盐等)、苯酚、硝基苯、六六六(六氯环己烷)、甲醇、砒霜等 十三、能爆炸的物质
1. 黑火药成分有:一硫、二硝(KNO3)三木炭 2. NH4NO3 3. 火棉 4. 红磷与KClO3 5. TNT(雷汞作引爆剂) 6. 硝化甘油 7. 氮化银
此外,某些混合气点燃或光照也会爆炸,其中应掌握:H2和O2 、 “点爆”的 CO和O2、 “光爆”的H2和Cl2、CH4和O2 、CH4和Cl2 、C2H2和O2。
无需点燃或光照,一经混合即会爆炸,所谓“混爆”的是H2和F2。 另外,工厂与实验室中,面粉、镁粉等散布于空气中,也是危险源。 十四、能使酸性高锰酸钾溶液褪色的物质 (一)、有机物
1. 不饱和烃(烯烃、炔烃、二烯烃、苯乙烯等) 2. 苯的同系物
3. 不饱和烃的衍生物(包括卤代烯、烯醇、烯醛、烯酸、烯酯、油酸、油酸盐、油酸酯等) 4. 含醛基的有机物(醛、甲酸、甲酸盐、甲酸某酯等) 5. 还原性糖(葡萄糖、麦芽糖) 6. 酚类
7. 石油产品(裂解气、裂化气、裂化汽油等) 8. 煤产品(煤焦油) 9. 天然橡胶(聚异戊二烯) (二)、无机物
1. 氢卤酸及卤化物(氢溴酸、氢碘酸、浓盐酸、溴化物、碘化物) 2. 亚铁盐及氢氧化亚铁 3. S(-2)的化合物:硫化氢、氢硫酸及硫化物 4. S(-4)的化合物:SO2、H2SO3及亚硫酸盐 5. 双氧水(H2O2) 十五、既能发生氧化反应,又能发生还原反应的物质 (一)、有机物
1. 含醛基的化合物:所有醛,甲酸、甲酸盐、甲酸酯, 葡萄糖. 2. 不饱和烃:烯烃、炔烃、二烯烃、苯乙烯
3. 不饱和烃的衍生物:包括卤代烯、卤代炔烃、烯醇、烯醛、烯酸、烯酸盐、烯酸酯、油酸、油酸盐、油酸酯、油. (二)、无机物
1. 含中间价态元素的物质:① S(+4):SO2、H2SO3及亚硫酸盐 ② Fe2+ 亚铁盐 ③ N:(+4)NO NO2 2. N2、S、Cl2等非金属单质. 3. HCl、H2O2等
十六、检验淀粉水解的程度
1.“未水解”加新制Cu(OH)2煮沸,若无红色沉淀,则可证明。 2.“完全水解”加碘水,不显蓝色。
3.“部分水解”取溶液再加新制Cu(OH)2煮沸,有红色沉淀,另取溶液加碘水,显蓝色。 十七、能使蛋白质发生凝结而变性的物质
1. 加热 2. 紫外线 3. 酸、碱 4. 重金属盐(如Cu2+、Pb2+、Hg2+、Ag+ 等) 5. 部分有机物(如苯酚、乙醇、甲醛等)。 十八、关于纤维素和酯类的总结 (一)、以下物质属于“纤维素”
1. 粘胶纤维 2.纸 3.人造丝 4.人造棉 5.玻璃纸 6.无灰滤纸 7. 脱脂棉 (二)、以下物质属于“酯”
1. 硝酸纤维 2. 硝化甘油 3. 胶棉 4. 珂珞酊 5. 无烟火药 6. 火棉 易错:TNT、酚醛树脂、赛璐珞既不是“纤维素”,也不是“酯”。 十九、既能和强酸溶液反应,又能和强碱溶液反应的物质 1. 有机物:蛋白质、氨基酸
2. 无机物:两性元素的单质 Al、(Zn) 两性氧化物 Al2O3、(ZnO)
两性氢氧化物 Al(OH)3、Zn(OH)2 弱酸的酸式盐 NaHCO3、NaH2PO4、NaHS 弱酸的铵盐 (NH4)2CO3、 NH4HCO3、(NH4)2SO3、(NH4)2S 等
属于“两性物质”的是:Al2O3、ZnO、Al(OH)3、Zn(OH)2、氨基酸、蛋白质 属于“表现两性的物质”是: Al、Zn、弱酸的酸式盐、弱酸的铵盐 二十、有机实验问题 (一)、甲烷的制取和性质
1. 反应方程式:
2. 为什么必须用无水醋酸钠?
若有水,电解质CH3COONa和NaOH将电离,使键的断裂位置发生改变而不生成CH4。 3. 必须用碱石灰而不能用纯NaOH固体,这是为何?碱石灰中的CaO的作用如何?
高温时,NaOH固体腐蚀玻璃;CaO作用:1)能稀释反应混合物的浓度,减少NaOH跟试管的接触,防止腐蚀玻璃。 2)CaO能吸水,保持NaOH的干燥。
4. 制取甲烷采取哪套装置?反应装置中,大试管略微向下倾斜的原因何在?此装置还可以制取哪些气体? 采用加热略微向下倾斜的大试管的装置,原因是便于固体药品的铺开,同时防止产生的湿水倒流而使试管炸裂。还可制取O2、NH3等。
5. 点燃甲烷时的火焰为何会略带黄色?点燃纯净的甲烷呈什么色? 1)玻璃中钠元素的影响;反应中副产物丙酮蒸汽燃烧使火焰略带黄色。 2)点燃纯净的甲烷火焰呈淡蓝色。 (二)、乙烯的制取和性质
1. 化学方程式:
2. 制取乙烯采用哪套装置?此装置还可以制备哪些气体?
分液漏斗、圆底烧瓶(加热)一套装置;此装置还可以制Cl2、HCl、SO2等. 3. 预先向烧瓶中加几片碎玻璃片(碎瓷片),是何目的? 防止暴沸(防止混合液在受热时剧烈跳动)
4. 乙醇和浓硫酸混合,有时得不到乙烯,这可能是什么原因造成的?
这主要是因为未使温度迅速升高到170℃所致,因为在140℃乙醇将发生分子间脱水得乙醚,方程式:
5. 温度计的水银球位置和作用如何?
混合液液面下,用于测混合液的温度(控制温度)。 6. 浓H2SO4的作用? 催化剂、脱水剂。
7. 反应后期,反应液有时会变黑,且有刺激性气味的气体产生,为何?
浓硫酸将乙醇炭化和氧化了,产生的刺激性气味的气体是
SO2。
(三)、乙炔的制取和性质 1. 反应方程式:
2. 此实验能否用启普发生器,为何?
不能, 因为 1)CaC2吸水性强,与水反应剧烈,若用启普发生器,不易控制它与水的反应; 2)反应放热,而启普发生器是不能承受热量的;3)反应生成的Ca(OH)2 微溶于水,会堵塞球形漏斗的下端口。 3. 能否用长颈漏斗?不能。用它不易控制CaC2与水的反应。
4. 用饱和食盐水代替水,这是为何?用以得到平稳的乙炔气流(食盐与CaC2不反应) 5. 简易装置中在试管口附近放一团棉花,其作用如何?防止生成的泡沫从导管中喷出。
6. 点燃纯净的甲烷、乙烯和乙炔,其燃烧现象有何区别?甲烷:淡蓝色火焰 乙烯: 明亮火焰,有黑烟 乙炔:明亮的火焰,有浓烟. (四)、苯跟溴的取代反应
1. 反应方程式:
2. 装置中长导管的作用如何?导气兼冷凝.冷凝溴和苯(回流原理) 3. 所加铁粉的作用如何?
催化剂(严格地讲真正起催化作用的是FeBr3)
4. 导管末端产生的白雾的成分是什么?产生的原因?怎样吸收和检验?锥形瓶中,导管为何不能伸入液面下?
白雾是氢溴酸小液滴,由于HBr极易溶于水而形成。用水吸收。检验用酸化的AgNO3溶液:加用酸化的AgNO3溶液后,产生淡黄色沉淀。导管口不伸入液面下是为了防止水倒吸。 5. 将反应后的液体倒入盛有冷水的烧杯中,有何现象? 水面下有褐色的油状液体(溴苯比水重且不溶于水) 6. 怎样洗涤生成物使之恢复原色?
溴苯因溶有溴而呈褐色,多次水洗或稀NaOH溶液洗可使其恢复原来的无色。 (五)、苯的硝化反应
1. 反应方程式:
2. 实验中,浓HNO3、浓H2SO4的作用如何?
浓HNO3是反应物(硝化剂);浓H2SO4是催化剂和脱水剂。 3. 使浓HNO3和浓H2SO4的混合酸冷却到50-60℃以下,这是为何?
①防止浓NHO3分解 ②防止混合放出的热使苯和浓HNO3挥发 ③温度过高有副反应发生(生成苯磺酸和间二硝基苯) 4. 盛反应液的大试管上端插一段导管,有何作用? 冷凝回流(苯和浓硝酸)
5. 温度计的水银球的位置和作用如何? 插在水浴中,用以测定水浴的温度。
6. 为何用水浴加热?放在约60℃的水浴中加热10分钟的目的如何?为什么应控制温度,不宜过高?
水浴加热,易于控制温度.有机反应往往速度缓慢,加热10分钟使反应彻底。①防止浓NHO3分解 ②防止混合放出的热使苯和浓HNO3挥发 ③温度过高有副反应发生(生成苯磺酸和间二硝基苯) 7. 制得的产物的颜色、密度、水溶性、气味如何?怎样洗涤而使之恢复原色?
淡黄色(溶有NO2,本色应为无色),油状液体,密度大于水,不溶于水,有苦杏仁味,多次水洗或NaOH溶液洗涤。
(六)、实验室蒸馏石油
1. 石油为什么说是混合物?蒸馏出的各种馏分是纯净物还是混合物?
石油中含多种烷烃、环烷烃及芳香烃,因而它是混合物。蒸馏出的各种馏分也还是混合物,因为蒸馏是物理变化。
2. 在原油中加几片碎瓷片或碎玻璃片,其作用如何? 防暴沸。 3. 温度计的水银球的位置和作用如何?
插在蒸馏烧瓶支管口的略下部位,用以测定蒸汽的温度。
4. 蒸馏装置由几部分构成?各部分的名称如何?中间的冷凝装置中冷却水的水流方向如何? 四部分:蒸馏烧瓶、冷凝管、接受器、锥形瓶。冷却水从下端的进水口进入,从上端的出水口流出。 5. 收集到的直馏汽油能否使酸性KMnO4溶液褪色?能否使溴水褪色?为何?
不能使酸性KMnO4溶液褪色,但能使溴水因萃取而褪色,因为蒸馏是物理变化,蒸馏出的各种馏分仍是各种烷烃、环烷烃及芳香烃组成的。 (七)、煤的干馏
1. 为何要隔绝空气?干馏是物理变化还是化学变化?煤的干馏和木材的干馏各可得哪些物质?
有空气氧存在,煤将燃烧。干馏是化学变化, 煤的干馏可得焦炭、焦炉气、煤焦油、粗氨水;木材的干馏可得木煤气、木炭、木焦油2. 点燃收集到的气体,有何现象?取少许直试管中凝结的液体,滴入到紫色的石蕊试液中,有何现象,为什么?此气体能安静地燃烧,产生淡蓝色火焰。能使石蕊试液变蓝,因为此液体是粗氨水,溶有氨,在水中电离呈碱性。 (八)、乙酸乙酯的制取
1. 反应方程式 :
2. 盛装反应液的试管为何应向上倾斜45°角? 液体受热面积最大。
3. 弯曲导管的作用如何? 导气兼冷凝回流(乙酸和乙醇) 4. 为什么导管口不能伸入Na2CO3溶液中? 为了防止溶液倒流. 5. 浓硫酸的作用如何? 催化剂和吸水剂 6. 饱和Na2CO3溶液的作用如何?
①乙酸乙酯在饱和碳酸钠溶液中的溶解度最小,利于分层;②乙酸与Na2CO3反应,生成无味的CH3COONa而被除去;③C2H5OH被Na2CO3溶液吸收,便于除去乙酸及乙醇气味的干扰。 (九)、酚醛树脂的制取
1. 反应方程式:
2. 浓盐酸的作用如何? 催化剂。
3. 水浴的温度是多少?是否需要温度计? 100℃,故无需使用温度计。4. 实验完毕的试管,若水洗不净,可用何种物质洗? 用酒精洗,因为酚醛树脂易溶于酒精。 (十)、淀粉的水解
1. 稀H2SO4的作用如何? 催化剂 2. 淀粉水解后的产物是什么?反应方程式
3. 向水解后的溶液中加入新制的Cu(OH)2悬浊液,加热,无红色沉淀生成,这 可能是何种原因所致?
未加NaOH溶液中和,原溶液中的硫酸中和了Cu(OH)2。 (十一)、 纤维素水解
纤维素水解后的产物是什么?反应方程式
2. 70%的H2SO4的作用如何? 催化剂
3. 纤维素水解后,为验证产物的性质,须如何实验?现象如何?先加NaOH溶液使溶液呈现碱性,再加新制Cu(OH)2,煮沸,有红色沉淀。证明产物是葡萄糖。4. 实验过程中,以什么为标志判断纤维素已水解完全了?
试管中产生亮棕色物质。 (十二)、纤维素三硝酸酯的制取 1. 反应方程式:
2. 将纤维素三硝酸酯和普通棉花同时点火,有何现象? 纤维素三硝酸酯燃烧得更迅速。
