广州大学教务处
 广大教字[2009] 32号
广大教字[2009] 32号
关于举办广州大学首届化学实验技能大赛的通知
各有关学院:
为了营造积极向上、勇攀高峰的学术科技氛围,强化学生的创新意识和动手能力,提高我校实验教学的质量,经研究,定于20##年11月份举办广州大学首届化学实验技能大赛。现将有关事项通知如下:
一、组织机构
本次比赛由教务处和校团委主办,由化学化工科技创新实践基地承办。
二、报名须知
1、参赛条件:全校修过(必修或选修均可)化学实验课程的二、三、四年级学生均可参赛,报名时请携带学生证。
2、报名地点:化学化工学院学工办(行政西前座322)
3、报名时间:20##年9月15日至20##年10月20日
4、联系人:宋著立老师 联系电话:39366900
三、比赛分组方式及内容
1、比赛分组
比赛分专业组和非专业组,化学专业和化学工程专业的为专业组,其它专业的为非专业组。
2、比赛方式及内容
比赛分笔试、初赛、决赛三个阶段。笔试按成绩各组分别取前60%进入初赛,初赛按成绩每组取前30%进入决赛。
各阶段内容如下:
(1)笔试:有关无机化学、有机化学或分析化学实验的基本操作和基本原理;
(2)初赛:硫酸亚铁铵的制备及纯度分析实验(具体要求见附件1);
(3)决赛:A、B两个选做一个(具体要求见附件2)。
A、氢氧化钠溶液浓度的测定实验;
B、2-甲基-2-氯丙烷的制备及表征实验。
四、比赛时间
笔试:20##年11月17日下午2:00---4:00
初赛:20##年11月24日下午2:00---4:00
决赛:20##年12月1日下午2:00---4:00
五、其它
1、进入实验比赛前要求撰写实验预习报告。预习报告要求:简述目的、原理、所需仪器药品、实验步骤并给出数据记录和处理表格(由竞赛组在前一天提供统一的纸张)。实验过程和实验后才能完成的内容留空。
2、竞赛结束后提交在预习报告基础上完成的实验报告。实验报告要求:数据(或现象)记录和处理、以及分析和讨论此实验成功的关键步骤及失败的原因。
3、奖励办法
决赛每组设一等奖1名,二等奖2名,三等奖3名,由学校颁发获奖证书和奖品;凡进入决赛者均可获优胜奖,由学校颁发获奖证书。
附件:1、初赛项目:硫酸亚铁铵的制备及纯度分析
2、 决赛项目A:氢氧化钠溶液浓度的测定
3、 决赛项目B:2-甲基-2-氯丙烷的制备及表征
4 、比赛评分标准
广州大学教务处
共青团广州大学委员会
广州大学化学化工科技创新实践基地
二○##年九月二十一日

发送:各有关学院
广州大学教务处综合办公室 20##年9月21日印发
附件1
初赛项目: 硫酸亚铁铵的制备及纯度分析
【实验内容与要求】
1. 制备复盐硫酸亚铁铵的原理和方法;
2. 水浴加热、溶解、常压和减压过滤、蒸发、结晶等基本操作;
3. 检验产品中杂质含量的一种方法──目视比色法。
【实验原理】
硫酸亚铁铵又称摩尔盐,是浅蓝绿色单斜晶体,它能溶于水,但难溶于乙醇。在空气中它不易被氧化,比硫酸亚铁稳定,所以在化学分析中可作为基准物质,用来直接配制标准溶液或标定末知溶液浓度。
在一定温度范围内,硫酸亚铁铵的溶解度比组成它的每一组分的溶解度都小。因此,很容易从浓的硫酸亚铁和硫酸铵混合溶液中制得结晶状的摩尔盐FeSO4·(NH4)2SO4·6H2O。在制备过程中,为了使Fe2+ 不被氧化和水解,溶液需保持足够的酸度。

本实验是先将金属铁粉溶于稀硫酸制得硫酸亚铁溶液:
Fe + H2SO4 ─→FeSO4 + H2 ↑
然后加入等物质的量的硫酸铵制得混合溶液,加热浓缩,冷至室温,便析出硫酸亚铁铵复盐。
FeSO4 + (NH4)2SO4 + 6 H2O ─→ FeSO4·(NH4)2SO4·6H2O
本实验采用目视比色法确定产品的杂质含量。具体做法是使Fe3+离子在一定条件下与显色剂KSCN作用,生成血红色的溶液,与已知杂质含量的溶液比较,确定杂质Fe3+含量的范围,从而确定产品的纯度等级。
 几种盐的溶解度数据(单位:g/100 g H2O)
几种盐的溶解度数据(单位:g/100 g H2O)
 盐(相对分子质量Mr) 10℃ 20℃ 30 ℃ 40 ℃
盐(相对分子质量Mr) 10℃ 20℃ 30 ℃ 40 ℃
(NH4)2SO4 (132.1) 73.0 75.4 8.0 81.0
FeSO4·7H2O (277.9) 37.0 48.0 60.0 73.3
 (NH4)2SO4 ·FeSO4·6H2O ( 392.1) 36.5 45.0 53.0
(NH4)2SO4 ·FeSO4·6H2O ( 392.1) 36.5 45.0 53.0
【实验仪器和药品和材料】
仪器:电子天平、25mL比色管1支,布氏漏斗一个,配套的吸滤瓶一个,锥形瓶(25mL)1个,蒸发皿1个, 100mL和10mL量筒各1个,50mL、500mL烧杯各1个,酒精灯,玻璃棒2根, 洗瓶1个,普通漏斗1个, 漏斗架一个铁架、铁圈、石棉网各一个
药品: 3mol·L-1 H2SO4,2.0 mol?L–1 HCl,1.0 mol?L–1KSCN, 10%Na2CO3 (NH4)2SO4 95%乙醇
材料:pH试纸,称量纸,滤纸铁屑
【实验步骤】
(1)铁的净化
称取2.0铁屑,放入锥形瓶中,加入10 ml 10% Na2CO3溶液,小火加热约10min 以除去铁上的油污,倾去碱液,先后用自来水和去离子水将铁屑洗至中性.
(2)FeSO4的制备
在上述锥形瓶中加入15 ml 3mol·L-1 H2SO4, 水浴加热(温度70-80℃)至不再有明显气泡放出,趁热常压过滤。未反应完的铁渣用滤纸吸干后称重,计算已反应的铁的质量。
(3)FeSO4·(NH4)2SO4·6H2O的制备
由已反应的铁的质量,计算所需要(NH4)2SO4的质量,称取(NH4)2SO4配成饱和溶液,加入蒸发皿中,搅匀后用3mol·L-1 H2SO4调节至pH为1-2,水浴蒸发浓缩后冷却至室温,析出的晶体减压过滤后用少量95%乙醇洗涤,抽干并用滤纸吸干晶体后称重。记录产品的外观并计算产率。
(4)纯度检验
称取1.0g产品于25ml比色管中,用15ml不含氧的去离子水溶解,再加入2ml 2 mol?L–1 HCl 溶解晶体,再加入1ml 1.0 mol?L–1KSCN溶液,加不含氧的去离子水稀释至刻度,摇匀后与标准色阶(标准色阶由老师配制)进行目视比色,确定Fe3+含量的范围和产品等级。
 硫酸亚铁铵产品等级与Fe3+的含量
硫酸亚铁铵产品等级与Fe3+的含量
 产品等级 Ⅰ级 Ⅱ级 Ⅲ级
产品等级 Ⅰ级 Ⅱ级 Ⅲ级
 Fe3+的含量/mg.g-1 <0.1 0.1 -0.2 >0.2
Fe3+的含量/mg.g-1 <0.1 0.1 -0.2 >0.2
(5)、数据记录与处理
(6)、结果分析和讨论
附件2
决赛项目A: 氢氧化钠溶液浓度的测定
【实验内容与要求】
1、氢氧化钠溶液浓度的标定;
2、稀释、称量和滴定分析操作的基本操作;
3、浓度、绝对偏差和相对偏差的计算。
【实验原理】
用邻苯二甲酸氢钾( KHP )标 定,以酚酞为指示剂,反应式为 :
HP-+ OH-=P2- +H2O
【仪器和试剂】
仪器:50mL碱式滴定管1支、锥形瓶3个、25mL移液管1个、250mL容量瓶1个
试剂:氢氧化钠待测溶液
0.1 % 酚酞溶液,邻苯二甲酸氢钾
【实验步骤】
1、稀释:用移液管移取25.00ml待测氢氧化钠溶液置于250.00ml容量瓶中,加水稀释至刻度,充分摇匀后待测;
2、称量:准确称取 0.4 - 0. 5 g 邻苯二甲酸氢钾 3 份 , 分别置 250 ml 锥形瓶中,加20 - 30 mL 蒸馏水溶解;
3、在锥形瓶中滴加 1 - 2 滴酚酞指示剂,用刚配好的 NaOH 溶液滴定溶液呈微红色,半分钟不褪色即为终点。 平行滴定3 次。记下各次滴定的零点体积和终点体积。计算待测氢氧化钠溶液的浓度以及绝对偏差和相对偏差。
4、数据记录与处理
5、结果分析和讨论
附件3
决赛项目B :2-甲基-2-氯丙烷的制备及表征
【实验内容与要求】
1. 以叔丁醇、浓盐酸为原料制备2-甲基-2-氯丙烷的原理和方法;
2. 分液漏斗的使用,萃取、干燥、蒸馏的原理和基本操作;
3.产物沸点和折光率的测定。
【实验原理】
2-甲基-2-氯丙烷,也称叔丁基氯(tert-butyl chloride),无色易燃液体,熔点 -25℃,沸点51~52℃,折射率nD201.3877,相对密度0.934。难溶于水,能与醇、醚等混溶。用作溶剂和有机合成原料。
叔丁基氯可由叔丁醇和浓盐酸反应制备得到,反应式如下:
反应属于SN1亲核取代反应历程,由于形成的叔丁基碳正离子稳定,使反应极易进行。
【实验仪器和药品】
仪器:14口标准磨口蒸馏装置1套、圆底烧瓶(25、100mL)各 1个、分液漏斗1个、锥形瓶(25 mL)3个、 烧杯2个、 量筒(10mL、25mL)各1个、温度计(150℃)1支、 电热套1个、铁架台2个、万用夹2套、铁圈1个。电子天平(公用)、折光仪(公用)。
药品:6.2g叔丁醇、21mL浓盐酸、10 mL 5%碳酸氢钠、无水氯化钙(1~3g)。
【实验步骤】
1、在100mL圆底烧瓶中,加入6.2g叔丁醇和21mL浓盐酸,不断振荡10~15 min后,转入分液漏斗,静置,待明显分层后,分去水层。
2、有机层分别用水、5%碳酸氢钠、水各5mL洗涤。产品用无水氯化钙干燥后,蒸馏,接收瓶置于冰水浴中,收集50~51℃馏分,记录沸程,称重。
3、测定产物的折光率。
附件4
比赛评分标准
第二篇:化学实验技能大赛试题
化学实验技能大赛试题
一 、填空
1、如被酸灼伤时可用1%的 水溶液处理;如被碱灼伤可用1%的 水溶液处理。
2、金属钠一般保存在 中;白磷一般保存在 中。
3、用于萃取的玻璃仪器为 ,使用该仪器时经常将它放在 上。
4、在进行玻璃管切断时,先 ,再 。
5、玻璃仪器洗净的标志是 。
6、汞能使人慢性中毒,若不慎将汞洒在地面上,应首先 ,然后
处理。
7、实验室经常使用分子筛来干燥液态有机物,属 方法干燥法。
8、在容量分析中,配制NaOH标准的蒸馏水须用煮沸后冷却的蒸馏水,目的 。
9、若某些易燃液体确实需要低温储存,则应存放在专门的___________内,且该设备应远离火源。
10、 为干燥以下四种物质,请选择合适的干燥剂填入下表的相应位置中,每种干燥剂只能使用一次。(备用干燥剂:氯化钙、硫酸镁、碳酸钾、金属钠)

11、化学试剂中,G.R.表示 ,A.R.表示 ,C.P.表示
。
12、不用仪器检查煤气管道或钢瓶漏气最简单的方法是
。
13、电器着火首先应 ,然后用 灭火器进行灭火,不能用
灭火器灭火。
14、从苯甲醛制备苯甲酸和苯甲醇实验中,苯甲醇的乙醚提取液需用饱和NaHSO3洗涤,其目的是 。
15、要配制Na2S2O3标液,蒸馏水应 ,目的 ,配制时应加入 ,目的是 ,配制后7~14天后标定,目的 。
16、在制作薄层板时,常使用的CMC是指 ,其主要作用是: 。
17、用纯水洗玻璃仪器时,使其既干净又节约用水的方法是 。
18、用草酸标定NaOH标液,应选 指示剂,用NaCO3标定HCl标液,应选用 指示剂。
19、在定量分析中,I2标液应盛放在 滴定管中使用,KMnO4标液为 滴定管,K2Cr2O7标液为 滴定管,NaCO3标液为 滴定管
20、铬酸洗液是实验室中常用的玻璃仪器去污洗涤用品,用 和 配制而成,虽然铬酸洗液去污效果良好,但由于 的原因,尽可能少使用。
21、 长期放置的乙醚可能含有 ,可以用 试纸检验,要除去这种物质,可使用 溶液洗涤乙醚,然后再干燥和蒸馏。
22、对NaCN废液和洒落的Hg滴进行无害化处理的方法分别是__________________和________________。
23、不能随便往碱性回收液中加入废酸液,这是因为 。
24、无机物“重结晶”的操作方法是:(1)在___________ 情况下将被纯化的物质溶于一定量溶剂中,形成________溶液;(2) _______________除去不溶性杂质;(3)滤液__________ ,被纯化的物质结晶析出,杂质留在母液中;(4) ________便得到较纯净的物质。
25、可燃气体与空气的混合物在其比例处于爆炸极限时,受到________________诱发将会引起爆炸。
二、选择
1、将BaSO4与PbSO4分离开,宜采用:
(A)NH3·H2O (B)HCl (C)H2S (D)NH4AC
2、王水的成分是下列哪一种混合而成?(体积比)
(A)HNO3+H2SO4 (1:3) (B) H2SO4+HCl (3:1) (C) HNO3+HCl (3:1)
(D) HCl+HNO3 (3:1)
3、某溶液为无色,下列何种离子不能否定?
(A)Ni2+ (B)Mn2+ (C)Cr3+ (D)Co2+
4、KMnO4能稳定存在于何处?
(A)空气中 (B)HCl中 (C)碱液中 (D)稀H2SO4溶液中
5、下列哪种氢氧化物既溶于NaOH,又溶于NH3·H2O
(A) Al(OH)3 (B)Zn(OH)2 (C)Cd(OH)2 (D)Ni(OH)2
6、在蒸馏操作中,对温度计位置描述正确的是:
(A)温度计水银球的上端与蒸馏头支管下侧相平;
(B)温度计水银球的中心处与蒸馏头支管口的中心位置一致;
(C)温度计水银球的上端与蒸馏头支管口的中心位置一致;
(D)温度计水银球的中心处与蒸馏头支管口下侧相平。
7、使用氢氟酸时,下列哪一个操作是不正确的?
(A)操作应在通风厨中进行; (B)用量筒量取氢氟酸,倒入烧杯中;
(C)操作上应戴上橡皮手套; (D)使用时应采用塑料或铂制器皿。
8、欲使滤纸紧贴于布氏漏斗内,滤纸的大小应服从下列哪种原则?
(A)大于漏斗内径; (B)与漏斗内径相同; (C)略小于漏斗内径; (D) 随便只要压紧漏斗即可。
9、AgNO3水溶液是:
(A)酸性 (B)中性 (C)碱性 (D)无法确定酸碱性
10、在水溶液中欲析出较好的结晶,宜采用下列哪个条件?D
(A)溶液浓度很大;(B)迅速冷却; (C)用力搅拌 ; (D)浓度适宜,缓慢降温。
11、 从滴瓶中取少量试剂加入试管的正确操作是:
(A) 将试管倾斜,滴管口贴在试管壁,再缓慢滴入试剂;
(B) 将试管倾斜,滴管口距试管口约半厘米处缓慢滴入试剂;
(C) 将试管垂直,滴管口伸入试管内半厘米再缓慢滴入试剂;
(D) 将试管垂直,滴管口贴在试管壁,再缓慢滴入试剂。
12、下列配制溶液的方法中,不正确的是:
(A) SnCl2溶液:将SnCl2溶于稀盐酸后加入锡粒;
(B) FeSO4溶液:将FeSO4溶于稀硫酸后放入铁钉;
(C) Hg(NO3)2溶液:将Hg(NO3)2溶于稀硝酸后加入少量Hg;
(D) FeCl3溶液: 将FeCl3溶于稀盐酸。
13、 实验室内因用电不符合规定引起导线及电器着火,此时应迅速:
(A)首先切断电源并用任意一种灭火器灭火;(B)切断电源后用泡沫灭火器灭火;
(C)切断电源用水灭火; (D)切断电源用CO2灭火器灭火。
14、一个交流单相插座的示意图如下。各插孔标注正确的是:
(A)a-地线(ground line);b-火线(live line);c-零线(null line);
(B) a-火线(live line);b-零线(null line);c-地线(ground line);
(C)a-地线(ground line);b-零线(null line);c-火线(live line);
(D) a-零线(null line);b-火线(live line);c-地线(ground line);
15、用紫外分光光度计可测定什么光谱:
(A) 原子吸收光谱 (B)分子吸收光谱 (C)电子吸收光谱 (D)原子发射光谱
16、下列哪些操作产生正误差?
(A)滴定管位于眼睛上方读取起始度数; (B)滴定管位于眼睛下方读取起始度数;
(C)移液管未用试液淋洗三遍,直接移取试液;(D)采用固定重量称量法称取无水Na2CO3
17、欲取50mL某溶液进行滴定要求容器量取的相对误差≤0.1%,在下列量具应选用哪一种?
(A)50mL滴定管; (B)50mL容量瓶; (C)50mL量筒; (D) 50mL移液管
18、pH=0.04的有效数字为几位? (A)一位 (B)两位 (C)三位 (D)不确定
19、水银的温度计最广可测下列哪种温度范围 :
(A)37℃以下; (B)100℃以下; (C)400℃以下 ; (D)500℃以下。
20、进行简单蒸馏操作时发现忘加了沸石,应该:
(A)停止加热后,马上加入沸石; (B)关闭冷却水后,加入沸石即可;
(C)停止加热后,待体系充分冷却,再加入沸石; (D)不需停止加热和关闭冷却水,即可加入沸石
21、纯化石油醚时,依次用浓硫酸、酸性高锰酸钾水溶液洗涤,其目的是:
(A)将石油醚中的不饱和烃类除去; (B)将石油醚中的低沸点的醚类除去;
(C)将石油醚中的醇类除去; (D)将石油醚中的水份除去。
22、旋转蒸发仪主要是用于:
(A)搅拌反应物,使反应加速进行; (B)旋转仪器使反应顺利进行;
(C)蒸发并得到产物; (D)蒸发溶剂和浓缩溶液。
23、柱层析时,单一溶剂往往不能取得良好的分离效果,展开剂往往是极性溶剂与非极性溶剂的混合物。下列常见溶剂的极性顺序正确的是:
(A)石油醚>甲苯>氯仿>丙酮 (B)甲苯>石油醚>氯仿>丙酮
(C)石油醚>丙酮>氯仿>甲苯 (D)丙酮>氯仿>甲苯>石油醚
24、液-液萃取过程的本质是什么?
(A)将物质由亲水性转为疏水性 (B)将水合离子改为配合物
(C)将物质由疏水性转为亲水性 (D)将沉淀在有机相中转化为可溶性物质
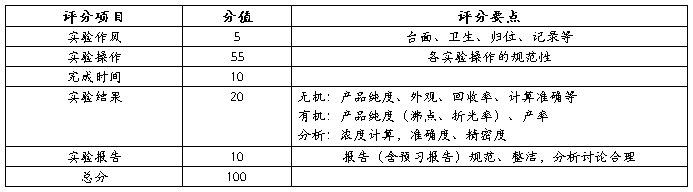
25、 在蒸馏操作中,下列温度计位置正确的是:
三、问答题
1、可以用无水氯化钙干燥乙醇吗?请简述理由。
答:不能,CaCl2易与醇类化合物形成络合物
2、试说出萃取与洗涤的异同点?
答:原理及操作相同。目的不同:萃取—使我们需要的物质溶于萃取层中,萃取得到产品;洗涤—使我们不需要的物质溶于洗涤层中,洗涤除去杂质
3、在萃取振荡过程中,若出现乳化现象,通常可采取什么措施?
答:可加入强电解质(如食盐)破乳
4、请指出下列仪器的名称:




5、什么是绿色化学?绿色化学实验的内容有哪些?
6、Al(OH)3 和 Zn(OH)2 都是白色沉淀,如何用简单的方法鉴别之(只用一种试剂)?
7、金属钠需保存在无水煤油中,怎样知道保存钠用的煤油是无水的呢?
8、如何更正下列作法的错误之处:(20分)
[1].称取固体 KMnO4 溶于煮沸并冷却的蒸馏水中。 [2].称取固体 Na2S2O3 溶于蒸馏水中煮沸
9、在配位滴定中(如用 EDTA 作为滴定剂)为什么必须使用酸、碱缓冲溶液?
10、在分液萃取层时,如不知哪一层是萃取层时,通常可采用什么方法来判断?
