初中化学方程式分类汇总
一﹑化合反应
1.单质的燃烧:
(1)镁带在空气中燃烧(照明弹)
化学方程式:2Mg + O2 2MgO
2MgO
实验现象:剧烈燃烧,放出热量,发出耀眼白光,产生白烟,生成白色固体。
(2)细铁丝在氧气中燃烧
化学方程式:3Fe + 2O2 Fe3O4
Fe3O4
实验现象:细铁丝在纯净的氧气中剧烈的燃烧,火星四射,放出热量,生成黑色固体。
(3)硫粉分别在空气中,氧气中燃烧
化学方程式:S + O2 SO2
SO2
实验现象:硫在空气中燃烧发出微弱的淡蓝色火焰,在氧气中剧烈燃烧发出明亮的篮紫色火焰,放出热量,生成有刺激性气味的气体。
(4)红磷在氧气中燃烧(烟幕弹)
化学方程式:4P + 5O2 2P2O5
2P2O5
实验现象:红磷在氧气中剧烈燃烧,发光放热,产生大量白烟。
(5)木炭在充足的氧气中燃烧
化学方程式:C + O2 CO2
CO2
实验现象:剧烈燃烧,放出热量,发出白光,生成能使澄清石灰水变浑浊的气体。
木炭在不充足的氧气中燃烧
化学方程式:2C + O2 2CO
2CO
(6)纯净的氢气在空气中燃烧
化学方程式:2H2 + O2 2H2O
2H2O
实验现象:纯净的氢气在空气中安静的燃烧发出淡蓝色的火焰,放出热量,在火焰的上方罩一干而冷的烧杯,烧杯内壁有水雾出现。
2.有毒气体的燃烧(尾气处理):
(7)一氧化碳燃烧
化学方程式:2CO + O2 2CO2
2CO2
实验现象:燃烧放出热量,发出蓝色火焰同时生成使澄清石灰水变浑浊的气体。
3.酸性氧化物与水的反应(CO2﹑SO2﹑SO3等):
(8)二氧化碳溶于水
化学方程式:CO2 + H2O  H2CO3
H2CO3
(9)二氧化硫溶于水
化学方程式:SO2 + H2O  H2SO3
H2SO3
(10)三氧化硫溶于水
化学方程式:SO3 + H2O  H2SO4
H2SO4
4.碱性氧化物与水的反应(Na2O﹑K2O﹑CaO﹑BaO等):
(11)氧化钠溶于水
化学方程式: Na2O + H2O  2NaOH
2NaOH
(12)氧化钙溶于水
化学方程式: CaO + H2O  Ca(OH)2
Ca(OH)2
实验现象:白色固体逐渐溶解,同时放出大量的热
5.二氧化碳气体通入炽热的炭层:
(13)化学方程式:CO2 + C  2CO
2CO
6.无水硫酸铜检验水的存在:
 (14)化学方程式:CuSO4 + 5H2O CuSO4·5H20
(14)化学方程式:CuSO4 + 5H2O CuSO4·5H20
实验现象:白色固体逐渐变成蓝色晶体
二﹑分解反应:
1.碱式碳酸铜(铜绿)受热分解:
 (15)化学方程式:Cu2(OH)2CO3 2CuO + H2O + CO2 ↑
(15)化学方程式:Cu2(OH)2CO3 2CuO + H2O + CO2 ↑
实验现象:绿色粉末逐渐变黑,试管壁有水珠出现,澄清石灰水逐渐变浑浊。
2.实验室制取氧气:
 (16)用氯酸钾和二氧化锰为原料制氧气:
(16)用氯酸钾和二氧化锰为原料制氧气:
化学方程式:2KClO3 2KCl + O2↑
(17)用高锰酸钾制氧气:
 化学方程式:2KMnO4 K2MnO4 + MnO2 + O2 ↑
化学方程式:2KMnO4 K2MnO4 + MnO2 + O2 ↑
(18)用双氧水和二氧化锰为原料制氧气:
化学方程式:2H2O2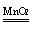 2H2O + O2↑
2H2O + O2↑
3.红色粉末氧化汞受热分解:
 (19)化学方程式:2HgO 2Hg + O2 ↑
(19)化学方程式:2HgO 2Hg + O2 ↑
实验现象:红色的氧化汞粉末逐渐变成白色液体,同时有能使带火星的木条复燃的气体生成。
4.水通电分解 :
(20)化学方程式:2H2O  2H2↑ + O2 ↑
2H2↑ + O2 ↑
实验现象:电源两极有气泡冒出,正极产生的气体与负极产生的气体体积比为1:2
5.碳酸不稳定,易分解:
(21)化学方程式:H2CO3 H2O + CO2 ↑
H2O + CO2 ↑
6.高温煅烧石灰石:
(22)化学方程式:CaCO3  CaO + CO2 ↑
CaO + CO2 ↑
7.碳酸钠晶体暴露在干燥的空气中风化:
(23)化学方程式:Na2CO3·10H2O  Na2CO3 + 10H2O
Na2CO3 + 10H2O
8.硫酸铜晶体受热失去结晶水:
 (24)化学方程式:CuSO4·5H2O CuSO4 + 5H2O
(24)化学方程式:CuSO4·5H2O CuSO4 + 5H2O
9.不溶性的碱受热易分解:
(25)氢氧化铜受热分解
 化学方程式:Cu(OH)2 CuO + H2O
化学方程式:Cu(OH)2 CuO + H2O
(26)氢氧化铁受热分解
 化学方程式:2Fe(OH)3 Fe2O3 + 3H2O
化学方程式:2Fe(OH)3 Fe2O3 + 3H2O
(27)氢氧化镁受热分解
 化学方程式:Mg(OH)2 MgO + H2O
化学方程式:Mg(OH)2 MgO + H2O
三﹑置换反应:
1.气体与固体之间的置换反应:
(28)氢气还原氧化铜
 化学方程式:H2 +CuO Cu + H2O
化学方程式:H2 +CuO Cu + H2O
实验现象:黑色固体粉末逐渐变成光亮的红色,试管壁有水珠生成
(29)氢气还原氧化铁
化学方程式:3H2 + Fe2O3 2Fe + 3H2O
2Fe + 3H2O
2.固体与固体之间的置换反应:
(30)木炭粉与氧化铜的反应
化学方程式:C + 2CuO  2Cu +CO2↑
2Cu +CO2↑
实验现象:黑色固体变成红色,同时又能使澄清石灰水变混浊的气体生成
(31)木炭粉与氧化铁的反应
化学方程式:3C + 2Fe2O3 4Fe + 3CO2↑
4Fe + 3CO2↑
3.液体与固体之间的置换反应:
1)固态非金属物质与水的反应:
(32)木炭与水的反应
化学方程式:C + H2O  CO + H2
CO + H2
2)金属与酸溶液的反应:
(33)将锌粒投入稀硫酸中
化学方程式:Zn + H2SO4 ZnSO4 + H2 ↑
ZnSO4 + H2 ↑
(34)将锌粒投入稀盐酸中
化学方程式:Zn + 2HCl  ZnCl2 + H2 ↑
ZnCl2 + H2 ↑
(35)将镁带投入稀硫酸中
化学方程式:Mg + H2SO4 MgSO4 + H2 ↑
MgSO4 + H2 ↑
(36)将镁带投入稀盐酸中
化学方程式:Mg + 2HCl  MgCl2 + H2 ↑
MgCl2 + H2 ↑
(37)将铁钉投入稀硫酸中
化学方程式:Fe + H2SO4 FeSO4 + H2 ↑
FeSO4 + H2 ↑
(38)将铁钉投入稀盐酸中
化学方程式:Fe + 2HCl  FeCl2 + H2 ↑
FeCl2 + H2 ↑
实验现象:铁钉表面有气泡冒出,溶液有无色变成浅绿色
3)金属与盐溶液的反应:
(39)将铁钉投入硫酸铜溶液中(曾青得铁则化为铜)
化学方程式:Fe + CuSO4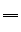 FeSO4 + Cu
FeSO4 + Cu
实验现象:铁钉表面有紫红色的固体物质析出,溶液有蓝色变为浅绿色
(40)将锌片投入硫酸铜溶液中
化学方程式:Zn + CuSO4 ZnSO4 + Cu
ZnSO4 + Cu
(41)将铜片投入硝酸汞溶液中
化学方程式:Cu + Hg(NO3)2 Cu(NO3)2 + Hg
Cu(NO3)2 + Hg
实验现象:铜片表面有银白色液体析出,溶液有无色变为蓝色
四﹑复分解反应:
1.碱性氧化物与酸的反应:
(42)氧化铜粉末溶于稀盐酸中
化学方程式:CuO + 2HCl  CuCl2 + H2O
CuCl2 + H2O
(43)氧化铜粉末溶于稀硫酸中
化学方程式:CuO + H2SO4 CuSO4 + H2O
CuSO4 + H2O
实验现象:黑色固体粉末逐渐溶解,溶液由无色逐渐变为蓝色
(44)氧化铁溶于稀硫酸中
化学方程式:Fe2O3 + 3H2SO4 Fe2(SO4)3 + 3H2O
Fe2(SO4)3 + 3H2O
(45)氧化铁溶于稀盐酸中
化学方程式:Fe2O3 + 6HCl  2FeCl3 + 3H2O
2FeCl3 + 3H2O
实验现象:红棕色固体逐渐溶解,溶液由无色变为黄色
(46)氧化锌溶于稀硝酸中
化学方程式:ZnO + 2HNO3 Zn(NO3)2 + H2O
Zn(NO3)2 + H2O
2.酸与碱的反应:
(47)氢氧化钠与稀盐酸混合
化学方程式:NaOH + HNO3 NaNO3 + H2O
NaNO3 + H2O
(48)氢氧化铜与稀盐酸混合
化学方程式:Cu(OH)2 + 2HCl  CuCl2 + 2H2O
CuCl2 + 2H2O
实验现象:蓝色固体逐渐消失,溶液由无色逐渐变为蓝色
(49)氢氧化镁与稀盐酸混合
化学方程式:Mg(OH)2 + 2HCl MgCl2 + 2H2O
MgCl2 + 2H2O
实验现象:白色固体逐渐消失
(50)氢氧化铁与稀盐酸混合
化学方程式:Fe(OH)3 + 3HCl  FeCl3 + 3H2O
FeCl3 + 3H2O
实验现象:红褐色固体逐渐消失,溶液有无色变为黄色
(51)氢氧化铝与稀盐酸混合
化学方程式:Al(OH)3 + 3HCl  AlCl3 + 3H2O
AlCl3 + 3H2O
(52)氢氧化铜与稀硫酸混合
化学方程式:Cu(OH)2 + H2SO4 CuSO4 + 2H2O
CuSO4 + 2H2O
(53)氢氧化钠与稀硝酸混合
化学方程式:NaOH + HNO3 NaNO3 + H2O
NaNO3 + H2O
(54)氢氧化镁与稀硝酸混合
化学方程式:Mg(OH)2 + 2HNO3 Mg(NO3)2 + 2H2O
Mg(NO3)2 + 2H2O
3.酸与盐的反应:
(55)稀盐酸与混有稀硝酸的硝酸银溶液混合
化学方程式:HCl + AgNO3 AgCl↓ + HNO3
AgCl↓ + HNO3
实验现象:有白色不溶于稀硝酸的沉淀生成
(56)稀硫酸与混有稀硝酸的氯化钡溶液混合
化学方程式:H2SO4 + BaCl2 BaSO4↓ + 2HCl
BaSO4↓ + 2HCl
实验现象:有白色不溶于稀硝酸的沉淀生成
(57)将碳酸钙粉末投入稀盐酸溶液中
化学方程式:CaCO3 + 2HCl  CaCl2 + H2O + CO2↑
CaCl2 + H2O + CO2↑
实验现象:白色固体逐渐溶解,有能使澄清石灰水变浑浊的气体生成
(58)将碳酸钠粉末投入稀硫酸溶液中
化学方程式:Na2CO3 + H2SO4 Na2SO4 + H2O + CO2↑
Na2SO4 + H2O + CO2↑
4.碱与盐的反应:
(59)硫酸铜溶液与氢氧化钠溶液混合
化学方程式:CuSO4 + 2NaOH  Na2SO4 + Cu(OH)2↓
Na2SO4 + Cu(OH)2↓
实验现象:有蓝色沉淀生成
(60)氯化铁溶液与氢氧化钠溶液混合
化学方程式:FeCl3 + 3NaOH  3NaCl + Fe(OH)3↓ 实验现象:有红褐色沉淀生成
3NaCl + Fe(OH)3↓ 实验现象:有红褐色沉淀生成
(61)碳酸钠溶液与氢氧化钙溶液混合
化学方程式:Na2CO3 + Ca(OH)2 NaOH + CaCO3↓ 实验现象:有白色沉淀生成
NaOH + CaCO3↓ 实验现象:有白色沉淀生成
(62)硝酸铵溶液与氢氧化钠溶液混合
化学方程式:NH4NO3 + NaOH  NaNO3 + NH3↑ + H2O
NaNO3 + NH3↑ + H2O
实验现象:由刺激性气味的气体生成,该气体能使红色的石蕊试纸变蓝
5.盐与盐的反应:
(63)硝酸银溶液与氯化钠溶液混合:化学方程式:AgNO3 + NaCl  NaNO3 + AgCl↓
NaNO3 + AgCl↓
实验现象:有白色不溶于稀硝酸的沉淀生成
(64)硝酸银溶液与氯化钾溶液混合:化学方程式:AgNO3 + KCl  KNO3 + AgCl↓
KNO3 + AgCl↓
实验现象:有白色不溶于稀硝酸的沉淀生成
(65)氯化钡溶液与硫酸钠溶液混合
化学方程式:Na2SO4 + BaCl2 BaSO4↓ + 2NaCl
BaSO4↓ + 2NaCl
实验现象:有白色不溶于稀硝酸的沉淀生成
(66)碳酸钠溶液与氯化钙溶液混合
化学方程式:Na2CO3 + CaCl2 2NaCl + CaCO3 ↓
2NaCl + CaCO3 ↓
实验现象:有白色沉淀生成
(67)硝酸钡溶液与硫酸铜溶液混合
化学方程式:Ba(NO3)2 + CuSO4 Cu(NO3)2 + BaSO4↓
Cu(NO3)2 + BaSO4↓
实验现象:有白色不溶于稀硝酸的沉淀生成
五﹑其它反应:
1.酸性氧化物与碱的反应:
(68) 检验二氧化碳的反应:
化学方程式:CO2 + Ca(OH)2 CaCO3↓ +H2O
CaCO3↓ +H2O
(69)吸收或除去二氧化碳的反应:
化学方程式:CO2 + 2NaOH  Na2CO3 + H2O
Na2CO3 + H2O
(70)除去尾气二氧化硫的反应:
化学方程式:SO2 + 2NaOH  Na2SO3 + H2O
Na2SO3 + H2O
(71)既能用于检验又能用于除去二氧化碳的反应:
化学方程式:CO2 + Ba(OH)2 BaCO3↓ + H2O
BaCO3↓ + H2O
(72)氢氧化钠溶液吸收三氧化硫:化学方程式:SO3 + 2NaOH  Na2SO4 + H2O
Na2SO4 + H2O
2.三种有机物的燃烧:
(73)甲烷燃烧:化学方程式: CH4 + 2O2 CO2 + 2H2O
CO2 + 2H2O
实验现象:燃烧,放出热量,发出明亮的蓝色火焰,在火焰的上方罩一干而冷的烧杯,烧杯内壁有水珠生成;若在烧杯中涂上澄清的石灰水,石灰水变浑浊。
(74)甲醇燃烧:化学方程式:2CH3OH + 3O2 2CO2 + 4H2O
2CO2 + 4H2O
(75)乙醇燃烧:化学方程式:C2H5OH + 3O2 2CO2 + 3H2O
2CO2 + 3H2O
3.用一氧化碳做还原剂冶炼金属:
1)炼铁(原料:赤铁矿或磁铁矿):
(76)化学方程式:3CO + Fe2O3 2Fe + 3CO2
2Fe + 3CO2
实验现象:红色粉末逐渐变成黑色,有能使澄清石灰水变浑浊的气体产生
(77)化学方程式:4CO + Fe3O4 3Fe + 4CO2
3Fe + 4CO2
2)炼铜(原料:氧化铜):
 (78)化学方程式:CO + CuO Cu + CO2
(78)化学方程式:CO + CuO Cu + CO2
实验现象:黑色粉末逐渐变成光亮的红色,又能使成清石灰水变浑浊的气体产生
4.补充:
 (79)2Cu + O2 2CuO
(79)2Cu + O2 2CuO
实验现象:红色的铜逐渐变成黑色
(80)2Al2O3 4Al + 3O2↑
4Al + 3O2↑
(81)3H2 + WO3 W + 3H2O
W + 3H2O
第二篇:初中化学方程式分类汇总
初中化学方程式分类汇总
一﹑化合反应
1.单质的燃烧:
(1)镁带在空气中燃烧(照明弹)
化学方程式:2Mg + O2 2MgO
2MgO
实验现象:剧烈燃烧,放出热量,发出耀眼白光,产生白烟,生成白色固体。
(2)细铁丝在氧气中燃烧
化学方程式:3Fe + 2O2 Fe3O4
Fe3O4
实验现象:细铁丝在纯净的氧气中剧烈的燃烧,火星四射,放出热量,生成黑色固体。
(3)硫粉分别在空气中,氧气中燃烧
化学方程式:S + O2 SO2
SO2
实验现象:硫在空气中燃烧发出微弱的淡蓝色火焰,在氧气中剧烈燃烧发出明亮的篮紫色火焰,放出热量,生成有刺激性气味的气体。
(4)红磷在氧气中燃烧(烟幕弹)
化学方程式:4P + 5O2 2P2O5
2P2O5
实验现象:红磷在氧气中剧烈燃烧,发光放热,产生大量白烟。
(5)木炭在充足的氧气中燃烧
化学方程式:C + O2 CO2
CO2
实验现象:剧烈燃烧,放出热量,发出白光,生成能使澄清石灰水变浑浊的气体。
木炭在不充足的氧气中燃烧
化学方程式:2C + O2 2CO
2CO
(6)纯净的氢气在空气中燃烧
化学方程式:2H2 + O2 2H2O
2H2O
实验现象:纯净的氢气在空气中安静的燃烧发出淡蓝色的火焰,放出热量,在火焰的上方罩一干而冷的烧杯,烧杯内壁有水雾出现。
2.有毒气体的燃烧(尾气处理):
(7)一氧化碳燃烧
化学方程式:2CO + O2 2CO2
2CO2
实验现象:燃烧放出热量,发出蓝色火焰同时生成使澄清石灰水变浑浊的气体。
3.酸性氧化物与水的反应(CO2﹑SO2﹑SO3等):
(8)二氧化碳溶于水
化学方程式:CO2 + H2O  H2CO3
H2CO3
(9)二氧化硫溶于水
化学方程式:SO2 + H2O  H2SO3
H2SO3
(10)三氧化硫溶于水
化学方程式:SO3 + H2O  H2SO4
H2SO4
4.碱性氧化物与水的反应(Na2O﹑K2O﹑CaO﹑BaO等):
(11)氧化钠溶于水
化学方程式: Na2O + H2O  2NaOH
2NaOH
(12)氧化钙溶于水
化学方程式: CaO + H2O  Ca(OH)2
Ca(OH)2
实验现象:白色固体逐渐溶解,同时放出大量的热
5.二氧化碳气体通入炽热的炭层:
(13)化学方程式:CO2 + C  2CO
2CO
6.无水硫酸铜检验水的存在:
 (14)化学方程式:CuSO4 + 5H2O CuSO4·5H20
(14)化学方程式:CuSO4 + 5H2O CuSO4·5H20
实验现象:白色固体逐渐变成蓝色晶体
二﹑分解反应:
1.碱式碳酸铜(铜绿)受热分解:
 (15)化学方程式:Cu2(OH)2CO3 2CuO + H2O + CO2 ↑
(15)化学方程式:Cu2(OH)2CO3 2CuO + H2O + CO2 ↑
实验现象:绿色粉末逐渐变黑,试管壁有水珠出现,澄清石灰水逐渐变浑浊。
2.实验室制取氧气:
 (16)用氯酸钾和二氧化锰为原料制氧气:
(16)用氯酸钾和二氧化锰为原料制氧气:
化学方程式:2KClO3 2KCl + O2↑
(17)用高锰酸钾制氧气:
 化学方程式:2KMnO4 K2MnO4 + MnO2 + O2 ↑
化学方程式:2KMnO4 K2MnO4 + MnO2 + O2 ↑
(18)用双氧水和二氧化锰为原料制氧气:
化学方程式:2H2O2 2H2O + O2↑
2H2O + O2↑
3.红色粉末氧化汞受热分解:
 (19)化学方程式:2HgO 2Hg + O2 ↑
(19)化学方程式:2HgO 2Hg + O2 ↑
实验现象:红色的氧化汞粉末逐渐变成白色液体,同时有能使带火星的木条复燃的气体生成。
4.水通电分解 :
(20)化学方程式:2H2O  2H2↑ + O2 ↑
2H2↑ + O2 ↑
实验现象:电源两极有气泡冒出,正极产生的气体与负极产生的气体体积比为1:2
5.碳酸不稳定,易分解:
(21)化学方程式:H2CO3 H2O + CO2 ↑
H2O + CO2 ↑
6.高温煅烧石灰石:
(22)化学方程式:CaCO3  CaO + CO2 ↑
CaO + CO2 ↑
7.碳酸钠晶体暴露在干燥的空气中风化:
(23)化学方程式:Na2CO3·10H2O  Na2CO3 + 10H2O
Na2CO3 + 10H2O
8.硫酸铜晶体受热失去结晶水:
 (24)化学方程式:CuSO4·5H2O CuSO4 + 5H2O
(24)化学方程式:CuSO4·5H2O CuSO4 + 5H2O
9.不溶性的碱受热易分解:
(25)氢氧化铜受热分解
 化学方程式:Cu(OH)2 CuO + H2O
化学方程式:Cu(OH)2 CuO + H2O
(26)氢氧化铁受热分解
 化学方程式:2Fe(OH)3 Fe2O3 + 3H2O
化学方程式:2Fe(OH)3 Fe2O3 + 3H2O
(27)氢氧化镁受热分解
 化学方程式:Mg(OH)2 MgO + H2O
化学方程式:Mg(OH)2 MgO + H2O
三﹑置换反应:
1.气体与固体之间的置换反应:
(28)氢气还原氧化铜
 化学方程式:H2 +CuO Cu + H2O
化学方程式:H2 +CuO Cu + H2O
实验现象:黑色固体粉末逐渐变成光亮的红色,试管壁有水珠生成
(29)氢气还原氧化铁
化学方程式:3H2 + Fe2O3 2Fe + 3H2O
2Fe + 3H2O
2.固体与固体之间的置换反应:
(30)木炭粉与氧化铜的反应
化学方程式:C + 2CuO  2Cu +CO2↑
2Cu +CO2↑
实验现象:黑色固体变成红色,同时又能使澄清石灰水变混浊的气体生成
(31)木炭粉与氧化铁的反应
化学方程式:3C + 2Fe2O3 4Fe + 3CO2↑
4Fe + 3CO2↑
3.液体与固体之间的置换反应:
1)固态非金属物质与水的反应:
(32)木炭与水的反应
化学方程式:C + H2O  CO + H2
CO + H2
2)金属与酸溶液的反应:
(33)将锌粒投入稀硫酸中
化学方程式:Zn + H2SO4 ZnSO4 + H2 ↑
ZnSO4 + H2 ↑
(34)将锌粒投入稀盐酸中
化学方程式:Zn + 2HCl  ZnCl2 + H2 ↑
ZnCl2 + H2 ↑
(35)将镁带投入稀硫酸中
化学方程式:Mg + H2SO4 MgSO4 + H2 ↑
MgSO4 + H2 ↑
(36)将镁带投入稀盐酸中
化学方程式:Mg + 2HCl  MgCl2 + H2 ↑
MgCl2 + H2 ↑
(37)将铁钉投入稀硫酸中
化学方程式:Fe + H2SO4 FeSO4 + H2 ↑
FeSO4 + H2 ↑
(38)将铁钉投入稀盐酸中
化学方程式:Fe + 2HCl  FeCl2 + H2 ↑
FeCl2 + H2 ↑
实验现象:铁钉表面有气泡冒出,溶液有无色变成浅绿色
3)金属与盐溶液的反应:
(39)将铁钉投入硫酸铜溶液中(曾青得铁则化为铜)
化学方程式:Fe + CuSO4 FeSO4 + Cu
FeSO4 + Cu
实验现象:铁钉表面有紫红色的固体物质析出,溶液有蓝色变为浅绿色
(40)将锌片投入硫酸铜溶液中
化学方程式:Zn + CuSO4 ZnSO4 + Cu
ZnSO4 + Cu
(41)将铜片投入硝酸汞溶液中
化学方程式:Cu + Hg(NO3)2 Cu(NO3)2 + Hg
Cu(NO3)2 + Hg
实验现象:铜片表面有银白色液体析出,溶液有无色变为蓝色
四﹑复分解反应:
1.碱性氧化物与酸的反应:
(42)氧化铜粉末溶于稀盐酸中
化学方程式:CuO + 2HCl  CuCl2 + H2O
CuCl2 + H2O
(43)氧化铜粉末溶于稀硫酸中
化学方程式:CuO + H2SO4 CuSO4 + H2O
CuSO4 + H2O
实验现象:黑色固体粉末逐渐溶解,溶液由无色逐渐变为蓝色
(44)氧化铁溶于稀硫酸中
化学方程式:Fe2O3 + 3H2SO4 Fe2(SO4)3 + 3H2O
Fe2(SO4)3 + 3H2O
(45)氧化铁溶于稀盐酸中
化学方程式:Fe2O3 + 6HCl  2FeCl3 + 3H2O
2FeCl3 + 3H2O
实验现象:红棕色固体逐渐溶解,溶液由无色变为黄色
(46)氧化锌溶于稀硝酸中
化学方程式:ZnO + 2HNO3 Zn(NO3)2 + H2O
Zn(NO3)2 + H2O
2.酸与碱的反应:
(47)氢氧化钠与稀盐酸混合
化学方程式:NaOH + HNO3 NaNO3 + H2O
NaNO3 + H2O
(48)氢氧化铜与稀盐酸混合
化学方程式:Cu(OH)2 + 2HCl  CuCl2 + 2H2O
CuCl2 + 2H2O
实验现象:蓝色固体逐渐消失,溶液由无色逐渐变为蓝色
(49)氢氧化镁与稀盐酸混合
化学方程式:Mg(OH)2 + 2HCl MgCl2 + 2H2O
MgCl2 + 2H2O
实验现象:白色固体逐渐消失
(50)氢氧化铁与稀盐酸混合
化学方程式:Fe(OH)3 + 3HCl  FeCl3 + 3H2O
FeCl3 + 3H2O
实验现象:红褐色固体逐渐消失,溶液有无色变为黄色
(51)氢氧化铝与稀盐酸混合
化学方程式:Al(OH)3 + 3HCl  AlCl3 + 3H2O
AlCl3 + 3H2O
(52)氢氧化铜与稀硫酸混合
化学方程式:Cu(OH)2 + H2SO4 CuSO4 + 2H2O
CuSO4 + 2H2O
(53)氢氧化钠与稀硝酸混合
化学方程式:NaOH + HNO3 NaNO3 + H2O
NaNO3 + H2O
(54)氢氧化镁与稀硝酸混合
化学方程式:Mg(OH)2 + 2HNO3 Mg(NO3)2 + 2H2O
Mg(NO3)2 + 2H2O
3.酸与盐的反应:
(55)稀盐酸与混有稀硝酸的硝酸银溶液混合
化学方程式:HCl + AgNO3 AgCl↓ + HNO3
AgCl↓ + HNO3
实验现象:有白色不溶于稀硝酸的沉淀生成
(56)稀硫酸与混有稀硝酸的氯化钡溶液混合
化学方程式:H2SO4 + BaCl2 BaSO4↓ + 2HCl
BaSO4↓ + 2HCl
实验现象:有白色不溶于稀硝酸的沉淀生成
(57)将碳酸钙粉末投入稀盐酸溶液中
化学方程式:CaCO3 + 2HCl  CaCl2 + H2O + CO2↑
CaCl2 + H2O + CO2↑
实验现象:白色固体逐渐溶解,有能使澄清石灰水变浑浊的气体生成
(58)将碳酸钠粉末投入稀硫酸溶液中
化学方程式:Na2CO3 + H2SO4 Na2SO4 + H2O + CO2↑
Na2SO4 + H2O + CO2↑
4.碱与盐的反应:
(59)硫酸铜溶液与氢氧化钠溶液混合
化学方程式:CuSO4 + 2NaOH  Na2SO4 + Cu(OH)2↓
Na2SO4 + Cu(OH)2↓
实验现象:有蓝色沉淀生成
(60)氯化铁溶液与氢氧化钠溶液混合
化学方程式:FeCl3 + 3NaOH  3NaCl + Fe(OH)3↓ 实验现象:有红褐色沉淀生成
3NaCl + Fe(OH)3↓ 实验现象:有红褐色沉淀生成
(61)碳酸钠溶液与氢氧化钙溶液混合
化学方程式:Na2CO3 + Ca(OH)2 NaOH + CaCO3↓ 实验现象:有白色沉淀生成
NaOH + CaCO3↓ 实验现象:有白色沉淀生成
(62)硝酸铵溶液与氢氧化钠溶液混合
化学方程式:NH4NO3 + NaOH  NaNO3 + NH3↑ + H2O
NaNO3 + NH3↑ + H2O
实验现象:由刺激性气味的气体生成,该气体能使红色的石蕊试纸变蓝
5.盐与盐的反应:
(63)硝酸银溶液与氯化钠溶液混合:化学方程式:AgNO3 + NaCl  NaNO3 + AgCl↓
NaNO3 + AgCl↓
实验现象:有白色不溶于稀硝酸的沉淀生成
(64)硝酸银溶液与氯化钾溶液混合:化学方程式:AgNO3 + KCl  KNO3 + AgCl↓
KNO3 + AgCl↓
实验现象:有白色不溶于稀硝酸的沉淀生成
(65)氯化钡溶液与硫酸钠溶液混合
化学方程式:Na2SO4 + BaCl2 BaSO4↓ + 2NaCl
BaSO4↓ + 2NaCl
实验现象:有白色不溶于稀硝酸的沉淀生成
(66)碳酸钠溶液与氯化钙溶液混合
化学方程式:Na2CO3 + CaCl2 2NaCl + CaCO3 ↓
2NaCl + CaCO3 ↓
实验现象:有白色沉淀生成
(67)硝酸钡溶液与硫酸铜溶液混合
化学方程式:Ba(NO3)2 + CuSO4 Cu(NO3)2 + BaSO4↓
Cu(NO3)2 + BaSO4↓
实验现象:有白色不溶于稀硝酸的沉淀生成
五﹑其它反应:
1.酸性氧化物与碱的反应:
(68) 检验二氧化碳的反应:
化学方程式:CO2 + Ca(OH)2 CaCO3↓ +H2O
CaCO3↓ +H2O
(69)吸收或除去二氧化碳的反应:
化学方程式:CO2 + 2NaOH  Na2CO3 + H2O
Na2CO3 + H2O
(70)除去尾气二氧化硫的反应:
化学方程式:SO2 + 2NaOH  Na2SO3 + H2O
Na2SO3 + H2O
(71)既能用于检验又能用于除去二氧化碳的反应:
化学方程式:CO2 + Ba(OH)2 BaCO3↓ + H2O
BaCO3↓ + H2O
(72)氢氧化钠溶液吸收三氧化硫:化学方程式:SO3 + 2NaOH  Na2SO4 + H2O
Na2SO4 + H2O
2.三种有机物的燃烧:
(73)甲烷燃烧:化学方程式: CH4 + 2O2 CO2 + 2H2O
CO2 + 2H2O
实验现象:燃烧,放出热量,发出明亮的蓝色火焰,在火焰的上方罩一干而冷的烧杯,烧杯内壁有水珠生成;若在烧杯中涂上澄清的石灰水,石灰水变浑浊。
(74)甲醇燃烧:化学方程式:2CH3OH + 3O2 2CO2 + 4H2O
2CO2 + 4H2O
(75)乙醇燃烧:化学方程式:C2H5OH + 3O2 2CO2 + 3H2O
2CO2 + 3H2O
3.用一氧化碳做还原剂冶炼金属:
1)炼铁(原料:赤铁矿或磁铁矿):
(76)化学方程式:3CO + Fe2O3 2Fe + 3CO2
2Fe + 3CO2
实验现象:红色粉末逐渐变成黑色,有能使澄清石灰水变浑浊的气体产生
(77)化学方程式:4CO + Fe3O4 3Fe + 4CO2
3Fe + 4CO2
2)炼铜(原料:氧化铜):
 (78)化学方程式:CO + CuO Cu + CO2
(78)化学方程式:CO + CuO Cu + CO2
实验现象:黑色粉末逐渐变成光亮的红色,又能使成清石灰水变浑浊的气体产生
4.补充:
 (79)2Cu + O2 2CuO
(79)2Cu + O2 2CuO
实验现象:红色的铜逐渐变成黑色
(80)2Al2O3 4Al + 3O2↑
4Al + 3O2↑
(81)3H2 + WO3 W + 3H2O
W + 3H2O
