 Na
Na
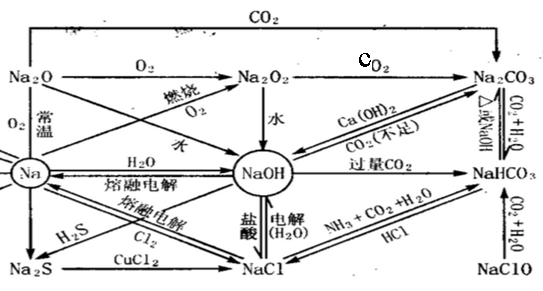
钠在空气中放置 4Na + O2 = 2Na2O
钠在空气中点燃 2Na +O2 = Na2O2
钠和硫反应 2Na + S =Na2S
钠和水反应 2Na + 2H2O =2NaOH +H2↑
氧化钠和水反应 Na2O + H2O = 2NaOH
氧化钠和二氧化碳反应 Na2O + CO2 = Na2CO3
氧化钠和盐酸反应 Na2O + 2HCl = 2NaCl + H2O
过氧化钠和水反应 2Na2O2 + 2H2O = 4NaOH + O2↑
过氧化钠和二氧化碳反应 2Na2O2 + 2CO2 = 2Na2CO3 + O2
碳酸氢钠受热分解2NaHCO3 △ Na2CO3 + CO2↑+ H2O
碳酸钠和盐酸反应Na2CO3 +2HCl = 2NaCl + CO2↑ +H2O
Na2CO3 +HCl = NaCl + NaHCO3
碳酸氢钠和盐酸反应NaHCO3 +HCl = NaCl + CO2↑ +H2O
碳酸钠和氢氧化钙反应Na2CO3 +Ca(OH)2 = CaCO3 ↓+ 2NaOH
碳酸氢钠和氢氧化钠反应 NaHCO3 + NaOH = Na2CO3 + H2O
氢氧化钠和二氧化碳反应2NaOH+CO2(少量)====Na2CO3+H2O
NaOH+CO2(过量)====NaHCO3

Al
①:4Al+3O2 = 2Al2O3 (常温、点燃)
②:2Al2O3=4Al+3O2↑电解法冶炼铝
③:2Al+6HCl=2AlCl3+3H2↑ 2Al+6H+=2Al3++3H2↑
④:2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2Al+2OH-+2H2O=2AlO2-+3H2↑
⑤:Al2O3+6HCl=2AlCl3+3H2O Al2O3+6H+=2Al3++3H2O
⑥:Al2O3+2NaOH=2NaAlO2+H2O Al2O3+2OH-=2AlO2-+H2O
⑦:AlCl3+3NH3·H2O=Al(OH)3↓+3NH4Cl 制取Al(OH)3用氨水而不用NaOH溶液
Al3++3NH3·H2O=Al(OH)3↓+3NH4+
AlCl3+3NaOH=Al(OH)3↓+3NaCl
Al3++3OH-=Al(OH)3↓
⑧:Al(OH)3+3HCl=AlCl3+3H2O Al(OH)3+3H+=Al3++3H2O
⑨:Al(OH)3+NaOH=NaAlO2+2H2O Al(OH)3+OH-=AlO2-+2H2O
⑩:2NaAlO2+CO2(少量)+3H2O =2Al(OH)3↓+ Na2CO3
2AlO2-+CO2(少量)+3H2O = 2Al(OH)3↓+ CO32-
NaAlO2+CO2(过量)+2H2O=Al(OH)3↓+ NaHCO3
AlO2-+CO2(过量)+2H2O=Al(OH)3↓+ HCO3-
Fe
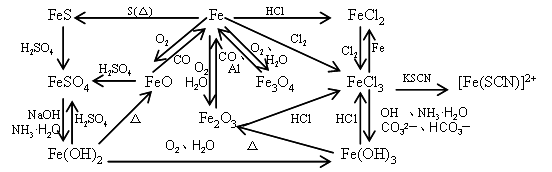
3Fe+2O2=点燃=Fe3O4
Fe+2HCl=FeCl2+H2↑
Fe+CuSO4=Cu+FeSO4
Fe2O3+3CO=高温=2Fe+3CO2↑
Fe3O4+4CO=高温=3Fe+4CO2↑
FeCl3+3H2O==Fe(OH)3(胶体)+3HCl
3Fe3O4+28HNO3=9Fe(NO3)3+NO↑+14H2O
Fe+2FeCl3=3FeCl2
FeSO4+2NaOH=Fe(OH)2↓(白色沉淀)+Na2SO4
4Fe(OH)2+O2+2H2O=4Fe(OH)3 (红褐色沉淀)
Fe+4HNO3(足量)=Fe(NO3)3+NO+2H2O
3Fe+8HNO3(少量)=3Fe(NO3)2+2NO+4H2O
Fe+6HNO3(浓)=加热=Fe(NO3)3+3NO2↑+3H2O (常温下钝化)
Fe+4HNO3(足量)=Fe(NO3)3+NO↑+2H2O
3Fe+8HNO3(少量)=3Fe(NO3)2+2NO↑+4H2O
2Fe+6H2SO4(浓)=加热=Fe2(SO4)3+3SO2↑+6H2O (常温下钝化)
2Fe(OH)3+6HI=2FeI2+I2+3H20
2FeCl3+Cu=2FeCl2+CuCl2
FeCl3+3NH3?H2O=Fe(OH)3↓+3NH4Cl
Fe2O3+2Al=高温=Al2O3+2Fe
3Fe3O4+8Al=高温=4Al2O3+6Fe
6FeSO4+2KNO3+4H2SO4====K2SO4+3Fe2(SO4)3+2NO↑+4H2O
铁离子遇硫氰根离子变红:Fe3+ +SCN-===[Fe(SCN)]2+(血红)

C
C+O2=CO2(点燃)
2C+O2=2CO(点燃)
C+2CuO=2Cu+CO2↑(高温)
CO2+C=2CO(高温)
CO+CuO=Cu+CO2(加热)
CaCO3+2HCl=CaCl2+H2O+CO2↑
Ca(OH)2+CO2=CaCO3↓+H2O
CO2+H2O=H2CO3
H2CO3=H2O+CO2↑
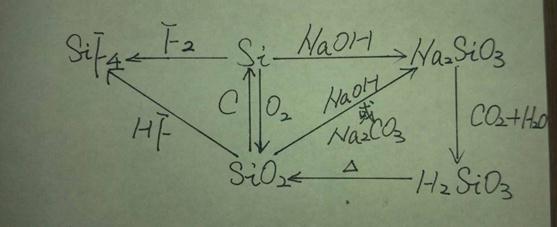
Si
Si+2NaOH+H2O=Na2SiO3+2H2↑
Si+F2=SiF4
Si + O2 =加热 SiO2
SiO2+Na2CO3==高温==Na2SiO3+CO2↑(或CaCo3)
SiO2+2C=(高温)Si+2CO↑
SiO2+4HF=SiF4↑+2H2O
SiO2 + CaO =(高温) CaSiO3
Na2SiO3+CO2+H2O==Na2CO3+H2SiO3↓
H2SiO3==加热H2O+SiO2
SiO2+2NaOH=Na2SiO3+2H2O
Cl
Cl2+H2== 2HCl (将H2在Cl2点燃;混合点燃、加热、光照发生爆炸)
3Cl2+2Fe ==2FeCl3
Cl2+Cu== CuCl2
Cl2+2FeCl2===2FeCl3 (在水溶液中:Cl2+2Fe2+===2Fe3++3Cl )
Cl2+Na2S===2NaCl+S↓ Cl2+S2–=2Cl–+S↓
Cl2+H2S===2HCl+S↓ Cl2+H2S=2H++2Cl–+S↓
Cl2+SO2+2H2O===H2SO4+2HCl Cl2+SO2+2H2O=4H++SO42–+2Cl–
Cl2+H2O2===2HCl+O2 Cl2+H2O2=2H++Cl–+O2
Cl2+H2O==HCl+HClO (Cl2+H2O ==2H++Cl–+HClO)
Cl2+2NaOH==NaCl+NaClO+H2O (Cl2+2OH–=Cl–+ClO–+H2O)
Cl2+2Ca(OH)2==CaCl2+Ca(ClO)2+2H2O (Cl2+2OH–=Cl–+ClO–+H2O)
3Cl2+6KOH(浓)= 5KCl+KClO3+3H2O 3Cl2+6OH–=5Cl–+ClO3–+3H2O
4HCl(浓)+MnO2 =MnCl2+Cl2↑+2H2O
4H++2Cl–+MnO2= Mn2++Cl2↑+2H2O
4HCl(g)+O2= 2Cl2+2H2O
16HCl+2KMnO4===2KCl+2MnCl2+5Cl2↑+8H2O
16 H++10Cl-+2MnO4–=2Mn2++5Cl2↑+8H2O\x09
6HCl+KClO3==KCl+3Cl2↑+3H2O
6H++5Cl–+ClO3–=3Cl2↑+3H2O

N
3NO2+H2O=4HNO3
N2O5+H2O=2HNO3
N2 (g)+ O2(g) =(放电)2NO(g)
2NO (g)+ O2(g)= 2NO2(g)
N2 + 2O2=(放电)=2NO2
3NO2 (g)+ H2O(l) =2HNO3(l) + NO(g)
4NO2(g)+2H2O(l)+O2(g)=4HNO3(l)
4NO(g)+2H2O(l)+3O2(g)=4HNO3(l)
4NH3+5O2=(△)4NO+6H2O
2NO+O2=2NO2
3NO2+H2O=2HNO3+NO
H2SO4+2KNO3=K2SO4+2HNO3
N2+3H2=2NH3
S
Cl2 +Na2S===2NaCl+S
Cl2 +H2S===2HCl+S
S+H2===H2S
2S+C===CS2
S+Fe===FeS
S+2Cu===Cu2S
3S+2Al===Al2S3
S+Zn===ZnS
S+O2===SO2
S+6HNO3(浓)===H2SO4+6NO2+2H2O
3S+4 HNO3(稀)===3SO2+4NO+2H2O
H2S+Fe===FeS+H2
H2S+CuCl2===CuS+2HCl
2SO2+O2===2SO3
2SO2+O2+2H2O===2H2SO4
SO2+Cl2+2H2O===H2SO4+2HCl
SO2+NO2===SO3+NO
SO2+2H2S===3S+2H2O
SO2+2NH3+H2O===(NH4)2SO3
第二篇:化学第一章总结
化学第一章知识点总结
(说明:涉及多个知识点和考点,认真复习和总结,查漏补缺)
一、 化学实验安全
1、 了解安全措施
(1) 稀释浓硫酸时,应把浓硫酸沿着玻璃棒注入水中,并不断搅拌。
(2) 温度计中水银洒出时,用硫粉处理 Hg+S=HgS
(3)浓酸撒在实验台上,先用Na2CO3 (或NaHCO3)中和,后用水冲擦干净。浓酸沾在皮肤上,宜先用干抹布拭去,再用水冲净。浓酸溅在眼中应先用稀NaHCO3溶液淋洗,然后请医生处理。
(4)浓碱撒在实验台上,先用稀醋酸中和,然后用水冲擦干净。浓碱沾在皮肤上,宜先用大量水冲洗,再涂上硼酸溶液。浓碱溅在眼中,用水洗净后再用硼酸溶液淋洗。
2、掌握正确的操作方法
(1)蒸馏时,冷凝管中的水是下口进,上口出;
(2)蒸馏时,温度计水银球下端应处于蒸馏烧瓶侧支管口处。
(3)萃取时,分液漏斗中上层液体从上口倒出,下层液体从下口放出(使用先检漏);
(4)蒸发时,出现大量晶体时停止加热,应用余热蒸发至干。
4、危险化学品标志:注意放射性、腐蚀性、爆炸性标志
二、 混合物的分离和提纯
(1)

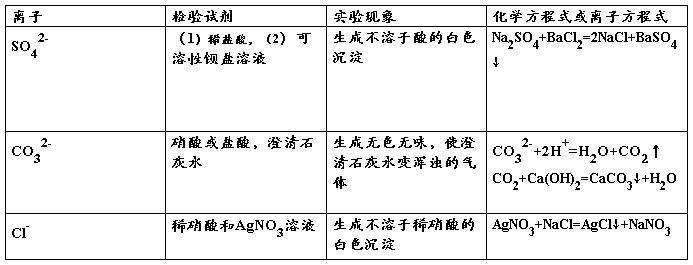
(2)离子的检验
三、 物质的量及物质的量浓度
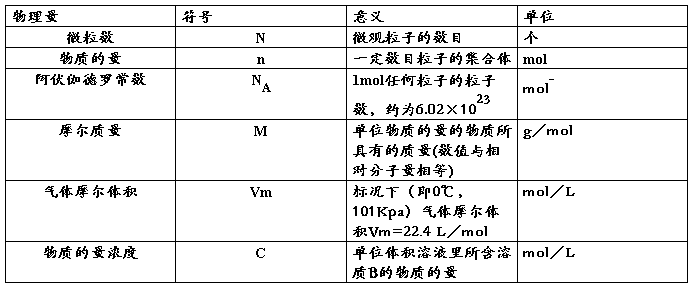
注意:阿伏伽德罗定律:在相同的温度和压强下,相同体积的任何气体都含有相同数目的粒子。Vm=V/n(同温同压,Vm相同)
⑵各物理量组成的公式
物质的粒子数N n =N/NA N=NA×n NA=N/n
物质的质m M=m/n m=M×n n=m/M
标准状况气体体积V V=n×Vm n=V/Vm Vm=V/n
物质的量浓度CB CB=nB/V nB=CB×V V=nB/CB
四、 溶液稀释规律:C(浓)×V(浓)=C(稀)×V(稀)
五、 一定物质的量浓度的配制
(1) 容量瓶的使用
① 容量瓶上标有:温度、容量、刻度线。
② 容量瓶一般规格:50 mL,100 mL,250 mL,500 mL,1000mL
③ 使用容量瓶时应注意:
Ø 检漏 :将容量瓶倒转后,观察是否漏水,再将瓶塞旋转180度观察是否漏水
Ø 不能在容量瓶里进行溶质的溶解,
Ø 用于洗涤烧杯的溶剂总量不能超过容量瓶的标线,一旦超过,必须重新进行配置。
Ø 容量瓶不能进行加热。如果溶质在溶解过程中放热,要待溶液冷却后再进行转移,因为温度升高瓶体将膨胀,所量体积就会不准确。
Ø 容量瓶只能用于配制溶液,不能储存溶液,因为溶液可能会对瓶体进行腐蚀,从而使容量瓶的精度受到影响。
(2) 配制溶液的基本操作步骤及所需仪器
Ø 所需仪器:托盘天平(称固体)、量筒(量液体)、烧杯、玻璃棒、容量瓶、胶头滴管
Ø 配制溶液基本步骤
① 计算 所称固体的质量或所量取的体积。
② 称量 用托盘天平称取所需溶质或用量筒量取所需浓溶液。
③ 溶解 一般在小烧杯中溶解或稀释,玻璃棒搅拌。
④ 转移 溶液需冷却至室温再转移;转移是用玻璃棒引流,且其下端靠在容
量瓶内壁上。
⑤ 洗涤 用蒸馏水洗涤小烧杯和玻璃棒2-3次。
⑥ 定容 向容量瓶中加水至距离刻度线1-2cm处,改用胶头滴管定容至刻
度。
⑦ 摇匀、装瓶 塞好瓶塞,反复上下颠倒摇匀。
(3) 配制溶液时的误差分析
根据 C=n/V=m/(MV)判断

