高中化学推断题--突破口归纳 (重)
一、位置与结构
1、Li是周期序数等于族序数2倍的元素。
2、S是最高正价等于最低负价绝对值3倍的元素。
3、Be、Mg是最外层电子数与最内层电子数相等的元素;
4、Li、Na是最外层电子数是最内电子数的1/2的元素;
5、最外层电子数是最内层电子数的2倍的是C、Si;3倍的是O、S;4倍的是Ne、Ar。
6、Be、Ar是次外层电子数等于最外层电子数的元素;
6、Mg是次外层电子数等于最外层电数4倍的元素;
7、Na是次外层电子数等于最外层电子数8倍的元素。
8、H、He、Al是原子最外层电子数与核外电子层数相等。
9、He、Ne各电子层上的电子数都满足2n2的元素。
10、H、He、Al是族序数与周期数相同的元素。
11、Mg是原子的最外层上的电子数等于电子总数的1/6的元素;
12、最外层上的电子数等于电子总数的1/3的是Li、P;1/2的有Be;相等的是H、He。
13、C、S是族序数是周期数2倍的元素。
14、O是族序数是周期数3倍的元素。
15、C、Si是最高正价与最低负价代数和为零的短周期元素。
16、O、F是最高正价不等于族序数的元素。
17、子核内无中子的原子 氢( H)
18、形成化合物种类最多的元素 碳
19、地壳中含量前三位的元素 O、Si、Al
20、大气中含量最多的元素 N
21、最外层电子数为次外层2倍的元素(或次外层电子数为最外层1/2的元素)C
22、最外层电子数为次外层3倍的元素(或次外层电子数为最外层1/3的元素) O
23、最外层电子数为次外层4倍的元素(或次外层电子数为最外层1/4的元素)Ne
24、最外层电子数为次外层电子数1/2的元素Li、Si
25、最外层电子数为次外层电子数1/4的元素 Mg
25、最外层电子数比次外层电子数多3个的元素N
26、最外层电子数比次外层电子数多5个的元素 F
27、最外层电子数比次外层电子数少3个的元素P
28、最外层电子数比次外层电子数多5个的元素 Al
29、核外电子总数与其最外层电子数之比为3:2的元素C
30、内层电子总数是最外层电子数2倍的原子有Li 、P
31、电子层数跟最外层电子数数相等的原子有H 、Be、 Al
32、核外电子总数与其最外层电子数之比为4:3的元素 O
33、最外层电子数是电子层数2倍的原子有关He、 C、 S
34、最外层电子数跟次外层电子数相等的原子有Be、Ar
35、X、Y两元素可形成X2Y和X2Y2两种化合物(或形成原子个数比2:1与1:1的化合物 Na2O、Na2O2 、H2O、H2O2
二、含量与物理性质
1、O是地壳中质量分数最大的元素,Si次之,Al是地壳中质量分数最大的金属元素。
2、H是最轻的非金属元素;Li是最轻的金属元素。
3、Na是焰色反应为黄色的元素;K是焰色反应为紫色(透过蓝色的钴玻璃观察)的元素。
4、Si是人工制得纯度最高的元素;C是天然物质中硬度最大的元素。
5、N是气态氢化物最易溶于水的元素;O是氢化物沸点最高的非金属元素。
6、常温下,F、Cl是单质具有有色气体的元素。
7、C是形成化合物种类最多的、最高价氧化物的含量增加会导致“温室效应”的元素。
8、Cl是单质最易液化的气体、最高价氧化物的水化物酸性最强的元素。
三、化学性质与用途
1、F是单质与水反应最剧烈的非金属元素。
2、N是气态氢化物与其最高价氧化物对应水化物能起化合反应的元素。
3、S是气态氢化物与其低价氧化物能反应生成该元素的元素。
4、P是在空气中能自燃的元素。
5、F是气态氢化物的水溶液可以雕刻玻璃的元素。
6、O是有两种同素异形体对人类生存最为重要的元素。
7、Mg是既能在CO2中燃烧,又能在N2中燃烧的金属单质。
8、Li、Na、F的单质在常温下与水反应放出气体的短周期元素。
四、 10电子微粒组
1、原子Ne
2、分子CH4、NH3、H2O、HF
3、阳离子Na+、Mg2+、Al3+、H3O+
4、阴离子N3-、O2-、F-、OH-、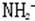
五、 18电子微粒组
1、原子Ar
2、分子SiH4、PH3、H2S、HCl、F2、H2O 、
3、阳离子K+、Ca2+、PH4+
4、阴离子P3-、S2-、Cl-、
5、特殊情况:F2、H2O2、C2H6、CH3OH、CH3F 、N2H4
六、核外电子总数及质子数均相同的粒子有
1、Na+ 、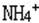 、H3O+
、H3O+
2、F-、OH-、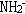
3、Cl-、HS-、
4、N2 、CO、C2H2
七、同族的上下周期元素原子序数之间的关系
1、二、三周期的同族元素原子序数之差为8。
2、三、四周期的同族元素原子序数之差为8或18,ⅠA、ⅡA为8,其他族为18。
3、四、五周期的同族元素原子序数之差为18。
4、五、六周期的同族元素原子序数之差为18或32。
5、六、七周期的同族元素原子序数之差为32。
特征现象
1.焰色反应:Na+(黄色)、K+(紫色)
2.浅黄色固体:S或Na2O2或AgBr或FeS2
3.有色溶液:Fe2+(浅绿色)、Fe3+(黄色)、Cu2+(蓝色)、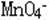 (紫色)
(紫色)
有色固体:红色(Cu、Cu2O、Fe2O3)、红褐色[Fe(OH)3] 、蓝色[Cu(OH)2] 、黑色(CuO、FeO、FeS、CuS、Ag2S、PbS) 、黄色(AgI、 Ag3PO4)、 白色[Fe(OH)2、CaCO3、BaSO4、AgCl、BaSO3]
有色气体:Cl2(黄绿色)、NO2(红棕色)
4.特征反应现象:Fe(OH)2→Fe(OH)3,白色到灰绿到红褐色
高中化学知识点
一、 元素化合物:
卤族元素
1 遇淀粉变蓝的物质 I2(碘水、碘酒)
2 使淀粉—KI溶液变蓝的物质 Cl2
3 最强的含氧酸 HClO4
4 最稳定的气态氢化物 HF
5 描述下列实验现象:
(1)铜丝在氯气中燃烧 产生棕黄色的烟
(2)H2在Cl2中燃烧 产生苍白色的火焰
(3)CH4与Cl2混合光照 黄绿色变浅,瓶内壁有油状液滴
6 漂白粉的有效成分 Ca(ClO)2
7 检验Cl- 先加稀HNO3酸化,再加入AgNO3溶液,有白色沉淀
氧族元素
1 能使带火星的木条复燃的气体 O2
2 能使品红褪色的气体 SO2(颜色可复现)、Cl2(颜色不可复现)
3 能使澄清的石灰水变浑浊的气体 CO2、SO2
4 浓硫酸的特性 吸水性、脱水性、氧化性、难挥发
5 检查肠胃用作“钡餐”的 BaSO4
6 检验SO 先加稀盐酸酸化,再加入BaCl2溶液,有白色沉淀
7 某溶液加入盐酸产生刺激气味气体,该溶液中定含有: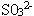
8 引发酸雨的污染物 SO2
氮族元素
1 常用作金属焊接保护气、代替稀有气体填充灯泡、保存粮食水果的气体 N2
2 在放电情况下才发生反应的两种气体 N2与O2
3 遇到空气立刻变红棕色的气体 NO
4 有颜色的气体 Cl2(黄绿色)、NO2(红棕色)
5 造成光化学烟雾的污染物 NO2
6 极易溶于水的气体 NH3、HCl
7 NH3喷泉实验的现象和原理 红色喷泉
8 NH3的空间结构 三角锥形
9 溶于水显碱性的气体 NH3
10 能使湿润的红色石蕊试纸变蓝的气体 NH3
11 两种气体相遇产生白烟 NH3遇HCl
12 某溶液加入NaOH溶液产生气体 气体一定是NH3;溶液一定含NH
13 检验某白色固体是铵盐的方法 加入浓NaOH溶液并加热,产生刺激气味能使湿润的红色石蕊试纸变蓝的气体,则固体为铵盐。
14 某溶液加入H2SO4的同时加入Cu.铜溶解溶液变蓝,该溶液中含有: 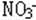
15 浓硝酸的特性 不稳定易分解、强氧化性、易挥发
16 王水的成分及特性 浓硝酸与浓盐酸1:3体积比混合具有极强的氧化性(溶解金、铂)
17 能使蛋白质变黄的物质 浓硝酸
18 火柴盒侧面的涂料 红磷
碳族
1 制造光导纤维的原料 SiO2
2 不能贮存在有磨口玻璃塞的玻璃瓶中的是 NaOH、KOH、(Na2SiO3)、NaF
碱金属
1 Na+的焰色K+的焰色 黄色紫色(隔蓝色钴玻璃观察)
2 钠与水反应的现象 钠漂浮在水面上,熔化成一个银白色小球,在水面到处游动,发出咝咝的声响,反应后滴入酚酞溶液变红。
3 能与Na2O2反应的两种物质 H2O、CO2
4 治疗胃酸过多的药品 NaHCO3
5 碱金属单质与盐溶液反应 (无法置换金属) 2Na + 2H2O + CuSO4 === Na2SO4 + Cu(OH)2↓+ H2↑
6 碳酸钠、碳酸氢钠的热稳定性比较 碳酸氢钠受热易分解
7 碳酸钠、碳酸氢钠的相互转化 NaHCO3加热生成Na2CO3Na2CO3溶液中通入过量CO2生成NaHCO3
Al、Mg、Fe金属
1 常用作净水剂的物质 明矾、Al(OH)3
2 常用作耐火材料的物质 Al2O3、MgO
3 既能溶于盐酸又能溶于NaOH溶液的物质 Al、Al2O3、Al(OH)3、NaHCO3、(NH4)2S
4 红褐色的沉淀 Fe(OH)3
5 红棕色的固体 Fe2O3
6 能发生钝化现象的两种金属 两种酸 Fe、Al浓硫酸、浓硝酸
有色物质
1 有颜色的气体 Cl2(黄绿色)、NO2(红棕色)
2 淡黄色的固体 Na2O2、S、AgBr、AgI(黄)
3 水溶液显蓝色的 含Cu2+的溶液(如CuSO4溶液)
4 水溶液显黄色的 含Fe3+的溶液(如FeCl3溶液)
一、 单质:Cu 紫红 Au 黄 S 黄 B 黄或黑 F2 淡黄绿 C(石墨) 黑 Cl2 黄绿 C(金刚石) 无 Br2 红棕 Si 灰黑 I2 紫黑 P 白、黄、红棕 二、氧化物:NO2 棕红 ClO2 黄 Na2O2 浅黄 K2O 黄 Pb3O4 红 MnO 绿 CuO 黑 MnO2黑 Ag2O 棕黑 FeO 黑 ZnO 白 Fe3O4 黑 Hg2O 黑 Fe2O3 红棕 HgO 红或黄 Cu2O 红
三、氧化物的水化物:Fe(OH)3红褐 HNO2 溶液亮蓝 Cu(OH)2 蓝
四、盐:CuFeS2 黄 ZnS 白 Ag2S 黑 FeS 黑棕 FeS2 黄 Sb2S3 黑或橙红 HgS 红 PbS 黑 CuS、Cu2S 黑 FeCl3·6H2O 棕黄 FeSO4·9H2O 蓝绿 Fe2(SO4)3·9H2O 棕黄 Fe3C 灰 FeCO3 灰 Ag2CO3 黄 Ag3PO4 黄 CuCl2 棕黄 AgF 黄 CuCl2·7H2O 蓝绿 AgCl白 CuSO4白 AgBr 浅黄 CuSO4·5H2O 蓝 AgI 黄 Cu2(OH)2CO3 暗绿
五、盐溶液中离子特色:Cu2+ 蓝 MnO4- 紫红 [CuCl4]2- 黄 Cr2O72- 橙红 Fe2+ 浅绿 Fe3+ 棕黄
六、非金属互化物:氯水 黄绿、 溴水 黄—橙 、碘水 黄褐、溴的有机溶液 橙红—红棕 、I2的有机溶液 紫红
七、其它:蛋白质遇浓HNO3变黄、 I2遇淀粉 变蓝、 TNT 淡黄 、Fe3+遇酚酞溶液 紫
气体小结
1 有毒的气体:H2S、Cl2、SO2、NO2、;CO、NO
2 有刺激性气味的气体:HCl、Cl2、SO2、NO2、NH3、
3 在空气中产生白雾的气体:HCl
4 不溶于水(能用排水法收集)的气体:H2、O2、N2、NO、CO、CH4、C2H4、C2H2
5 不能用排气法收集的气体 NO(氧化)、C2H4、CO(密度与空气近似)
6 溶于水显酸性的气体:HCl、SO2、NO2、H2S、CO2(能使湿润的蓝色石蕊试纸变红) Cl2(使湿润的蓝色石蕊试纸先变红,后褪色)
7 溶于水显碱性的气体:NH3
8 不能用浓硫酸干燥的气体:NH3(HI、HBr)
9 能用碱石灰干燥的气体不能用碱石灰干燥的气体:NH3酸性气体(HCl、SO2、NO2、H2S、CO2、Cl2)
第二篇:高中化学推断题--突破口归纳
高中化学推断题--突破口归纳
推断题是重点,也是难点。在各类考试中都占很大比例。今借此篇幅把与短周期中有关的常见突破口做一下总结,希望对同学们有所帮助。
一、位置与结构
1、Li是周期序数等于族序数2倍的元素。
2、S是最高正价等于最低负价绝对值3倍的元素。
3、Be、Mg是最外层电子数与最内层电子数相等的元素;
4、Li、Na是最外层电子数是最内电子数的1/2的元素;
5、最外层电子数是最内层电子数的2倍的是C、Si;3倍的是O、S;4倍的是Ne、Ar。
6、Be、Ar是次外层电子数等于最外层电子数的元素;
6、Mg是次外层电子数等于最外层电数4倍的元素;
7、Na是次外层电子数等于最外层电子数8倍的元素。
8、H、He、Al是原子最外层电子数与核外电子层数相等。
9、He、Ne各电子层上的电子数都满足2n2的元素。
10、H、He、Al是族序数与周期数相同的元素。
11、Mg是原子的最外层上的电子数等于电子总数的1/6的元素;
12、最外层上的电子数等于电子总数的1/3的是Li、P;1/2的有Be;相等的是H、He。
13、C、S是族序数是周期数2倍的元素。
14、O是族序数是周期数3倍的元素。
15、C、Si是最高正价与最低负价代数和为零的短周期元素。
16、O、F是最高正价不等于族序数的元素。
17、子核内无中子的原子 氢( H)
18、形成化合物种类最多的元素 碳
19、地壳中含量前三位的元素 O、Si、Al
20、大气中含量最多的元素 N
21、最外层电子数为次外层2倍的元素(或次外层电子数为最外层1/2的元素)C
22、最外层电子数为次外层3倍的元素(或次外层电子数为最外层1/3的元素) O
23、最外层电子数为次外层4倍的元素(或次外层电子数为最外层1/4的元素)Ne
24、最外层电子数为次外层电子数1/2的元素Li、Si
25、最外层电子数为次外层电子数1/4的元素 Mg
25、最外层电子数比次外层电子数多3个的元素N
26、最外层电子数比次外层电子数多5个的元素 F
27、最外层电子数比次外层电子数少3个的元素P
28、最外层电子数比次外层电子数多5个的元素 Al
29、核外电子总数与其最外层电子数之比为3:2的元素C
30、内层电子总数是最外层电子数2倍的原子有Li 、P
31、电子层数跟最外层电子数数相等的原子有H 、Be、 Al
32、核外电子总数与其最外层电子数之比为4:3的元素 O
33、最外层电子数是电子层数2倍的原子有关He、 C、 S
34、最外层电子数跟次外层电子数相等的原子有Be、Ar
35、X、Y两元素可形成X2Y和X2Y2两种化合物(或形成原子个数比2:1与1:1的化合物 Na2O、Na2O2 、H2O、H2O2
二、含量与物理性质
1、O是地壳中质量分数最大的元素,Si次之,Al是地壳中质量分数最大的金属元素。
2、H是最轻的非金属元素;Li是最轻的金属元素。
3、Na是焰色反应为黄色的元素;K是焰色反应为紫色(透过蓝色的钴玻璃观察)的元素。
4、Si是人工制得纯度最高的元素;C是天然物质中硬度最大的元素。
5、N是气态氢化物最易溶于水的元素;O是氢化物沸点最高的非金属元素。
6、常温下,F、Cl是单质具有有色气体的元素。
7、C是形成化合物种类最多的、最高价氧化物的含量增加会导致“温室效应”的元素。
8、Cl是单质最易液化的气体、最高价氧化物的水化物酸性最强的元素。
三、化学性质与用途
1、F是单质与水反应最剧烈的非金属元素。
2、N是气态氢化物与其最高价氧化物对应水化物能起化合反应的元素。
3、S是气态氢化物与其低价氧化物能反应生成该元素的元素。
4、P是在空气中能自燃的元素。
5、F是气态氢化物的水溶液可以雕刻玻璃的元素。
6、O是有两种同素异形体对人类生存最为重要的元素。
7、Mg是既能在CO2中燃烧,又能在N2中燃烧的金属单质。
8、Li、Na、F的单质在常温下与水反应放出气体的短周期元素。
四、 10电子微粒组
1、原子Ne 2、分子CH4、NH3、H2O、HF
3、阳离子Na+、Mg2+、Al3+、H3O+ 4、阴离子N3-、O2-、F-、OH-、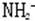
五、 18电子微粒组
1、原子Ar 2、分子SiH4、PH3、H2S、HCl、F2、H2O 、
3、阳离子K+、Ca2+、PH4+ 4、阴离子P3-、S2-、Cl-、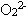
5、特殊情况:F2、H2O2、C2H6、CH3OH、CH3F 、N2H4
六、核外电子总数及质子数均相同的粒子有
1、Na+ 、 、H3O+ 2、F-、OH-、
、H3O+ 2、F-、OH-、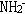 3、Cl-、HS-、 4、N2 、CO、C2H2
3、Cl-、HS-、 4、N2 、CO、C2H2
七、同族的上下周期元素原子序数之间的关系
1、二、三周期的同族元素原子序数之差为8。
2、三、四周期的同族元素原子序数之差为8或18,ⅠA、ⅡA为8,其他族为18。
3、四、五周期的同族元素原子序数之差为18。
4、五、六周期的同族元素原子序数之差为18或32。
5、六、七周期的同族元素原子序数之差为32。
特征现象
1.焰色反应:Na+(黄色)、K+(紫色)
2.浅黄色固体:S或Na2O2或AgBr或FeS2
3.有色溶液:Fe2+(浅绿色)、Fe3+(黄色)、Cu2+(蓝色)、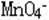 (紫色)
(紫色)
有色固体:红色(Cu、Cu2O、Fe2O3)、红褐色[Fe(OH)3] 、蓝色[Cu(OH)2] 、黑色(CuO、FeO、FeS、CuS、Ag2S、PbS) 、黄色(AgI、 Ag3PO4)、 白色[Fe(OH)2、CaCO3、BaSO4、AgCl、BaSO3]
有色气体:Cl2(黄绿色)、NO2(红棕色)
4.特征反应现象:Fe(OH)2→Fe(OH)3,白色到灰绿到红褐色
高中化学会考应知应会知识点条
一、 元素化合物:
卤族元素
1 遇淀粉变蓝的物质 I2(碘水、碘酒) 2 使淀粉—KI溶液变蓝的物质 Cl2 3 最强的含氧酸 HClO4 4 最稳定的气态氢化物 HF
5 描述下列实验现象:
(1)铜丝在氯气中燃烧 产生棕黄色的烟
(2)H2在Cl2中燃烧 产生苍白色的火焰
(3)CH4与Cl2混合光照 黄绿色变浅,瓶内壁有油状液滴
6 漂白粉的有效成分 Ca(ClO)2
7 检验Cl- 先加稀HNO3酸化,再加入AgNO3溶液,有白色沉淀
氧族元素
1 能使带火星的木条复燃的气体 O2
2 能使品红褪色的气体 SO2(颜色可复现)、Cl2(颜色不可复现)
3 能使澄清的石灰水变浑浊的气体 CO2、SO2
4 浓硫酸的特性 吸水性、脱水性、氧化性、难挥发
5 检查肠胃用作“钡餐”的 BaSO4
6 检验SO 先加稀盐酸酸化,再加入BaCl2溶液,有白色沉淀
7 某溶液加入盐酸产生刺激气味气体,该溶液中定含有: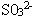
8 引发酸雨的污染物 SO2
氮族元素
1 常用作金属焊接保护气、代替稀有气体填充灯泡、保存粮食水果的气体 N2
2 在放电情况下才发生反应的两种气体 N2与O2
3 遇到空气立刻变红棕色的气体 NO
4 有颜色的气体 Cl2(黄绿色)、NO2(红棕色)
5 造成光化学烟雾的污染物 NO2
6 极易溶于水的气体 NH3、HCl
7 NH3喷泉实验的现象和原理 红色喷泉
8 NH3的空间结构 三角锥形
9 溶于水显碱性的气体 NH3
10 能使湿润的红色石蕊试纸变蓝的气体 NH3
11 两种气体相遇产生白烟 NH3遇HCl
12 某溶液加入NaOH溶液产生气体 气体一定是NH3;溶液一定含NH
13 检验某白色固体是铵盐的方法 加入浓NaOH溶液并加热,产生刺激气味能使湿润的红色石蕊试纸变蓝的气体,则固体为铵盐。
14 某溶液加入H2SO4的同时加入Cu.铜溶解溶液变蓝,该溶液中含有: 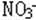
15 浓硝酸的特性 不稳定易分解、强氧化性、易挥发
16 王水的成分及特性 浓硝酸与浓盐酸1:3体积比混合具有极强的氧化性(溶解金、铂)
17 能使蛋白质变黄的物质 浓硝酸
18 火柴盒侧面的涂料 红磷
碳族
1 制造光导纤维的原料 SiO2
2 不能贮存在有磨口玻璃塞的玻璃瓶中的是 NaOH、KOH、(Na2SiO3)、NaF
碱金属
1 Na+的焰色K+的焰色 黄色紫色(隔蓝色钴玻璃观察)
2 钠与水反应的现象 钠漂浮在水面上,熔化成一个银白色小球,在水面到处游动,发出咝咝的声响,反应后滴入酚酞溶液变红。
3 能与Na2O2反应的两种物质 H2O、CO2
4 治疗胃酸过多的药品 NaHCO3
5 碱金属单质与盐溶液反应 (无法置换金属) 2Na + 2H2O + CuSO4 === Na2SO4 + Cu(OH)2↓+ H2↑
6 碳酸钠、碳酸氢钠的热稳定性比较 碳酸氢钠受热易分解
7 碳酸钠、碳酸氢钠的相互转化 NaHCO3加热生成Na2CO3Na2CO3溶液中通入过量CO2生成NaHCO3
Al、Mg、Fe金属
1 常用作净水剂的物质 明矾、Al(OH)3
2 常用作耐火材料的物质 Al2O3、MgO
3 既能溶于盐酸又能溶于NaOH溶液的物质 Al、Al2O3、Al(OH)3、NaHCO3、(NH4)2S
4 红褐色的沉淀 Fe(OH)3
5 红棕色的固体 Fe2O3
6 能发生钝化现象的两种金属 两种酸 Fe、Al浓硫酸、浓硝酸
有色物质
1 有颜色的气体 Cl2(黄绿色)、NO2(红棕色)
2 淡黄色的固体 Na2O2、S、AgBr、AgI(黄)
3 水溶液显蓝色的 含Cu2+的溶液(如CuSO4溶液)
4 水溶液显黄色的 含Fe3+的溶液(如FeCl3溶液)
一、 单质:Cu 紫红 Au 黄 S 黄 B 黄或黑 F2 淡黄绿 C(石墨) 黑 Cl2 黄绿 C(金刚石) 无 Br2 红棕 Si 灰黑 I2 紫黑 P 白、黄、红棕 二、氧化物:NO2 棕红 ClO2 黄 Na2O2 浅黄 K2O 黄 Pb3O4 红 MnO 绿 CuO 黑 MnO2黑 Ag2O 棕黑 FeO 黑 ZnO 白 Fe3O4 黑 Hg2O 黑 Fe2O3 红棕 HgO 红或黄 Cu2O 红
三、氧化物的水化物:Fe(OH)3红褐 HNO2 溶液亮蓝 Cu(OH)2 蓝
四、盐:CuFeS2 黄 ZnS 白 Ag2S 黑 FeS 黑棕 FeS2 黄 Sb2S3 黑或橙红 HgS 红 PbS 黑 CuS、Cu2S 黑 FeCl3·6H2O 棕黄 FeSO4·9H2O 蓝绿 Fe2(SO4)3·9H2O 棕黄 Fe3C 灰 FeCO3 灰 Ag2CO3 黄 Ag3PO4 黄 CuCl2 棕黄 AgF 黄 CuCl2·7H2O 蓝绿 AgCl白 CuSO4白 AgBr 浅黄 CuSO4·5H2O 蓝 AgI 黄 Cu2(OH)2CO3 暗绿
五、盐溶液中离子特色:Cu2+ 蓝 MnO4- 紫红 [CuCl4]2- 黄 Cr2O72- 橙红 Fe2+ 浅绿 Fe3+ 棕黄
六、非金属互化物:氯水 黄绿、 溴水 黄—橙 、碘水 黄褐、溴的有机溶液 橙红—红棕 、I2的有机溶液 紫红
七、其它:蛋白质遇浓HNO3变黄、 I2遇淀粉 变蓝、 TNT 淡黄 、Fe3+遇酚酞溶液 紫
气体小结
1 有毒的气体:H2S、Cl2、SO2、NO2、;CO、NO
2 有刺激性气味的气体:HCl、Cl2、SO2、NO2、NH3、
3 在空气中产生白雾的气体:HCl
4 不溶于水(能用排水法收集)的气体:H2、O2、N2、NO、CO、CH4、C2H4、C2H2
5 不能用排气法收集的气体 NO(氧化)、C2H4、CO(密度与空气近似)
6 溶于水显酸性的气体:HCl、SO2、NO2、H2S、CO2(能使湿润的蓝色石蕊试纸变红) Cl2(使湿润的蓝色石蕊试纸先变红,后褪色)
7 溶于水显碱性的气体:NH3
8 不能用浓硫酸干燥的气体:NH3(HI、HBr)
9 能用碱石灰干燥的气体不能用碱石灰干燥的气体:NH3酸性气体(HCl、SO2、NO2、H2S、CO2、Cl2)
与酸碱和水反应小结
1 金属与酸反应产生气体情况:(1) 与酸反应产生H2 (2) 与酸反应产生SO2 (3) 与酸反应产生NO2 (4) 与酸反应产生NO ①活动性顺序H以前的金属与盐酸、稀硫酸 ②Cu以前(含Cu)的金属与浓硫酸 ③Ag以前(含Ag)的金属与浓硝酸 ④Ag以前(含Ag)的金属与稀硝酸
2 常温下与水反应产生H2的产生O2的产生C2H2的 K、NaNa2O2、F2CaC2
3 既能溶于盐酸又能溶于NaOH溶液的物质 Al、Al2O3、Al(OH)3、NaHCO3、(NH4)2S
4 既不溶于水、又不溶于强酸的白色沉淀 AgCl、BaSO4
5 不能与水反应的酸性氧化物能与水反应的酸性氧化物 SiO2CO2、SO2、SO3等
6 能与水反应的碱性氧化物不能与水反应的碱性氧化物 K2O、Na2O、BaO、CaO(MgO)CuO、Fe2O3、Al2O3
其它
1 敞口放置质量会增加的溶液敞口放置质量会减少的溶液 浓硫酸(吸水)、碱溶液(吸CO2)浓盐酸、浓硝酸、浓氨水(挥发)
2 常采用电解法冶炼的金属常采用热还原法冶炼的金属常采用热分解法冶炼的金属 K、Ca、Na、Mg、AlZn、Fe、Sn、Pb、CuHg、Ag
3 合金的定义和性质 两种或以上金属或金属与非金属硬度比组分金属高,熔点比各组分低
4 与环境保护有关的知识:(1)酸雨(2)温室效应(3)光化学烟雾(4)破坏臭氧层(5)白色污染(6)水体富氧化(藻类疯长)(7)能保护环境的最好燃料 ①SO2 ②CO2 ③NO2 ④氟氯烃 ⑤塑料袋 ⑥含磷洗衣粉 ⑦H2
5 常见的漂白剂 (1)将有色物质氧化的:氯水(实为HClO)、Na2O2、H2O2、O3 (2)SO2(与有色物质结合成不稳定无色物)
无机化学
1、物质颜色
红色:Fe2O3、Fe(OH)3、FeSCN2+、Cu2O、Cu、NO2、Br2(g)、P; 橙色:Br2的溶液;
黄色:S、Na2O2、AgBr、AgI、Ag3PO4、Fe3+(aq)、久置浓HNO3; 绿色:Fe2+(aq)、绿矾、铜绿、浓CuCl2、Cu+浓HNO3;
蓝色:Cu2+(aq)、胆矾、Cu(OH)2; 紫色:石蕊、KMnO4、I2(g)、Fe3++C6H5OH;
黑色:多数过渡金属的氧化物以及硫化物、C、Fe等; 白色:CaCO3、BaSO4、AgCl、Mg(OH)2、Al(OH)3、MgO、Al2O3。
2、物质状态
液态单质:Br2、Hg; 液态化合物:H2O、H2O2、H2SO4、HNO3等;
气态单质:H2、N2、O2、F2、Cl2等; 气态化合物:C、N、S的氢化物及氧化物等。
3、反应现象或化学性质
(1)焰色反应:黄色—Na;紫色(钴玻璃)—K。
(2)与燃烧有关的现象:
火焰颜色:苍白色:H2在Cl2中燃烧; (淡)蓝色:H2、CH4、CO 等在空气中燃烧;
黄色:Na在Cl2或空气中燃烧; 烟、雾现象:棕(黄)色的烟:Cu或Fe在Cl2中燃烧;
白烟:Na在Cl2或P在空气中燃烧; 白雾:有HX等极易溶于水的气体产生;
白色烟雾:P在Cl2中燃烧。
(3)沉淀特殊的颜色变化:
白色沉淀变灰绿色再变红褐色:Fe(OH)2→Fe(OH)3; 白色沉淀迅速变棕褐色:AgOH→Ag2O。
(4)使湿润的红色石蕊试纸变蓝的气体:NH3;
(5)能使品红溶液褪色加热后又复原的气体:SO2;
(6)在空气中迅速由无色变成红棕色的气体:NO;
(7)使淀粉溶液变蓝的物质:I2;
(8)能漂白有色物质的淡黄色固体:Na2O2;
(9)在空气中能自燃的固体:P4;
(10)遇SCN-变红色、OH-产生红褐色沉淀、苯酚显紫色的离子:Fe3+;
(11)不溶于强酸和强碱的白色沉淀:AgCl、BaSO4;
(12)遇Ag+生成不溶于硝酸的白色、浅黄色、黄色沉淀的离子分别是:Cl-、Br-、I-。
(13)可溶于NaOH的白色沉淀:Al(OH)3、H2SiO3;金属氧化物:Al2O3;
(14)可溶于HF的酸性氧化物:SiO2;
(15)能与NaOH溶液反应产生气体的单质:Al、Si、;化合物:铵盐;
(16)能与浓硫酸、铜片共热产生红棕色气体的是:硝酸盐;
(17)通入二氧化碳产生白色胶状沉淀且不溶于任何强酸的离子:SiO32-;
(18)溶液中加酸产生的气体可能是:CO2、SO2、H2S; 溶液中存在的离子可能是: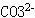 、
、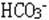 、
、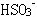 、
、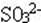 、
、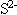 、
、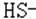 、
、
(19)同一元素的气态氢化物和最高价氧化物对应水化物能反应生成盐的元素:N;
(20)与酸、碱都能反应的无机物:Al、Al2O3、Al(OH)3、弱酸酸式盐、弱酸弱碱盐等;
(21)能与水反应生成气体的物质:K、Na、NaH;Na2O2、CaC2及Mg3N2、Al2S3等;
(22)既有气体又有沉淀生成的反应:Ba(OH)2、Ca(OH)2与NH4HCO3、(NH4)2SO4等;
(23)先沉淀后溶解的反应: 、
、 、
、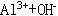 、
、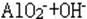 、
、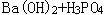 等;
等;
(24)见光易分解的物质:HClO、HNO3、AgCl、AgBr、AgI;
(25)使用催化剂的反应:合成氨、三氧化硫的生成、氨的催化氧化、制氧气等。
4、特殊的反应类型: 往往是题目的隐性突破口。
(1)单质A + 化合物B → 单质C + 化合物D
即置换反应,可以是金属置换出金属(最常见的是铝热反应)或金属置换出非金属(被置换出来的非金属应该是还原产物,而还原产物在一定条件下具有一定的还原性,故通常是H2或C),也可以是非金属置换出非金属(常见的是卤素单质之间的置换或F2置换出O2、当然卤素都能置换出S,另外C可以置换出Si、H2)或非金属置换出金属(此时的非金属必作还原剂,而常见的还原性非金属只有C和H2)。
(2)A 的化合物 + A的化合物 → A 的单质 + 化合物B
该反应通常是一个归中到单质的反应,该单质必为非金属单质,常见的是S、Cl2、N2。
(3)单质A + 强碱 →两种含A 元素的化合物
该反应是一个碱性歧化反应,单质A 通常是X2或S;
(4)单质A + 单质B → 化合物C ;C + 单质A → 化合物D
综合以上两个反应,可知A、B两种元素可以形成C、D两种以上的化合物,其中必定有一种元素有变价。若有变价的元素是金属,则必为Fe;若有变价的元素为非金属则该元素通常是C、N、S或O等,故以上C、D分别是NO、NO2或CO、CO2、或SO2、SO3或Na2O、Na2O2等。
(5)一种物质分解得到两种以上产物:
常见的有KMnO4、NaHCO3、NH4HCO3、(NH4)2CO3、NH4I、Cu2(OH)2CO3等的分解。
(6)多种物质化合得到一种物质:
如Fe(OH)2+O2+H2O;NOx+O2+H2O等
(7)电解类型(惰性电极):
生成两种产物:电解质分解型或电解水型或熔融的NaCl等。
生成三种产物:放氧生酸型或放氢生碱型。
生成三种气体:电解氨水或NH4Cl溶液。
(8)与化工生产有关的反应:
如制漂白粉、制生石灰、工业合成氨、氯碱工业、硫酸工业、硝酸工业、玻璃工业等。
二、有机化学:
1 检验酒精中是否含水 无水CuSO4,变蓝
2 能使溴水褪色的 烯、炔(苯、烷不能)
3 能使KMnO4酸性溶液褪色的 烯、炔(苯、烷不能)
4 能发生加聚反应的 含C=C双键的(如烯)
5 能发生消去反应的是 乙醇(浓硫酸,170℃)
6 能发生酯化反应的是 醇和酸
7 燃烧产生大量黑烟的是 C2H2、C6H6
8 属于天然高分子的是 淀粉、纤维素、蛋白质、天然橡胶(油脂、麦芽糖、蔗糖不是)
9 属于三大合成材料的是 塑料、合成橡胶、合成纤维
10 常用来造纸的原料 纤维素
11 常用来制葡萄糖的是 淀粉
12 能发生皂化反应的是 油脂
13 水解生成氨基酸的是 蛋白质
14 水解的最终产物是葡萄糖的是 淀粉、纤维素、麦芽糖
15 能与Na2CO3或NaHCO3溶液反应的是 乙酸
16 有毒的物质是 甲醇(含在工业酒精中);NaNO2(亚硝酸钠,工业用盐)
17 能与Na反应产生H2的是 含羟基的物质(如乙醇、苯酚)
18 能发生水解的是 酯、油脂、二糖、多糖、蛋白质
19 能还原成醇的是 醛
20 能作植物生长调节剂、水果催熟剂的是 乙烯
21 能作为衡量一个国家石油化工水平的标志的是 乙烯的产量
22 通入过量的CO2溶液变浑浊的 C6H5ONa溶液
23 不能水解的糖 单糖(如葡萄糖)
24 能发生银镜反应的(或与新制的Cu(OH)2共热产生红色沉淀的) 醛、葡萄糖、麦芽糖
25 不溶于水的有机物 液态烃(苯、汽油等)、乙酸乙酯
26 易溶于水的有机物 甘油、乙醇、乙醛、乙酸
27 可用于环境消毒的 苯酚
28 皮肤上沾上苯酚用什么清洗 酒精
29 写出下列分子中含有的官能团的名称、结构简式:(1)乙醇; (2)乙醛; (3)乙酸; (4)硝基苯
①羟基—OH ②醛基—CHO ③ 羧基—COOH ④硝基—NO2
30 写出下列有机反应类型:(1) 甲烷与氯气光照反应(2) 从乙烯制聚乙烯(3) 乙烯使溴水褪色(4) 从乙醇制乙烯(5) 从乙醛制乙醇(6) 从乙酸制乙酸乙酯(7) 乙酸乙酯与NaOH溶液共热(8) 油脂的硬化(9) 从乙烯制乙醇(10) 从乙醛制乙酸
(1) 取代(2) 加聚(3) 加成(4) 消去(5) 还原(6) 酯化(7) 水解(8) 加成(或还原)(9) 加成(10) 氧化
31 加入浓溴水产生白色沉淀的是 苯酚
32 加入FeCl3溶液显紫色的 苯酚
33 能使蛋白质发生盐析的两种盐 Na2SO4、(NH4)2SO4
34 写出下列通式:(1)烷;(2)烯;(3)炔 (1)CnH2n+2;(2)CnH2n;(3)CnH2n-2
三、化学实验:
1 能在酒精灯火焰上直接加热的仪器 试管、坩埚、蒸发皿、燃烧匙
2 需要垫石棉网加热的仪器 烧杯、烧瓶、锥形瓶
3 用固—固加热装置制取的气体用固—液加热装置制取的气体用固—固不加热装置制取的气体 O2、NH3Cl2、C2H4H2、CO2、C2H2
4 制取以下气体需要加热的:制取以下气体不需要加热的: (1) 用MnO2与浓HCl制Cl2(2) 用乙醇和浓H2SO4制C2H4(3) 用KClO3和MnO2制O2(4) 用Cu和稀HNO3制NO(5) 用NH4Cl和Ca(OH)2制NH3
(1) 用Zn和稀H2SO4制H2(2) 用CaCO3和稀HCl制CO2(3) 用CaC2和H2O制C2H2(4) 用Cu和浓HNO3制NO2
5 需要保存在棕色瓶中的物质 氯水、浓硝酸、AgNO36 一元强酸与一元一元强碱恰好中和的计算公式(求未知碱浓度) C(酸)V(酸)==C(碱)V(碱)
四、俗名总结:
1 甲烷 沼气、天然气、坑气、瓦斯气的主要成分 11 Na2CO3 纯碱、苏打
2 乙炔 电石气 12 NaHCO3 小苏打
3 乙醇 酒精 13 CuSO4·5H2O 胆矾、蓝矾
4 丙三醇 甘油 14 SiO2 石英、硅石
5 苯酚 石炭酸 15 CaO 生石灰
6 甲醛 蚁醛 16 Ca(OH)2 熟石灰、消石灰
7 乙酸 醋酸 17 CaCO3 石灰石、大理石
8 三氯甲烷 氯仿 18 Na2SiO3水溶液 水玻璃
9 NaCl 食盐 19 KAl(SO4)2·12H2O 明矾
10 NaOH 烧碱、火碱、苛性钠 20 CO2固体 干冰
一、硫酸盐类:
1.皓矾: ZnSO47H2O 2.钡餐,重晶石: BaSO4
3.绿矾: FeSO4.7H2O 4.芒硝: NaSO4.10H2O
5.明矾: KAl(SO4) 2.12H2O
二、矿石类:
1. 莹石:CaF2 2.光卤石: KCl.MgCl2.6H2O
3. 黄铜矿: CuFeS2 4. 矾土:Al2O3.H2O、Al2O3.3H2O和少量Fe2O3 、SiO2
5.磁铁矿石: Fe3O4 6.赤铁矿石:Fe2O3
7. 褐铁矿石: 2Fe2O3.3H2O 8.菱铁矿石:Fe2CO3
9.镁铁矿石:Mg2SiO4 10. 苏口铁:碳以片状石墨形式存在
11. 白口铁:碳以FeC3形式存在
12. 高岭石: Al2 (Si2O5)(OH) 4 或(Al2O3·2SiO2·2H2O)
13.正长石: KAlSi3O8 14. 石英:SiO2
15.硼砂: Na2B4O7.10H2O 16. 脉石:SiO2
17.刚玉(蓝宝石.红宝石): 天然产的无色氧化铝晶体
三、气体类:
1.高炉煤气:CO,CO2等混合气体 2. 水煤气CO,H2
3. 天然气(沼气):CH4
四、有机类:
1. 福马林(蚁醛): HCHO 2. 蚁酸:HCOOH
3.尿素: (NH4CNO)或 CO(NH2) 2 4. 氯仿: CCl4
5.木精(工业酒精):CH3OH 6. 甘油: CH2OH-CHOH- CH2OH
7.硬脂酸:C17H35COOH 8.软脂酸: C15H31COOH
9. 油酸: C17H33OH 10.肥皂:C17H35COONa
11.银氨溶液:[Ag(NH3) 2]+ 12.乳酸:CH3-CHOH-COOH
13.葡萄糖:C6H12O6 14.蔗糖:C12H22O11
15.核糖:CH2OH-(CHOH) 3CHO 16.脱氧核糖:CH2OH-(CHOH) 2CH2-CH 3
17.淀粉: (C6H10O5)n
18.火棉,胶棉:主要成份都是[(C6H7O2)-(ONO2) 3] n 只是前者含N量高
五、其他类:
1. 白垩: CaCO3 2.石灰乳:Ca(OH) 2 3. 熟石灰: 2CaSO4.H2O 4. 足球烯: C60 5.铜绿:Cu2(OH)2CO3
6. 纯碱: Na2CO3 7.王水: HCl,HNO3 (3:1) 8. 水玻璃(泡火碱) :Na2SiO3 9.小苏打:NaHCO3
10.苏打:Na2CO3 11. 大苏打:Na2S2O3 12.盐卤:MgCl2.6HO
