高中化学教材常考实验总结及命题方式解读
前言:化学实验在高考题的比重是越来越大,目前高考实验命题的特点有二:一是突出考查实验的基础知识和基本操作能力,二是突出考查实验探究能力,这一点在考试大纲中已有明确要求。课本实验往往成为考查学生实验探究能力命题的载体。因此,课本实验的重要性就不言而喻了,针对目前实验在教材中的分布比较分散,学生又难以掌握的现状,我组织了组内老师进行了整理,现发给你们。
一、配制一定物质的量浓度的溶液
以配制100mL1.00mol/L的NaOH溶液为例:
 1、步骤:(1)计算 (2)称量:4.0g(保留一位小数)(3)溶解(4)转移:待烧杯中溶液冷却至室温后转移(5)洗涤 (6)定容:将蒸馏水注入容量瓶,当液面离刻度线1—2cm时,改用胶头滴管滴加蒸馏水至凹液面最低点与刻度线在同一水平线上(7)摇匀:盖好瓶塞,上下颠倒、摇匀 (8)装瓶贴标签 :标签上注明药品的名称、浓度。
1、步骤:(1)计算 (2)称量:4.0g(保留一位小数)(3)溶解(4)转移:待烧杯中溶液冷却至室温后转移(5)洗涤 (6)定容:将蒸馏水注入容量瓶,当液面离刻度线1—2cm时,改用胶头滴管滴加蒸馏水至凹液面最低点与刻度线在同一水平线上(7)摇匀:盖好瓶塞,上下颠倒、摇匀 (8)装瓶贴标签 :标签上注明药品的名称、浓度。
2、 所用仪器:(由步骤写仪器)
托盘天平、药匙、烧杯、玻璃棒、(量筒)、100mL容量瓶、胶头滴管
3、 注意事项:
(1) 容量瓶:只有一个刻度线且标有使用温度和量程规格,只能配制瓶上规定容积的溶液。(另外使用温度和量程规格还有滴定管、量筒)
(2) 常见的容量瓶:50 mL、100mL、250mL、500mL、1000mL。若配制480mL与240mL溶液,应分别用500mL容量瓶和250mL容量瓶。写所用仪器时,容量瓶必须注明规格,托盘天平不能写成托盘天秤!
(3) 容量瓶使用之前必须查漏。方法:向容量瓶内加少量水,塞好瓶塞,用食指顶住瓶塞,用另一只手的五指托住瓶底,把瓶倒立过来,如不漏水,正立,把瓶塞旋转1800后塞紧,再倒立若不漏水,方可使用。(分液漏斗与滴定管使用前也要查漏)
(4)命题角度:一计算所需的固体和液体的量,二是仪器的缺失与选择,三是实验误差分析。
二、Fe(OH)3胶体的制备:
1、步骤:向沸水中加入FeCl3的饱和溶液,继续煮沸至溶液呈红褐色,停止加热。
操作要点:四步曲:①先煮沸,②加入饱和的FeCl3溶液,③再煮沸至红褐色,④停止加热
2、涉及的化学方程式:Fe3++3H2O 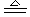 Fe(OH)3(胶体)+3H+
Fe(OH)3(胶体)+3H+
强调之一是用等号,强调之二是标明胶体而不是沉淀,强调之三是加热。
3、命题角度:配制步骤及对应离子方程式的书写
三、焰色反应:
1、 步骤:洗—烧—蘸—烧—洗—烧
2 、该实验用铂丝或铁丝
3 、焰色反应可以是单质,也可以是化合物,是物理性质
4 、Na ,K 的焰色:黄色,紫色(透过蓝色的钴玻璃)
5 、某物质作焰色反应,有黄色火焰一定有Na ,可能有K
6、命题角度:实验操作步骤及Na ,K 的焰色
四、Fe(OH)2的制备:
1、实验现象:白色沉淀立即转化灰绿色,最后变成红褐色沉淀。
2、化学方程式为:Fe2++2OH-=Fe(OH)2 4e(OH)2+O2+2H2O= 4e(OH)3
3、注意事项:(1)所用亚铁盐溶液必须是新制的,NaOH溶液必须煮沸,(2)滴定管须插入液以下,(2)往往在液面加一层油膜,如苯或食物油等(以防止氧气的氧化)。
4、命题角度:制备过程中的现象、方程式书写及有关采取措施的原因
五、重要离子的检验:
1、Cl-的检验:加入AgNO3溶液,再加入稀硝酸,若生成不溶于稀HNO3的白色沉淀;或先加硝酸化溶液(排除CO32-干扰),再滴加AgNO3溶液,如有白色沉淀生成,则说明有Cl-存在
2、SO42-的检验:先加入盐酸,若有白色沉淀,先进行过滤,在滤液中再加入BaCl2溶液,生成白色沉淀即可证明。若无沉淀,则在溶液中直接滴入BaCl2溶液进行检验。
命题角度:检验方法、除杂、沉淀洗涤及相关纯度的计算
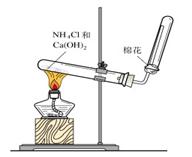 六、氨气的实验室制法
六、氨气的实验室制法
1、反应原理 :2NH4Cl+Ca(OH)2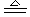 CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
2、收集:向下排空气法(管口塞一团棉花,避免空气对流)
3、验满:①将湿润的红色石蕊试纸放在试管口,若试纸变蓝,说明氨气已收集满 ②将蘸有浓盐酸的玻璃棒靠近试管口,出现大量白烟,则证明氨气已收集满
4、干燥方法:碱石灰干燥(不能无水氯化钙)
5、装置图:固体和固体加热制气体的装置,与制氧气的相同
拓展:浓氨水或浓铵溶液滴到生石灰或烧碱中制氨气,或浓氨水直接加热也可制氨气
6、命题角度:因氨气作为中学化学实验制取气体中唯一的实验,其地位不可估量。主要角度为:反应原理、收集、干燥及验满等,并以此基础进行性质探究实验。
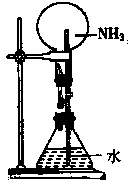 七、喷泉实验
七、喷泉实验
1、实验原理:氨气极易溶于水,挤压胶头滴管,
少量的水即可溶解大量的氨气(1:700),使烧瓶内压强迅速减小,
外界大气压将烧杯中的水压入上面的烧瓶,
故NH3、HCl、 HBr 、HI、 SO2 等
气体均能溶于水形成喷泉。
2、实验现象:产生红色喷泉(氨气溶于水形成碱性溶液,酚酞遇碱显红色)
3、实验关键:①氨气应充满 ②烧瓶应干燥 ③装置不得漏气
4、实验拓展:CO2、H2S、Cl2 等与水不能形成喷泉,但与NaOH溶液可形成喷泉
 八、铜与浓硫酸反应的实验
八、铜与浓硫酸反应的实验
1、实验原理:Cu+2H2SO4(浓) 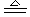 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
2、现象:加热之后,试管中的品红溶液褪色,
或试管中的紫色石蕊试液变红;将反应后的溶液倒入盛有水的烧杯中,溶液由黑色变成蓝色。
 3、原因解释:变黑的物质为被浓硫酸氧化生成CuO,CuO与冲稀的硫酸反应生成了CuSO4溶液。
3、原因解释:变黑的物质为被浓硫酸氧化生成CuO,CuO与冲稀的硫酸反应生成了CuSO4溶液。
【提示】由于此反应快,利用铜丝,便于及时抽出,减少污染。
命题角度:SO2的性质及产物的探究、“绿色化学”及尾气的处理等。
九、铝热反应:
1、实验操作步骤:把少量干燥的氧化铁和适量的铝粉均匀混合后放在纸漏斗中,在混合物上面加少量氯酸钾固体中,中间插一根用砂纸打磨过的镁条,点燃。
2、实验现象:立即剧烈反应,发出耀眼的光芒,产生大量的烟,纸漏斗被烧破,有红热状态的液珠,落入蒸发皿内的细沙上,液珠冷却后变为黑色固体。
3、化学反应方程式:Fe2O3+2Al  2Fe+Al2O3
2Fe+Al2O3
4、注意事项:
(1)要用打磨净的镁条表面的氧化膜,否则难以点燃。
(2)玻璃漏斗内的纸漏斗要厚一些,并用水润湿,以防损坏漏斗
(3)蒸发皿要垫适量的细沙:一是防止蒸发皿炸裂,二是防止熔融的液体溅出伤人。
(4)实验装置不要距人太近,防止使人受伤。
5、命题角度:实验操作步骤及化学方程式。
十、酸碱中和滴定实验(了解):(以一元酸与一元碱中和滴定为例)
1、原理:C酸V酸=C碱V碱
2、要求:①准确测算的体积. ②准确判断滴定终点
3、酸式滴定管和碱式滴定管的构造:①0刻度在滴定管的上端,注入液体后,仰视读数数值偏大 ②使用滴定管时的第一步是查漏 ③滴定读数时,记录到小数点后两位 ④滴定时一般用酚酞、甲基橙作指示剂,不用石蕊试液。④酸碱式滴定管不能混用,如酸、具有氧化性的物质一定用酸式滴定管盛装。
4、操作步骤(以0.1 molL-1的盐酸滴定未知浓度的氢氧化钠溶液为例)
①查漏、洗涤、润洗
②装液、赶气泡、调液面、注液(放入锥形瓶中)
③滴定:眼睛注视锥形瓶中溶液中溶液颜色的变化,当滴到最后一滴,溶液颜色发生明显变化且半分钟内部不变色即为滴定终点
5、命题角度:滴定管的结构、读数及中和滴定原理。
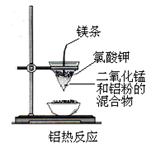
十一、氯碱工业:
1、实验原理:电解饱和的食盐水的电极反应为:2NaCl+2H2O 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
 2、应用:电解的离子方程式为2Cl-+2H2O
2、应用:电解的离子方程式为2Cl-+2H2O 2OH-+H2↑+Cl2↑,阴极产物是H2和NaOH,阴极被电解的H+是由水电离产生的,故阴极水的电离平衡被破坏,阴极区溶液呈碱性。若在阴极区附近滴几滴酚酞试液,可发现阴极区附近溶液变红。阳极产物是氯气,将湿润的KI淀粉试纸放在阳极附近,试纸变蓝。
2OH-+H2↑+Cl2↑,阴极产物是H2和NaOH,阴极被电解的H+是由水电离产生的,故阴极水的电离平衡被破坏,阴极区溶液呈碱性。若在阴极区附近滴几滴酚酞试液,可发现阴极区附近溶液变红。阳极产物是氯气,将湿润的KI淀粉试纸放在阳极附近,试纸变蓝。
3、命题角度:两极上析出产物的判断、产物的性质及相关电解原理
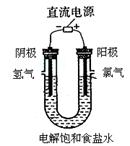
十二、电镀:
 (1)电镀的原理:与电解原理相同。电镀时,一般用含有镀层金属阳离子的电解质溶液作电镀液,把待镀金属制品浸入电镀液中,与直流电源的负极相连,作阴极;用镀层金属作阳极,与直流电源的正极相连,阳极金属溶解,成为阳离子,移向阴极,这些离子在阴极上得电子被还原成金属,覆盖在镀件的表面。
(1)电镀的原理:与电解原理相同。电镀时,一般用含有镀层金属阳离子的电解质溶液作电镀液,把待镀金属制品浸入电镀液中,与直流电源的负极相连,作阴极;用镀层金属作阳极,与直流电源的正极相连,阳极金属溶解,成为阳离子,移向阴极,这些离子在阴极上得电子被还原成金属,覆盖在镀件的表面。
(2)电镀池的组成:待镀金属制品作阴极,镀层金属作阳极,含有镀层金属离子的溶液作电镀液,阳极反应:M – ne- =Mn+(进入溶液),阴极反应Mn+ + ne- =M(在镀件上沉积金属)
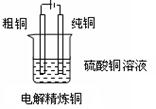 十三、铜的精炼:
十三、铜的精炼:
(1)电解法精炼炼铜的原理:
阳极(粗铜):Cu-2e-=Cu2+、Fe-2e-=Fe2+
阴极 (纯铜):Cu2++2e-=Cu
(2)问题的解释:铜属于活性电极,电解时阳极材料发生氧化反应而溶解。粗铜中含有Zn、Ni、Fe、Ag、Au等多种杂质,当含有杂质的铜在阳极不断溶解时,位于金属活动性顺序表铜以前的金属杂质,如Zn、Ni、Fe、等也会同时失去电子,但它们的阳离子得电子能力比铜离子弱,难以被还原,所以并不能在阴极上得电子析出,而只能留在电解液里,位于金属活动性表铜之后的银、金等杂质,因失去电子的能力比铜更弱,难以在阳极失去电子变成阳离子溶解,所以以金属单质的形式沉积在电解槽底,形成阳极泥(阳极泥可作为提炼金、银等贵重金属的原料)。
(3)命题角度:精炼原理及溶液中离子浓度的变化
十四、卤代烃中卤原子的检验方法(取代反应、消去反应):
1、实验步骤:

2、若为白色沉淀,卤原子为氯;若浅黄色沉淀,卤原子为溴;若黄色沉淀,卤原子为碘
3、卤代烃是极性键形成的共价化合物,只有卤原子,并无卤离子,而AgNO3只能与X—产全AgX沉淀,故必须使卤代烃中的—X转变为X—,再根据AgX沉淀的颜色与质量来确定卤烃中卤原子的种类和数目,
4、加入硝酸银溶液之前,须加入硝酸酸化中和掉混合液中的碱液方可。
5、用酸性KMnO4溶液验证消去反应产物乙烯时,要注意先通入水中除去乙醇,再通入酸性KMnO4溶液中;也可用溴水直接检验(则不用先通入水中)。
十五、乙酸乙酯的制备
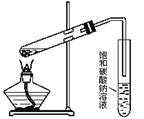 注意事项:1、先加乙醇,再加浓硫酸和乙酸的混合液;2、低温加热小心均匀的进行,以防乙酸、乙醇的大量挥发和液体剧烈沸腾;3、导气管末端不要插入饱和Na2CO3液体中,防液体倒吸。
注意事项:1、先加乙醇,再加浓硫酸和乙酸的混合液;2、低温加热小心均匀的进行,以防乙酸、乙醇的大量挥发和液体剧烈沸腾;3、导气管末端不要插入饱和Na2CO3液体中,防液体倒吸。
4、用饱和Na2CO3溶液吸收主要优点:
①吸收乙酸,便于闻于乙酸乙酯的香味 ②溶解乙醇 ③ 降低乙酸乙酯的溶解度,分层,观察乙酸乙酯
5、本反应的副反应:C2H5-OH+ HO-C2H5 C2H5-O-C2H5+H2O
C2H5-O-C2H5+H2O
C+2H2SO4(浓) CO2↑+2SO2↑+ 2H2O
CO2↑+2SO2↑+ 2H2O
6、命题角度:加入药品顺序、导管的位置、饱和Na2CO3溶液的作用及考查运用化学平衡提高乙酸乙酯转化率的措施。
十六、醛基的检验(以乙醛为例):
A:银镜反应
1、银镜溶液配制方法:在洁净的试管中加入1ml 2%的AgNO3溶液(2)然后边振荡试管边逐滴加入2%稀氨水,至最初产生的沉淀恰好溶解为止,制得银氨溶液。
反应方程式:AgNO3+NH3·H2O=AgOH+ NH4 NO3 AgOH+2 NH3·H2O=Ag(NH3)2OH+2H2O
2、银镜实验注意事项:(1)沉淀要恰好溶解(2)银氨溶液随配随用,不可久置
(3)加热过程不能振荡试管 (4)试管要洁净
3、做过银镜反应的试管用稀HNO3清洗
B:与新制Cu(OH)2悬浊液反应:
1、Cu(OH)2悬浊液配制方法:在试管里加入10%的NaOH溶液2ml,滴入2%的CuSO4溶液4—6滴,得到新制的氢氧化铜悬浊液
2、注意事项:(1)Cu(OH)2必须是新制的(2)要加热至沸腾(3)实验必须在碱性条件下(NaOH要过量)
第二篇:11-12上教师实验总结
和 谐 德 育 实 验 总 结
2011--2012学年度第一学期
蒙军利
时间过得真快,转眼间,紧张的一学期又结束了,在本学期中,为了搞好本班的班风、学风,促进学生全面发展,提高少年儿童德、智、体、美、劳多方面的素质,主要做了下面几点工作:
一、加强学生思想教育,培养学生的良好习惯。
1、进一步加强学生的品德教育,根据班级学生情况,再向学生讲解学校开展的“流动红旗评分”活动的具体要求。特别提醒新转入的同学,要求班上的每一位成员一定按照学校的要求去做。强调争创“书香班级”的具体做法。使学生养成良好的学习和生活习惯。
2、合理利用品德课,重大节日,加强学生的德育教育。这学期举行《老师,您辛苦了》、《文明这花开心中》、有意义的主题班队会,使学生懂得做人的道理,培养其爱国主义情感,同时让学生在各种活动和劳动中学会合作,学会生活。
3、集体主义精神要求个人的行为融入集体之中,个人要服从集体。由于家庭、社会等多方面的影响,学生自我意识较强,缺乏顾全大局的意识和行为的自觉性。所以,开学来,通过学校的两操、“十佳歌手”比赛等各种丰富多彩的活动,增强学生的集体荣誉感,树立集体意识,教育学生团结协作、互帮互学,增进友谊,大家共同进步,并通过参与,培养学生的一荣俱荣、一损俱损的集体意识,大大增进了集体的凝聚力。在各种活动中,我班学生表现的都很令我满意。
4、常抓常规管理,初步养成良好习惯学生。从早晨上学到放学,一日的常规是否规范、文明,影响到良好集体的形成及学生各方面的发展。在班主任工作中,我主要从小事抓起,抓好常规管理,培养学生良好的学习、生活习惯,为学生创设一个和谐、整洁的学习、生活环境。学期初,我就根据班中的实际情况,把班上学生平均分成八个大组,每组明确了各个组员的岗位负责。如:红领巾佩带检查员、两操检查员、班级卫生检查员、课桌检查员、纪律检查员等。同时,我利用班队会让全班同学讨论,明确小学生应做到哪些,不能做哪些。我又组织学生每周进行总结评比,表彰日常行为规范好的同学,评为优胜星,贴到光荣栏里,以此不断强化,帮助学生初步养成良好的学习、生
活习惯。
二、做好家访工作。
老师要教好学生,除了做好校内的教育、管理外,还要做好校外的工作,要与家长联系,取得家长协助,才能把学生教育好。平时我都注意做好这个工作,特别是那些顽皮、学习习惯不太好的同学,更要与家长共同管教。以前有七、八个同学经常不按时完成作业,做事总是拖拖拉拉,得过且过。因此,我及时联系家长,向家长反映孩子在校表现,并于家长共同商量解决办法,对家长提出加强对孩子的监督管理和家庭辅导的要求。后来,经过老师和家长的多次教育,这一部分学生现在改变很大,基本能及时完成作业了,学习成绩也提高了不少。
三、确实做好学生的安全教育工作。
这一学期“安全教育”是教学工作的一个重点,教师会议及校会中已多次调强“安全教育”问题,所以“安全工作”务必要彻底做好。几乎每天上课我都要抽出几分钟进行安全教育,教育学生遵守交通规则,注意防火、防触电、人身安全,不下河洗澡,不到危险地带玩耍,注意食品安全,不购买小摊小贩出售的不洁食品。狠抓了学生的路队、课间操、课间休息及上放学路上、校外安全教育,成立了学生安全自治小组等,始终把学生的安全工作放在各项工作的首位,本学期没有发生不安全的事件。
