第二章 误差和分析数据处理
1、 指出下列各种误差是系统误差还是偶然误差?如果是系统误差,请区别方法误差、仪器和试剂误差或操作误差,并给出它们的减免方法。
答:①砝码受腐蚀:
系统误差(仪器误差);更换砝码。
②天平的两臂不等长:
系统误差(仪器误差);校正仪器。
③容量瓶与移液管未经校准:
系统误差(仪器误差);校正仪器。
④在重量分析中,试样的非被测组分被共沉淀:
系统误差(方法误差);修正方法,严格沉淀条件。
⑤试剂含被测组分:
系统误差(试剂误差);做空白实验。
⑥试样在称量过程中吸潮:
系统误差(操作误差);严格按操作规程操作。
⑦化学计量点不在指示剂的变色范围内:
系统误差(方法误差);另选指示剂。
⑧读取滴定管读数时,最后一位数字估计不准:
偶然误差;严格按操作规程操作,增加测定次数。
⑨在分光光度法测定中,波长指示器所示波长与实际波长不符:
系统误差(仪器误差);校正仪器。
⑩在HPLC测定中,待测组分峰与相邻杂质峰部分重叠
系统误差(方法误差);改进分析方法
6、两人测定同一标准试样,各得一组数据的偏差如下:

① 求两组数据的平均偏差和标准偏差;
② 为什么两组数据计算出的平均偏差相等,而标准偏差不等;
③ 哪组数据的精密度高?
解:①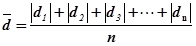



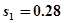

②标准偏差能突出大偏差。
③第一组数据精密度高。
7、测定碳的相对原子质量所得数据:12.0080、12.0095、12.0099、12.0101、12.0102、12.0106、12.0111、12.0113、12.0118及12.0120。求算:①平均值;②标准偏差;③平均值的标准偏差;④平均值在99%置信水平的置信限。
解:①
②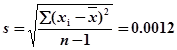
③
④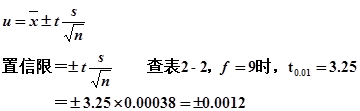
8、在用氯丁二烯氯化生产二氯丁二烯时,产品中总有少量的三氯丁二烯杂质存在。分析表明,杂质的平均含量为1.60%。改变反应条件进行试生产,取样测定,共取6次,测定杂质含量分别为:1.46%、1.62%、1.37%、1.71%、1.52%及1.40%。问改变反应条件后,产品中杂质百分含量与改变前相比,有明显差别吗?(α=0.05时)
解: 

查表2-2,t5,0.05=2.571,t计算 < t临界值。
所以,改变反应条件后,杂志含量与改变前无明显差别。
9、解:HPLC数据 :
97.2%,98.1%,99.9%,99.3%,97.2%,98.1%(6次)

化学法数据:
97.8%,97.7%,98.1%,96.7% ,97.3%(5次)
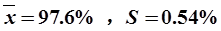
①用F检验两种方法结果的精密度是否存在显著差别

用t检验平均值是否有显著性差别
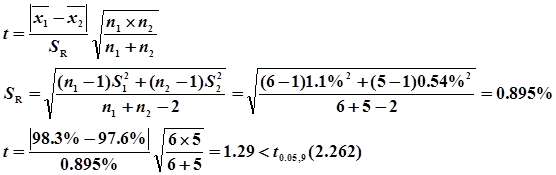
说明两种方法的平均值没有显著差别。
②在该项分析中,HPLC法可以代替化学法。
10、解:①

11、解:

第三章 滴定分析法概论
1、解:不可直接配制标准溶液的物质:
NaOH,化学性质不稳定 HCl,不是固体,难得到纯净物
H2SO4,不是固体 KMnO4,难制得纯度高的纯净物
Na2S2O3,难制得纯净物,化学性质不稳定
2、答:草酸晶体部分风化后标定氢氧化钠溶液浓度结果偏低(称取一定质量基准物,实际物质的量超过计算值,消耗了更多的氢氧化钠,浓度标定结果偏低),用此氢氧化钠溶液测定有机酸摩尔质量时结果偏低;碳酸钠吸潮带有少量水分后标定盐酸溶液浓度结果偏高(称取一定质量基准物,实际物质的量小于计算值,消耗了更少的盐酸,浓度标定结果偏高),用此盐酸溶液测定有机碱摩尔质量时结果偏高。
3、(1)读数偏大,结果(HCl)浓度偏低
(2)0.1248 > 0.1238,结果偏高
(3)HCl浓度比真实浓度低,需要消耗更多的HCl,结果偏低
(4)相同质量的碳酸氢钠比碳酸钠消耗的盐酸少,导致消耗盐酸体积减小,盐酸浓度测定值偏高
4、写出下列各体系的质子条件式。
解:(1)NH4H2PO4:
[H+]+[H3PO4]=[OH-]+[HPO42-]+2[PO43-]+[NH3]
(2)H2SO4(C1)+HCOOH(C2):
[H+]=[OH-]+[HSO4-]+2[SO42-]+[HCOO-]
(3)NaOH(C1)+NH3(C2):
[H+]+C1+[NH4+]=[OH-]
(4)HAc(C1)+NaAc(C2):
[H+]=[OH-]+[Ac-]-C2
(5)HCN(C1)+NaOH(C2):
[H+]+C2=[OH-]+[CN-]
5、写出①H3AsO4②MgBr2水溶液的电荷平衡式。
解:① [OH-]+[H2AsO4-]+2[HAsO42-]+3[AsO43-]=[H+]
② 2[Mg2+]+[H+]=[OH-]+[Br-]
6、解:
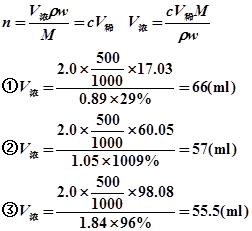
8、已知1ml某HCl标准溶液中含氯化氢0.004374g/mL,试计算:①该HCl溶液对NaOH的滴定度②该HCl溶液对CaO的滴定度。
解:HCl+NaOH==NaCl+H2O 2HCl+CaO==CaCl2+H2O
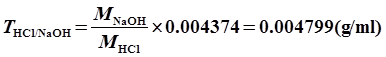
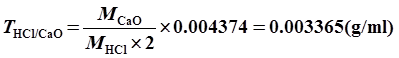
9、解: CaCO3 ~ 2HCl

10、二元弱酸H2A,已知pH=1.92时,δH2A=δHA-;pH=6.22时,δHA-=δA2-。计算:①H2A的pKa1和pKa2②HA-溶液的pH。
解:①pKa1=1.92,pKa2=6.22
(二元酸分布系数公式,两个相等处,一个极大值)
②
第四章 酸碱滴定法
补充习题:下列各酸,哪些能用NaOH溶液直接滴定或分步滴定?哪些不能?如能直接滴定,各应采用什么指示剂?
(1) 甲酸(HCOOH) Ka=1.8×10-4
答:cKa>10-8,可以直接滴定。可以采用酚酞指示剂
(2) 硼酸(H3BO3) Ka1=5.4×10-10
答:cKa1<10-8,不可以直接滴定。
(3) 琥珀酸(H2C4H4O4) Ka1=6.9×10-5,Ka2=2.5×10-6
答:cKa1>10-8,cKa2>10-8,但Ka1/Ka2<104。不能分步滴定,但可以直接一次性滴定。
(4) 柠檬酸(H3C6H5O7) Ka1=7.2×10-4,Ka2=1.7×10-5,Ka3=4.1×10-7
答:cKa1>10-8,cKa2>10-8,cKa3≈10-8但Ka1/Ka2<104,Ka2/Ka3<104。不能分步滴定,但可以直接一次性滴定。
(5) 顺丁烯二酸 Ka1=1.5×10-2,Ka2=8.5×10-7
答:cKa1>10-8,cKa2≈10-8,且Ka1/Ka2>104。可以分步滴定。
(6) 邻苯二甲酸 Ka1=1.3×10-3,Ka2=3.1×10-6
答:CKa1>10-8,CKa2>10-8,但Ka1/Ka2<104。不能分步滴定,但可以直接一次性滴定。
1、解:NaOH吸收CO2,将部分转化为Na2CO3。
①滴定强酸,如果以甲基橙为指示剂,终点化学计量关系还是1:2,基本无影响。若以酚酞为指示剂,则碳酸钠不能完全作用为氯化钠,对结果有明显影响。
②滴定弱酸,NaOH能中和弱酸,Na2CO3不能中和弱酸,需要消耗更多的标准溶液,将带来正误差(分析结果偏高)。
2、答:硼砂溶于水将生成极弱酸硼酸和一元弱碱
B4O72- + 5H2O = 2H2BO3- + 2H3BO3
一元弱碱的Kb=Kw/Ka,硼酸=1.8×10-5,因此可以用盐酸准确滴定
而醋酸钠Kb极小,无法准确滴定。
氢氧化钠可以测定醋酸不能滴定硼酸同理。
补充习题:在下列何种溶剂中,醋酸、苯甲酸、盐酸及高氯酸的酸强度都相同?
①纯水;②浓硫酸;③液氨;④甲基异丁酮
答:液氨(碱性溶剂是酸的均化性溶剂)
补充习题:下列溶剂中何者为质子溶剂?何者为无质子溶剂?若为质子溶剂,是酸性溶剂还是碱性溶剂?若为无质子溶剂,是偶极亲质子溶剂还是惰性溶剂?
①冰醋酸;②二氧六环;③乙二胺;④甲基异丁酮;⑤苯;⑥水;⑦乙醚;⑧异丙醇;⑨丙酮;⑩丁胺
答:质子溶剂:①③⑥⑧⑩;其中,酸性溶剂:①;碱性溶剂:③⑩
无质子溶剂:②④⑤⑦⑨;其中,偶极亲质子溶剂:④⑨;惰性溶剂:②⑤⑦
补充习题:有一碱液,可能是NaOH、Na2CO3、NaHCO3或其中两者的混合物。今用盐酸滴定,以酚酞为指示剂时消耗HCl的体积为V1,加入甲基橙,继续用盐酸滴定又消耗HCl的体积为V2。当出现下列情况时,溶液各由哪些物质组成?
①V1>V2>0;②V2>V1>0;③V1=V2;④V1=0,V2>0;⑤V1>0,V2=0
答:①NaOH+Na2CO3; ②Na2CO3+NaHCO3;
③Na2CO3; ④NaHCO3; ⑤NaOH。
3、解:
①0.10mol/L NaH2PO4 两性物质溶液,

注:此时公式中的Ka1和Ka2对应于磷酸的第一和第二步离解。
②0.05mol/L HAc和0.05mol/L NaAc混合溶液
缓冲溶液,用缓冲溶液公式计算

③0.1mol/L NaAc溶液 碱性溶液,按一元弱碱公式计算

④0.10mol/L NH4CN,两性物质溶液,用最简公式计算

⑤0.10mol/L H3BO3,一元弱酸溶液,用最简公式计算

⑥0.05mol/L NH4NO3,一元弱酸溶液,用最简公式计算

4、已知水的离子积常数Ks=10-14,乙醇的离子积常数Ks=10-19.1,求:
(1)纯水的pH和乙醇的pC2H5OH2。
(2)0.0100mol/LHClO4的水溶液和乙醇溶液的pH、pC2H5OH2及pOH、pC2H5O。(设HClO4全部离解)
解:(1)
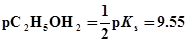
(2)因HClO4全部离解,故水溶液中:
pH=-lg0.0100=2.00,pOH=14.00-2.00=12.00
乙醇溶液中:
pC2H5OH2=-lg0.0100=2.00,pC2H5O=19.10-2.00=17.10
5、解:①HA的摩尔质量




6、解:化学计量点时,完全生成NaAc 0.0500mol/L

pOH=5.27;pH=8.73。
终点误差计算略,计算结果相等均为0.03%。
7、解:酚酞做指示剂,消耗盐酸12.00mL,说明试样中有Na3PO4。
Na3PO4+ HCl = Na2HPO4+ NaCl

8、解:
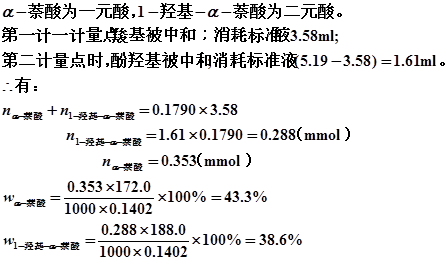
9、解:只简单提示思路,尿素分子式为 CO(NH2)2;每分子尿素能产生2分子能被吸收滴定的NH3。因此滴定剂HCl物质的量为尿素物质的量2倍。
第五章 配位滴定法
3、解:此题题意为Al3+总浓度为0.10mol/L。

=1+1.4×104+1.4×107+1.0×109+5.6×109+2.3×109+6.9×107
=8.9×109
比较式中各项数值相对大小,可见主要存在形式为AlF3、AlF4-、AlF52-
[Al3+]=cAl/αAl(F)=0.10/(8.9×109)=1.1×10-11 (mol/L)
4、待测溶液含2×10-2mol/L的Zn2+和2×10-3mol/L的Ca2+,
(1)能否用控制酸度的方法选择滴定Zn2+?
(2)若能,控制酸度范围是多少?
解:
Δlg(cK)= 6.81>5,可用控制酸度的方法选择滴定Zn2+。



6、取100mL水样,用氨性缓冲溶液调节至pH=10,以EBT为指示剂,用EDTA标准溶液(0.008826 mol/L)滴定至终点,共消耗12.58mL,计算水的总硬度。如果将上述水样再取100mL,用NaOH调节pH=12.5,加入钙指示剂,用上述EDTA标准溶液滴定至终点,消耗10.11mL,试分别求出水样中Ca2+和Mg2+的量。
解:

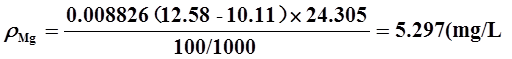
7、称取葡萄糖酸钙试样0.5500g,溶解后,在pH=10的氨性缓冲溶液中用EDTA滴定(EBT为指示剂),滴定消耗浓度为0.04985mol/L的EDTA标准溶液24.50ml,试计算葡萄糖酸钙的含量。(分子式C12H22O14Ca·H2O)
解:

第6章 氧化还原滴定法

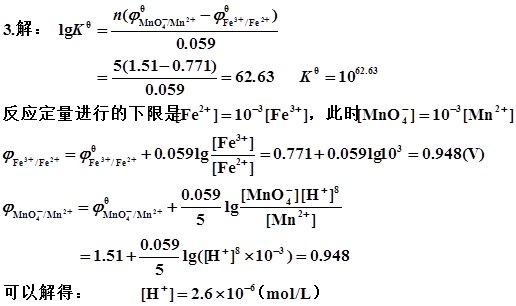
4、解:①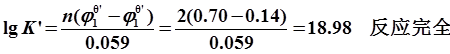
②计量点电位

③电位突跃范围 ~
~ 即:
即:
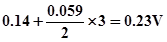 ~
~
应选亚甲蓝指示剂(理论变色点0.36V)。
5、解:根据化学计量关系,硫代硫酸钠的物质的量为重铬酸钾物质的量6.

6、解:先确定有关化学计量关系 2Cu2+ ~ I2 ~ 2Na2S2O3
计算胆矾试样含量

7、解: 本题是返滴定法测定盐酸小檗碱的含量
重铬酸钾与盐酸小檗碱反应化学计量关系为1:2。
滴定度T=2c重铬酸钾M盐酸小檗碱=13.05(mg/ml)
与盐酸小檗碱反应的K2Cr2O7的量为总量减去剩余量
剩余K2Cr2O7的一部分(250ml中取100ml)用置换碘量法与Na2S2O3作用。
求算50.00ml K2Cr2O7过量的量:

8、解:

9、解: 1C2O42-~ (2/5)KMnO4
Ca~CaC2O4~(2/5)KMnO4
设5.00ml血液中钙的物质的量为 n mol,有:

10、解:本题较复杂,只说下简单思路
草酸溶液一部分与二氧化铅作用将其还原,化学计量关系为1:1;
沉淀
剩余草酸用高锰酸钾滴定,化学计量关系为5:2;
沉淀溶解后消耗高锰酸钾量为全部铅离子的量
第7章 沉淀滴定法和重量分析法
1、说明以下测定中,分析结果偏高、偏低还是没影响?为什么?
(1) 在pH4或pH11时,以铬酸钾指示剂法测定Cl-。
(2) 采用铁铵矾指示剂法测定Cl-或Br-,未加硝基苯。
(3) 吸附指示剂法测定Cl-,选曙红为指示剂。
(4) 用铬酸钾指示剂法测定NaCl、Na2SO4混合液中的NaCl。
答:(1)偏高。指示剂变色延迟或Ag+水解。
(2)偏低。沉淀转化,消耗过多SCN-。
(3)偏低。指示剂吸附太强,终点提前。
(4)偏高,硫酸银难溶,消耗更多Ag+标准溶液。
4、解题思路:该题为沉淀剂用量。首先按照1:1化学计量关系计算,然后沉淀剂过量50%~100%可算出沉淀剂使用量。

5、解:根据题意,和沉淀滴定反应的有关化学计量关系,可以得到两个关系式:

6、解题思路: 硝酸银总量减去返滴定所用硫氰酸铵溶液量为试样氯离子和溴离子的总量;可解得混合物中各自的质量。
7、解题思路: 分别用返滴定化学计量关系可以计算无机氯和有机氯的含量
9、解题思路:用换算因素计算比较简单。

