1.简述米氏常数的意义。
⑴ 当反应速度为最大速度一半时,米氏方程可以变换如下:
1/2Vmax=Vmax[S]/(Km+[S])→ Km=[S]知,Km值等于酶反应速度为最大速度一半时的底物浓度。
⑵ Km值是酶的特征性常数,只与酶的性质,酶所催化的底物和酶促反应条件(如温度、pH、有无抑制剂等)有关,与酶的浓度无关。
⑶ 1/Km可以近似表示酶对底物亲和力的大小。
⑷ 利用米氏方程,我们可以计算在某一底物浓度下的反应速度或者在某一速度条件下的底物浓度。
2.简述三羧酸循环的生理意义是什么?它有哪些限速步骤?
生理意义:三羧酸循环是机体获取能量的主要方式;为生物合成提供原料;影响果实品质
糖;脂肪和蛋白质代谢的枢纽
限速步骤:
1) 在柠檬酸合酶的作用下,由草酰乙酸和乙酰-CoA合成柠檬酸
2) 在异柠檬酸脱氢酶催化下,异柠檬酸脱氢形成草酰琥珀酸。
3) 在α-酮戊二酸脱氢酶系作用下,α-酮戊二酸氧化、脱羧,生成琥珀酰-CoA、 NADH+H+和CO2。
4.什么是转氨作用?简述转氨作用的两步反应过程?为什么它在氨基酸代谢中有重要作用?
概念:
转氨作用是指在转氨酶催化下将α-氨基酸的氨基转给另一个α-酮酸,生成相应的α-酮酸和一种新的α-氨基酸的过程。磷酸吡哆醛是转氨酶的辅酶,起到携带NH2基的作用。
这一过程分为两步反应:
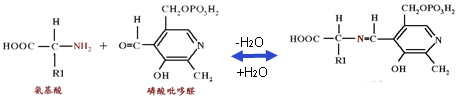
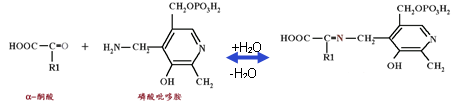
转氨作用的生理意义:
a) 通过转氨作用可以调节体内非必需氨基酸的种类和数量,以满足体内蛋白质合成时对非必需氨基酸的需求。
b) 转氨作用可使由糖代谢产生的丙酮酸、α-酮戊二酸、草酰乙酸变为氨基酸,因此,对糖和蛋白质代谢产物的相互转变有其重要性。
c) 由于生物组织中普遍存在有转氨酶,而且转氨酶的活性又较强,故转氨作用是氨基酸脱氨的重要方式。
d) 转氨作用的另一重要性是因肝炎病人血清的转氨酶活性有显著增加,测定病人血清的转氨酶含量大有助于肝炎病情的诊断。
转氨基作用还是联合脱氨基作用的重要组成部分,从而加速了体内氨的转变和运输,勾通了机体的糖代谢、脂代谢和氨基酸代谢的互相联系。
5.简述磷酸戊糖途径概念及生理意义
概念:以6-磷酸葡萄糖开始,在6-磷酸葡萄糖脱氢酶催化作用下形成6-磷酸葡萄糖酸,进而代谢生成磷酸戊糖作为中间代谢产物,故将此过程称为磷酸戊糖途径。
1) 产生大量的NADPH,为细胞的各种合成反应提供还原力
2) 途径中的中间物为许多化合物的合成提供原料:PPP途径可以产生多种磷酸单糖,如磷酸核糖、4-磷酸赤藓糖与磷酸烯醇式丙酮酸等。
3) 提高植物的抗病能力:这主要是因为4-磷酸赤藓糖与磷酸烯醇式丙酮酸可合成莽草酸,进而合成绿原酸、咖啡酸等与抗病能力有关的物质。
4) 提高植物的适应能力:当植物处于逆境条件下(干旱、染病、受损等),内外因素均不利于EMP途径的涉及的酶,而PPP途径不受影响,能够顺利进行,因而可以提高植物的适应力。
6.简述尿素循环的基本过程及发生部位
A、部位
肝脏是尿素合成的主要器官,肾脏是尿素排泄的主要器官。
B、原料
尿素的生物合成需要NH3、CO2(或H2CO3)、鸟氨酸、天冬氨酸、ATP、Mg2+和相关酶的参加。
C、过程
全部反应过程可分为3个阶段:
Ⅰ、CO2、NH3与鸟氨酸作用合成瓜氨酸。(线粒体)
Ⅱ、瓜氨酸与天冬氨酸作用产生精氨酸。(细胞液)
Ⅲ、精氨酸被精氨酸水解酶水解后放出尿素,并形成鸟氨酸。(细胞液)
7.代谢调节有哪几个水平?它们与生物进化程度的对应情况如何?
在生物进化过程中,生物体内的调节机制也随之发展。进化程度越高,期代谢调节机制越复杂。就整个生物界而言,代谢调解可分为四个水平:酶水平调节、细胞水平调节、激素水平调节、神经水平调节。
其中,酶水平和细胞水平调节是生物体内最基本的调节方式,为单细胞生物、植物、动物所共有;激素水平调节和神经水平调节是随生物进化而发展起来的高级水平调节方式。但是,高级水平的激素调节和神经调节,仍然以酶水平和细胞水平的调节为基础。
8.脂肪酸在生物体内经β-氧化作用分解为乙酰CoA需要经过哪些过程?分别发生在细胞的什么部位?
A、脂肪酸的活化——脂酰CoA的生成
脂肪酸进行氧化前必须活化,活化在线粒体外进行。内质网及线粒体外膜上的脂酰CoA合成酶在ATP、CoA-SH、Mg2+存在的条件下,催化脂肪酸活化,生成脂酰CoA。
B、脂酰CoA进入线粒体
脂肪酸的活化在细胞液中进行,而催化脂肪酸氧化的酶系存在于线粒体的基质内,因此活化的脂酰CoA必须进入线粒体内才能代谢。
长链脂酰CoA不能直接透过线粒体内膜。它进入线粒体需肉碱[ L-(CH3)3N+CH2CH(OH)CH2COO-, L-β羟- -三甲氨基丁酸 ]的转运。
C、脂肪酸的β-氧化
脂酰-CoA进入线粒体基质后,在线粒体基质中疏松结合的脂酸β-氧化多酶复合体的催化下,从脂酰基的β-碳原子开始,进行脱氢、加水、再脱氢及硫解等四步连续反应:
(1)脱氢:脂酰-CoA在脂酰-CoA脱氢酶的催化下,α、β碳原子各脱下一氢原子,生成反△2烯酰CoA。脱下的2H由FAD接受生成FADH2。
(2)加水:反△2烯酰CoA在△2烯酰水化酶的催化下,加水生成L(+)-β-羟脂酰-CoA。
(3)再脱氢:L(+)-β-羟脂酰CoA在β-羟脂酰-CoA脱氢酶的催化下,脱下2H生成β-酮脂酰-CoA,脱下的2H由NAD+接受,生成NADH及H+。
(4)硫解:β-酮脂酰CoA在β-酮脂酰-CoA硫解酶催化下,加CoA-SH使碳链断裂,生成1分子乙酰CoA和少2个碳原子的脂酰CoA。
9.DNA双螺旋结构有什么基本特点?这些特点能解释哪些最重要的生命现象?
答案要点:a. 两条反向平行的多聚核苷酸链沿一个假设的中心轴右旋相互盘绕而形成,螺旋表面有一条大沟和一条小沟。b. 磷酸和脱氧核糖单位作为不变的骨架组成位于外侧,作为可变成分的碱基位于内侧,链间碱基按A-T配对,之间形成2个氢键,G-C配对,之间形成3个氢键(碱基配对原则,Chargaff定律)。c. 螺旋直径2nm,相邻碱基平面垂直距离0.34nm,螺旋结构每隔10个碱基对重复一次,间隔为3.4nm。该模型揭示了DNA作为遗传物质的稳定性特征,最有价值的是确认了碱基配对原则,这是DNA复制、转录和反转录的分子基础,亦是遗传信息传递和表达的分子基础。该模型的提出是本世纪生命科学的重大突破之一,它奠定了生物化学和分子生物学乃至整个生命科学飞速发展的基石。
12、请列举细胞内乙酰CoA的代谢去向。
答案要点:三羧酸循环;乙醛酸循环;从头合成脂肪酸;酮体代谢;合成胆固醇等。(各1分)
13、为什么说三羧酸循环是糖、脂、蛋白质三大物质代谢的共同通路?哪些化合物可以被认为是联系糖、脂、蛋白质和核酸代谢的重要环节?为什么?
答案要点:①三羧酸循环是糖、脂、蛋白质三大物质代谢的共同氧化分解途径(2分);三羧酸循环为糖、脂、蛋白质三大物质合成代谢提供原料(1分),要举例(2分)。②列举出糖、脂、蛋白质、核酸代谢相互转化的一些化合物(3分),糖、脂、蛋白质、核酸代谢相互转化相互转化途径(2分)。
14.氨中毒原理(3分)
1)α酮戊二酸大量转化2)NADPH大量消耗3)三羧酸循环中断,能量供应受阻,某些敏感器官(如神经、大脑)功能障碍。
15.为 什么用反应初速度表示酶活力?(3分)
答案:1)底物浓度降低, 2)酶在一定pH下部分失活 3)产物对酶的抑制 4)产物浓度增加而加速了逆反应的进行。
16.肽键的特点(4分)
1)是氮原子上的孤对电子与羰基具有明显的共轭作用。
2)肽键中的C-N键具有部分双键性质,不能自由旋转。
3)组成肽键的原子C-O-N-H处于同一平面,构成刚性平面。
4)键长(0.132nm)比一般C-N键 (0.147nm) 短,而比 C=N(0.127nm)长。
5)在大多数情况下,H和O以反式结构存在。
17. 什么是蛋白质的变性,引起蛋白质变性的因素有哪些?
蛋白质受理化因素的作用时,次级键受到破坏,导致天然构象的破坏,使蛋白质的生物活性丧失的现象称为蛋白质变性。(2分)变性的因素,物理因素有:热、紫外线、X射线、超声波、高压、搅拌、据烈振荡、研磨等;化学因素有:强酸、强碱、有机溶剂、尿素、重金属盐、生物碱试剂、去污剂等。(3分)
18、嘌呤核苷酸合成的基本原料有哪些?首先合成的是什么核苷酸?
答:体内嘌呤核苷酸合成的原料有二氧化碳、一碳单位、谷氨酰胺、天冬氨酸和戊糖5—磷酸(核糖5`—磷酸)。首先合成的核苷酸是次黄嘌呤核苷酸。
19. 嘧啶核苷酸合成的基本原料有哪些?首先合成的什么核苷酸?合成胸腺嘧啶时其甲基是由什么物质提供的?
答:体内嘧啶核苷酸合成的原料有氨、二氧化碳、天冬氨酸和核糖5-磷酸。首先合成的是尿嘧啶核苷酸。合成胸腺嘧啶的甲基是由N2、N10—CH2—FH4提供的。
21.为什么说“三羧酸循环”是三大类物质代谢的枢纽?
三羧酸循环是乙酰CoA最终氧化生成CO2和H2O的途径。
糖代谢产生的碳骨架最终进入三羧酸循环氧化。
脂肪分解产生的甘油可通过有氧氧化进入三羧酸循环氧化,脂肪酸经β-氧化产生CoA可进入三羧酸循环氧化。
蛋白质分解产生的氨基酸经脱氨后碳骨架可进入三羧酸循环,同时,三羧酸循环的中间产物可作为氨基酸的碳骨架接受氨后合成必需氨基酸。
所以,三羧酸循环是三大物质代谢的枢纽
22何谓氧化磷酸化作用?NADH呼吸链中有个氧化磷酸化偶联部位?
答:在线粒体内伴随着电子在呼吸链传递过程中所发生的ADP磷酸化生成ATP的过程称为氧化磷酸化作用。
在NDAH呼吸链中有三个偶联部位,第一个偶联部位是在NADH→CoQ之间;第二个偶联部位是在细胞b→细胞色素c之间;第三个偶联部位是在细胞色素aa3→O2之间。
第二篇:生物化学常用简答题
1、简述血氨的来源和去路。
(1)血氨来源:
①氨基酸脱氨基作用,是血氨的主要来源;
②肠道产氨,由腐败作用产生的氨或肠道尿素经肠道细菌尿素酶水解产生的氨; ③肾脏产氨,主要来自谷氨酰胺的水解;
④胺类、嘌呤、嘧啶等含氮物质的分解产生氨。
(2)血氨去路
①在肝脏经鸟氨酸循环合成尿素,随尿液排出体外;②合成谷氨酰胺
③参与合成非必需氨基酸;④合成其它含氮物质
2、磷酸戊糖途径分哪两个阶段,此代谢途径的生理意义是什么?
磷酸戊糖途径分为氧化反应和非氧化反应两个阶段
(1)是机体生成NADPH的主要代谢途径:NADPH在体内可用于:,参与体内代谢:如参与合成脂肪酸、胆固醇等。②参与羟化反应:作为加单氧酶的辅酶,参与对代谢物的羟化。③维持谷胱甘肽的还原状态,还原型谷胱甘肽可保护含-SH的蛋白质或酶免遭氧化,维持红细胞膜的完整性,由于6-磷酸葡萄糖脱氢酶遗传性缺陷可导致蚕豆病,表现为溶血性贫血。
(2)是体内生成5-磷酸核糖的主要途径:体内合成核苷酸和核酸所需的核糖或脱氧核糖均以5-磷酸葡萄糖的形式提供,其生成方式可以由G-6-P脱氢脱羧生成,也可以由3-磷酸甘油醛和F-6-P经基团转移的逆反应生成。
3、试述成熟红细胞糖代谢特点及其生理意义。
成熟红细胞不仅无细胞核,而且也无线粒体、核蛋白体等细胞器,不能进行核酸和蛋白质的生物合成,也不能进行有氧氧化,不能利用脂肪酸。血糖是其唯一的能源。红细胞摄取葡萄糖属于易化扩散,不依赖胰岛素。成熟红细胞保留的代谢通路主要是葡萄糖的酵解和磷酸戊糖通路以及2.3一二磷酸甘油酸支路。通过这些代谢提供能量和还原力(NADH,NADPH)以及一些重要的代谢物,对维持成熟红细胞在循环中约120的生命过程及正常生理功能均有重要作用。
4、血糖正常值是多少,机体是如何进行调节的。
3.89~6.11mmol/L
7、在糖代谢过程中生成的丙酮酸可进入哪些代谢途径?
答:(1)在供氧不足时,丙酮酸在乳酸脱氢酶的催化下,有还原型的辅酶Ⅰ供氢,还原成乳酸。(2)在供氧充足时,丙酮酸进入线粒体在丙酮酸脱氢酶系的作用下,氧化脱羧生成乙酰辅酶A, 乙酰辅酶A进入三羧酸循环被氧化为二氧化碳和水及ATP。(3)丙酮酸进入线粒体在丙酮酸羧化酶的作用下生成草酰乙酸,后者经磷酸烯醇式丙酮酸羧激酶催化下生成磷酸烯醇式丙酮酸,在异生成糖。(4)丙酮酸进入线粒体在丙酮酸羧化酶的作用下生成草酰乙酸,后者与乙酰辅酶A缩合成柠檬酸,柠檬酸出线粒体在细胞浆中经柠檬酸裂解酶催化生成乙酰辅酶A,后者可作脂肪、胆固醇的合成原料。(5)丙酮酸可经还原性氨基化生成丙氨酸等非必需氨基酸。决定丙酮酸的代谢方向是各条代谢途径中关键酶的活性。这些酶受到别构效应剂与激素的调节。
肝脏调节:用餐后血糖浓度增高是,肝糖原合成增加,是血糖水平不致因饮食而过度升高;
空腹时肝糖原分解,提供葡萄糖;饥饿或禁食,肝脏的糖异生作用加强,提供葡萄糖。 肾脏调节:肾小管重吸收葡萄糖,但是不要超过肾糖阈。
神经调节:用电刺激交感神经系的视丘下部腹内侧核或内脏神经,能促使肝糖原分解,血糖升高;用电刺激副交感神经系的视丘下部外侧或迷走神经时,肝糖原合成增加,血糖浓度升高。
激素调节:若是血糖浓度过高,则胰岛素起作用,若血糖浓度过低,有肾上腺素、胰高血糖素、糖皮质激素、生长素、甲状腺激素等起作用。
来源:食物糖、肝糖原分解、非糖物质糖异生
去路:氧化生成水、二氧化碳、能量;合成肝糖原、肌糖原、转化成脂肪、核糖、氨基酸等;通过磷酸戊糖途径转化为五磷酸核糖。
3。何为酶的竞争性抑制作用?有何特点?试举例说明之。
1)有些抑制剂与酶的底物结构相似,可与底物竞争酶的活性中心,从而阻碍酶与底物结合形成中间产物。这种抑制作用称为竞争性抑制作用。2)有两个特点,一是抑制剂以非共价键与酶呈可逆性结合,可用透析或超滤的方式除去,二是抑制程度取决于抑制剂与酶的相对亲和力和底物浓度的比例,加大底物浓度可减轻抑制作用。3)典型例子是丙二酸对琥珀酸脱氢酶的抑制作用。
4。比较三种可逆性抑制作用的特点。
(1)竞争性抑制:抑制剂的结构与底物结构相似,共同竞争酶的活性中心。抑制作用的大小与抑制剂与底物的浓度以及酶对它们的亲和力有关。Km值升高,Vm不变。
(2)非竞争性抑制:抑制剂的结构与底物结构不相似或不同,只与酶活性中心外的必需基因结合。不影响酶与底物的结合。抑制作用的强弱只与抑制剂的浓度有关。Km值不变,Vm下降。
(3)反竞争性抑制:抑制剂只与酶-底物复合物结合,生成的三元复合物不能解离为产物。Km,Vm均下降。
5。简述血糖的来源和去路。
血糖的来源:①食物经消化吸收的葡萄糖;②肝糖原分解;③糖异生
血糖的去路:①糖酵解或有氧氧化产生能量;②合成糖原;③转变为脂肪及某些非必需氨基酸;④进入磷酸戊糖途径等转变为其它非糖类物质。
简述糖异生的生理意义。
1.维持血糖浓度相对恒定
2.乳酸是糖异生的重要原料。
3.肾糖异生增强有利于维持酸碱平衡
4.协助氨基酸代谢
1、乳酸循环是如何形成,其生理意义是什么?
乳酸循环的形成是因肝脏和肌肉组织中酶的特点所致。肝内糖异生活跃,又有葡萄糖6-磷酸酶水解6-磷酸葡萄糖生成葡萄糖;而肌肉中除糖异生活性很低外还缺乏葡萄糖6-磷酸酶,肌肉中生成的乳酸即不能异生为糖,更不能释放出葡萄糖。但肌肉内酵解生成的乳酸通过细胞膜弥散进入血液运输入肝,在肝内异生为葡萄糖再释放入血又可被肌肉摄取利用,这样就构成乳酸循环。其生理意义在于避免损失乳酸以及防止因乳酸堆积而引起酸中毒。
2、试述原核生物终止转录的方式
①依赖pho终止转录的方式
Rho因子是由相同的6个亚基组成的六聚体蛋白质,亚基分子量46KD。它是原核生物转录终止因子,可结合转录产物RNA3′端的多聚C特殊序列,还有ATP酶和解螺旋酶活性。Rho因子与转录产物3′端的多聚C结合后,Rho因子和RNA聚合酶都发生构象改变,从而使RNA聚合酶停顿,解螺旋酶的活性使DNA与RNA杂化双链拆离,使转录产物从转录复合物中释放。
②非依赖pho终止转录的方式
非依赖Rho的转录终止主要依赖于RNA 3′-端的茎环(发夹)结构及随后的一串寡聚U。茎环结构生成后仍被RNApol所包容,因而使RNA-pol变构而不能前进,polyU与模板poly A序列是最不稳定的碱基配对结
试比较体外氧化和生物氧化的异同点?
答:相同点:消耗的氧量,最终产物,释放的能量是相同的
不同点:生物氧化是:①生物体内的生物氧化过程是在37℃,近于中性的含水环境中,由酶催化进行
②CO2的产生方式为有机酸脱羧,H2O的产生是底物脱氢,再经电子传递过程最后与氧 结合生成
③反应逐步释放出能量,相当一部分能量以化学能的方式储存在高能磷酸化合物中 ④生物氧化的速率受体内多种因素的调节。
食糖多为什么发胖(仅要求写出物质的转变过程,不要求酶)
答:人吃过多的糖造成体内能量物质过剩,进而合成脂肪储存故可以发胖,其基本过程如下:葡萄糖——→丙酮酸——→乙酰CoA——→合成脂肪酸——→酯酰CoA
葡萄糖——→磷酸二羟丙酮——→3—磷酸甘油
酯酰CoA + 3—磷酸甘油——→脂肪(储存)
简述磺胺类药物的作用机理及意义?
磺胺药物能抑制细菌生长,是因为这些细菌在生长繁殖时需利用对氨基苯甲酸作底物。在二氢叶酸合成酶的催化下合成二氢叶酸,二氢叶酸是核苷酸合成过程中的辅酶之一四氢叶酸的前体。磺胺药物的结构与对氨基苯甲酸相似,可竞争性抑制菌体内的二氢叶酸的合成酶,从而阻碍了二氢叶酸的合成。菌体内二氢叶酸缺乏,导致核苷酸、核酸的合成受阻,因而影响细菌的生长繁殖,起到杀菌的目的。根据竞争性抑制的特点,服用磺胺药物是必须保持血液中药物的高浓度,以发挥其有效的竞争性抑制作用。
DNA复制与转录过程的异同点。
DNA的复制与转录的相同点:复制和转录都是酶促的核苷酸聚合的过程,有以下相似之处,都以DNA为模板;都需依赖DNA的聚合酶;聚合过程都是核苷酸之间生成磷酸二酯键;都从5′至3′方向延伸成新链多聚核苷酸;都遵从碱基配对规律。
复制与转录的不同点:
1 转录以DNA单链为模版而复制以双链为模板
2 转录用的无引物而复制以一段特异的RNA为引物
3 转录和复制体系中所用的酶体系不同
4 转录和复制的配对的碱基不完全一样,转录中A对U,而复制中A对T,而且转录体系
中有次黄嘌呤碱基的引入
1、简述原核生物与真核生物的RNA聚合酶的种类和主要功能。(9分)
1.真核生物的RNA聚合酶目前已发现有三种。RNA聚合酶Ⅰ存在于核仁中,转录rRNA顺序。RNA聚合酶Ⅱ存在于核质中,转录大多数基因(严格说是催化各种前体mRNA的合成)。RNA聚合酶Ⅲ存在于核质中,转录很少几种基因如tRNA基因如5SrRNA基因。 原核生物只发现一种RNA聚合酶,能催化mRNA,tRNA和rRNA等的合成.
2、举出二种在线粒体内进行物质代谢反应的代谢途径,再写出这两个途径的反应过程。
(1)三羧酸循环
在线粒体基质中进行,反应过程的酶,除了琥珀酸脱氢酶是定位于线粒体内膜外,其余均位于线粒体基质中
主要事件顺序为:
1)乙酰CoA与草酰乙酸结合,生成柠檬酸,放出CoA。柠檬酸合成酶。
2)柠檬酸先失去一个H2O而成顺乌头酸,再结合一个H2O转化为异柠檬酸。顺乌头酸酶
3)异柠檬酸发生脱氢、脱羧反应,生成a-酮戊二酸,放出一个CO2,生成一个NADH+H+。异柠檬酸脱氢酶
4)a-酮戊二酸氧化脱羧生成琥珀酰CoA,放出一个CO2,生成一个NADH+H+。酮戊二酸脱氢酶
5)琥珀酰辅酶A合成酶催化底物水平磷酸化反应
6)琥珀酸脱氢生成延胡索酸,生成1分子FADH2,琥珀酸脱氢酶
7)延胡索酸和水化合而成苹果酸。延胡索酸酶
8)苹果酸氧化脱氢,生成草酸乙酸,生成1分子NADH+H+。苹果酸脱氢酶
(2)脂酰CoA的β氧化:脂酰CoA进入线粒体基质后,在脂肪酸β氧化酶系催化下,使脂酰基断裂生成一分子乙酰CoA和一分子比原来少了两个碳原子的脂酰CoA.因反应均在脂酰CoA烃链的α,β碳原子间进行,最后β碳被氧化成酰基,故称为β氧化。
1)脱氢2)加水3)再脱氢4)硫解
为什么说三羧酸循环是糖、脂和蛋白质三大物质代谢的共同通路?
①三羧酸循环是乙酰CoA最终进入CO2和H2O的途径。②糖代谢产生的碳骨架最终进入到三羧酸循环氧化。③脂肪分解代谢产生的甘油可通过糖有氧氧化进入三羧酸循环氧化,脂肪酸经β-氧化产生的乙酰CoA可进入三羧酸循环氧化。④蛋白质分解产生的氨基酸经脱氨后碳骨架可经糖有氧氧化进入三羧酸循环氧化,同时三羧酸循环的中间产物可作为氨基酸的碳骨架接受NH3后合成非必需氨基酸。 因此,三羧酸循环是三大物质的共同通路。
三羧酸循环的生物学意义
1.三羧酸循环是机体获取能量的主要方式。1个分子葡萄糖经无氧酵解仅净生成2个分子ATP,而有氧氧化可净生成32个ATP,其中三羧酸循环生成20个ATP,在一般生理条件下,许多组织细胞皆从糖的有氧氧化获得能量。糖的有氧氧化不但释能效率高,而且逐步释能,并逐步储存于ATP分子中,因此能的利用率也很高。
2.三羧酸循环是糖,脂肪和蛋白质三种主要有机物在体内彻底氧化的共同代谢途径,三羧酸循环的起始物乙酰CoA,不但是糖氧化分解产物,它也可来自脂肪的甘油、脂肪酸和来自
蛋白质的某些氨基酸代谢,因此三羧酸循环实际上是三种主要有机物在体内氧化供能的共同通路,估计人体内2/3的有机物是通过三羧酸循环而被分解的。
3.三羧酸循环是体内三种主要有机物互变的联结机构,因糖和甘油在体内代谢可生成α-酮戊二酸及草酰乙酸等三羧酸循环的中间产物,这些中间产物可以转变成为某些氨基酸;而有些氨基酸又可通过不同途径变成α-酮戊二酸和草酰乙酸,再经糖异生的途径生成糖或转变成甘油,因此三羧酸循环不仅是三种主要的有机物分解代谢的最终共同途径,而且也是它们互变的联络机构。
1、为什么说三羧酸循环是糖、脂和蛋白质三大物质代谢的共同通路? 答:①三羧酸循环是乙酰CoA最终进入CO2和H2O的途径。②糖代谢产生的碳骨架最终进入到三羧酸循环氧化。③脂肪分解代谢产生的甘油可通过糖有氧氧化进入三羧酸循环氧化,脂肪酸经β-氧化产生的乙酰CoA可进入三羧酸循环氧化。④蛋白质分解产生的氨基酸经脱氨后碳骨架可经糖有氧氧化进入三羧酸循环氧化,同时三羧酸循环的中间产物可作为氨基酸的碳骨架接受NH3后合成非必需氨基酸。
蛋白质的α螺旋结构有何特点? 螺旋结构有何特点?
多肽链主链绕中心轴旋转,形成棒状螺旋结构, 1、多肽链主链绕中心轴旋转,形成棒状螺旋结构,每个螺旋含有 3.6 个氨基 酸残基, 0.54nm,氨基酸之间的轴心距为 0.15nm.。 酸残基,螺距为 0.54nm,氨基酸之间的轴心距为 0.15nm.。 螺旋结构的稳定主要靠链内氢键,
2、α-螺旋结构的稳定主要靠链内氢键,每个氨基酸的 NH 与前面第四个氨基 形成氢键。 酸的 C=O 形成氢键。 螺旋结构大都为右手螺旋。 3、天然蛋白质的 α-螺旋结构大都为右手螺旋。
什么是乙醛酸循环,
答:乙醛酸循环是一个有机酸代谢环,它存在于植物和微生物中,在动物组织中尚未发现。乙醛酸循环反应分为五步(略)。总反应说明,循环每转1 圈需要消耗2分子乙酰CoA,同时产生1 分子琥珀酸。琥珀酸产生后,可进入三羧酸循环代谢,或者变为葡萄糖。
乙醛酸循环的意义有如下几点:(1)乙酰CoA 经乙醛酸循环可琥珀酸等有机酸,这些有机酸可作为三羧酸循环中的基质。(2)乙醛酸循环是微生物利用乙酸作为碳源建造自身机体的途径之一。(3)乙醛酸循环是油料植物将脂肪酸转变为糖的途径。
琥珀酰CoA 的代谢来源与去路有哪些?
答:(1)琥珀酰CoA 主要来自糖代谢,也来自长链脂肪酸的 ω-氧化。奇数碳原子脂肪酸,通过 氧化除生成乙酰CoA,后者进一步转变成琥珀酰CoA。此外,蛋氨酸,苏氨酸以及缬氨酸和异亮氨酸在降解代谢中也生成琥珀酰CoA。
(2)琥珀酰CoA 的主要代谢去路是通过柠檬酸循环彻底氧化成CO2 和H2O。琥珀酰CoA 在肝外组织,在琥珀酸乙酰乙酰CoA 转移酶催化下,可将辅酶A 转移给乙酰乙酸,本身成为琥珀酸。此外,琥珀酰CoA 与甘氨酸一起生成δ-氨基-γ-酮戊酸(ALA),参与血红素的合成。
糖代谢和脂代谢是通过那些反应联系起来的?
答:(1)糖酵解过程中产生的磷酸二羟丙酮可转变为磷酸甘油,可作为脂肪合成中甘油的原
料。
(2)有氧氧化过程中产生的乙酰CoA 是脂肪酸和酮体的合成原料。
(3)脂肪酸分解产生的乙酰CoA 最终进入三羧酸循环氧化。
(4)酮体氧化产生的乙酰CoA 最终进入三羧酸循环氧化。
(5)甘油经磷酸甘油激酶作用后,转变为磷酸二羟丙酮进入糖代谢。
糖类物质在生物体内起什么作用?
答:(1)糖类物质是异氧生物的主要能源之一,糖在生物体内经一系列的降解而释放大量的能量,供生命活动的需要。
(2)糖类物质及其降解的中间产物,可以作为合成蛋白质 脂肪的碳架及机体其它碳素的来源。
(3)在细胞中糖类物质与蛋白质 核酸 脂肪等常以结合态存在,这些复合物分子具有许多特异而重要的生物功能。
(4)糖类物质还是生物体的重要组成成分。
氧化作用和磷酸化作用是怎样偶联的?
答:目前解释氧化作用和磷酸化作用如何偶联的假说有三个,即化学偶联假说、结构偶联假说与化学渗透假说。其中化学渗透假说得到较普遍的公认。该假说的主要内容是:
(1)线粒体内膜是封闭的对质子不通透的完整内膜系统。
(2)电子传递链中的氢传递体和电子传递体是交叉排列,氢传递体有质子(H+)泵的作用,在电子传递过程中不断地将质子(H+)从内膜内侧基质中泵到内膜外侧。
(3)质子泵出后,不能自由通过内膜回到内膜内侧,这就形成内膜外侧质子(H+)浓度高于内侧,使膜内带负电荷,膜外带正电荷,因而也就形成了两侧质子浓度梯度和跨膜电位梯度。这两种跨膜梯度是电子传递所产生的电化学电势,是质子回到膜内的动力,称质子移动力或质子动力势。
(4)一对电子(2eˉ)从NADH 传递到O2 的过程中共有3 对H 十从膜内转移到膜外。复合物Ⅰ、Ⅲ、Ⅳ着质子泵的作用,这与氧化磷酸化的三个偶联部位一致,每次泵出2 个H 十。
(5)质子移动力是质子返回膜内的动力,是ADP 磷酸化成ATP 的能量所在,在质子移动力驱使下,质子(H+)通过F1F0-ATP 合酶回到膜内,同时ADP 磷酸化合戚ATP。
在体内ATP 有哪些生理作用?
(1)是机体能量的暂时贮存形式:在生物氧化中,ADP 能将呼吸链上电子传递过程中所释放的电化学能以磷酸化生成ATP 的方式贮存起来,因此ATP 是生物氧化中能量的暂时贮存形式。
(2)是机体其它能量形式的来源:ATP 分子内所含有的高能键可转化成其它能量形式,以维持机体的正常生理机能,例如可转化成机械能、生物电能、热能、渗透能、化学合成能等。体内某些合成反应不一定都直接利用ATP 供能,而以其他三磷酸核苷作为能量的直接来源。如糖原合成需UTP 供能;磷脂合成需CTP 供能;蛋白质合成需GTP 供能。这些三磷酸核苷分子中的高能磷酸键并不是在生物氧化过程中直接生成的,而是来源于ATP。
(3)可生成cAMP 参与激素作用:ATP 在细胞膜上的腺苷酸环化酶催化下,可生成cAMP,作为许多肽类激素在细胞内体现生理效应的第二信使。
有时别构酶的活性可以被低浓度的竞争性抑制剂激活,请解释?
答:底物与别构酶的结合,可以促进随后的底物分子与酶的结合,同样竞争性抑制剂与酶的底物结合位点结合,也可以促进底物分子与酶的其它亚基的进一步结合,因此低浓度的抑制剂可以激活某些别构酶。
简述tRNA 二级结构的组成特点及其每一部分的功能。
答:tRNA 的二级结构为三叶草结构。其结构特征为:
(1)tRNA 的二级结构由四臂、四环组成。已配对的片断称为臂,未配对的片断称为环。
(2)叶柄是氨基酸臂。其上含有CCA-OH3’,此结构是接受氨基酸的位置。
(3)氨基酸臂对面是反密码子环。在它的中部含有三个相邻碱基组成的反密码子,可与mRNA 上的密码子相互识别。
(4)左环是二氢尿嘧啶环(D 环),它与氨基酰-tRNA 合成酶的结合有关。
(5)右环是假尿嘧啶环(TψC 环),它与核糖体的结合有关。
(6)在反密码子与假尿嘧啶环之间的是可变环,它的大小决定着tRNA 分子大小。
蛋白质的作用:
(1)生物催化作用 酶是蛋白质,具有催化能力,新陈代谢的所有化学反应几乎都是在酶的催化下进行的。
(2)结构蛋白 有些蛋白质的功能是参与细胞和组织的建成。
(3)运输功能 如血红蛋白具有运输氧的功能。
(4)收缩运动 收缩蛋白(如肌动蛋白和肌球蛋白)与肌肉收缩和细胞运动密切相关。
(5)激素功能 动物体内的激素许多是蛋白质或多肽,是调节新陈代谢的生理活性物质。
(6)免疫保护功能 抗体是蛋白质,能与特异抗原结合以清除抗原的作用,具有免疫功能。
(7)贮藏蛋白 有些蛋白质具有贮藏功能,如植物种子的谷蛋白可供种子萌发时利用。
(8)接受和传递信息 生物体中的受体蛋白能专一地接受和传递外界的信息。
(9)控制生长与分化 有些蛋白参与细胞生长与分化的调控。
(10)毒蛋白 能引起机体中毒症状和死亡的异体蛋白,如细菌毒素、蛇毒、蝎毒、蓖麻毒素等。
核苷酸的生物功用:
作为核酸合成的原料
体内能量的利用形式
参与代谢和生理调节
组成辅酶
活化中间代谢物
补救合成的生理意义
补救合成节省从头合成时的能量和一些氨基酸的消耗。
体内某些组织器官,如脑、骨髓等只能进行补救合成。
肝在糖代谢中的作用:
合成、储存糖原
分解糖原生成葡萄糖,释放入血
是糖异生的主要器官
2.酶隔离分布的意义:提高同一代谢途径酶促反应速率。使各种代谢途径互不干扰,彼此协调,
有利于调节物对各途径的特异调节。
1.生物氧化与体外氧化之相同点和不同点:
同:生物氧化中物质的氧化方式有加氧、脱氢、失电子,遵循氧化还原反应的一般规律。 质在体内外氧化时所消耗的氧量、最终产物(CO2,H2O)和释放能量均相同。
不同:
反应环境温和,酶促反应逐步进行,能量逐步释放,能量容易捕获,ATP生成效率高。---能量突然释放。
通过加水脱氢反应使物质能间接获得氧,并增加脱氢的机会;脱下的氢与氧结合产生H2O,有机酸脱羧产生CO2。---物质中的碳和氢直接氧结合生成CO2和H2O 。
2.氧化呼吸链组分按氧化还原电位由低到高的顺序排列
标准氧化还原电位
拆开和重组
特异抑制剂阻断
还原状态呼吸链缓慢给氧
3.NADH氧化呼吸链:NADH →复合体Ⅰ→Q →复合体Ⅲ→Cyt c →复合体Ⅳ→O2
4.琥珀酸氧化呼吸链:琥珀酸 →复合体Ⅱ →Q →复合体Ⅲ→Cyt c →复合体Ⅳ→O2
5.ROS主要来源:
线粒体:超氧阴离子O·-2,是体内O·-2的主要来源; O·-2在线粒体中再生成H2O2和·OH。
过氧化酶体:FAD将从脂肪酸等底物获得的电子交给O2生成H2O2和羟自由基·OH。 胞浆需氧脱氢酶(如黄嘌呤氧化酶等)也可催化生成O·-2。
细菌感染、组织缺氧等病理过程,环境、药物等外源因素也可导致细胞产生活性氧类。
2.氮平衡
氮总平衡:摄入氮 = 排出氮(正常成人)
氮正平衡:摄入氮 大于 排出氮(儿童、孕妇等)
氮负平衡:摄入氮 小于 排出氮(饥饿、消耗性疾病患者)
意义:可以反映体内蛋白质代谢的概况。
3.蛋白质消化的生理意义:
由大分子转变为小分子,便于吸收。
消除种属特异性和抗原性,防止过敏、毒性反应。
4.胰酶及其作用
胰酶是消化蛋白质的主要酶,最适pH为7.0左右,包括内肽酶和外肽酶。
内肽酶
水解蛋白质肽链内部的一些肽键,如胰蛋白酶、糜蛋白酶、弹性蛋白酶。
外肽酶
自肽链的末段开始,每次水解一个氨基酸残基,如羧基肽酶(A、B) 、氨基肽酶。
5.酶原激活的意义
可保护胰组织免受蛋白酶的自身消化作用。
保证酶在其特定的部位和环境发挥催化作用。
酶原还可视为酶的贮存形式。
6.氨基酸通过主动转运过程被吸收
吸收部位:主要在小肠
吸收形式:氨基酸、寡肽、二肽
吸收机制:耗能的主动吸收过程
7.蛋白质的降解途径
-1、蛋白质在溶酶体通过ATP-非依赖途径被降解
-2、蛋白质在蛋白酶体通过ATP-依赖途径被降解
8.转氨基作用的生理意义:转氨基作用不仅是体内多数氨基酸脱氨基的重要方式,也是机体合成非必需氨基酸的重要途径。
9.氨在血液中以丙氨酸及谷氨酰胺的形式转运
(一)通过丙氨酸-葡萄糖循环氨从肌肉运往肝 生理意义:肌肉中氨以无毒的丙氨酸形式运输到肝,肝为肌肉提供葡萄糖。
(二)通过谷氨酰胺氨从脑和肌肉等组织运往肝或肾 生理意义:谷氨酰胺是氨的解毒产物,也是氨的储存及运输形式。
10.氨的主要去路
体内氨的去路有:在肝内合成尿素,这是最主要的去路;合成非必需氨基酸及其它含氮化合物;合成谷氨酰胺;肾小管泌氨
1.复制的基本规律
复制的方式 ——半保留复制
双向复制
半不连续复制
半保留复制的意义:按半保留复制方式,子代DNA与亲代DNA的碱基序列一致,即子代保留了亲代的全部遗传信息,体现了遗传的保守性。
参与DNA复制的物质:
底物(substrate): dATP, dGTP, dCTP, dTTP;
聚合酶(polymerase): 依赖DNA的DNA聚合酶,简写为 DNA-pol;
模板(template): 解开成单链的DNA母链;
引物(primer): 提供3?-OH末端使dNTP可以依次聚合;
其他的酶和蛋白质因子。
聚合反应的特点:
DNA 新链生成需引物和模板;
新链的延长只可沿5? → 3?方向进行。
DNA复制的保真性至少要依赖三种机制:
遵守严格的碱基配对规律;
聚合酶在复制延长时对碱基的选择功能;
复制出错时DNA-pol的及时校读功能。
DNA连接酶功能:
DNA连接酶在复制中起最后接合缺口的作用。
在DNA修复、重组及剪接中也起缝合缺口作用。
也是基因工程的重要工具酶之一。
DNA损伤的修复
错配修复
直接修复
光修复
切除修复
重组修复
SOS修复
1.脂类的消化条件 部位:
条件:① 乳化剂(胆汁酸盐、甘油一酯、甘油二酯等)的乳化作用;
② 酶的催化作用
部位:主要在小肠上段
2.酮体生成的生理意义:
-酮体是肝脏输出能源的一种形式。并且酮体可通过血脑屏障,是肌肉尤其是脑组织的重要能源。
-酮体利用的增加可减少糖的利用,有利于维持血糖水平恒定,节省蛋白质的消耗。
3.PG、TX及LT的生理功能
-1. PG
PGE2诱发炎症,促局部血管扩张。
PGE2、PGA2 使动脉平滑肌舒张而降血压。
PGE2、PGI2抑制胃酸分泌,促胃肠平滑肌蠕动。
PGF2α使卵巢平滑肌收缩引起排卵,使子宫体收缩加强促分娩。
-2. TX
PGF2、TXA2 强烈促血小板聚集,并使血管收缩促血栓形成,PGI2 、PGI3对抗它们的作用。
TXA3促血小板聚集,较TXA2弱得多。
-3. LT
LTC4、LTD4及LTE4被证实是过敏反应的慢反应物质。
LTD4还使毛细血管通透性增加。
LTB4还可调节白细胞的游走及趋化等功能,促进炎症及过敏反应的发展。
4.甘油磷脂的合成
合成部位:全身各组织内质网,肝、肾、肠等组织最活跃。
5.胆固醇
分布:广泛分布于全身各组织中, 大约 ? 分布在脑、神经组织;肝、肾、肠等内脏、皮肤、脂肪组织中也较多;肌肉组织含量较低;肾上腺、卵巢等合成类固醇激素的腺体含量较高。 存在形式:游离胆固醇、胆固醇酯
胆固醇的生理功能:是生物膜的重要成分,对控制生物膜的流动性有重要作用;是合成胆汁酸、类固醇激素及维生素D等生理活性物质的前体。
6.载脂蛋白功能:
结合和转运脂质,稳定脂蛋白的结构
载脂蛋白可参与脂蛋白受体的识别:
载脂蛋白可调节脂蛋白代谢关键酶活性:
1.生物氧化与体外氧化之相同点和不同点:
同:生物氧化中物质的氧化方式有加氧、脱氢、失电子,遵循氧化还原反应的一般规律。 质在体内外氧化时所消耗的氧量、最终产物(CO2,H2O)和释放能量均相同。
不同:
反应环境温和,酶促反应逐步进行,能量逐步释放,能量容易捕获,ATP生成效率高。---能量突然释放。
通过加水脱氢反应使物质能间接获得氧,并增加脱氢的机会;脱下的氢与氧结合产生H2O,有机酸脱羧产生CO2。---物质中的碳和氢直接氧结合生成CO2和H2O 。
2.氧化呼吸链组分按氧化还原电位由低到高的顺序排列
标准氧化还原电位
拆开和重组
特异抑制剂阻断
还原状态呼吸链缓慢给氧
3.NADH氧化呼吸链:NADH →复合体Ⅰ→Q →复合体Ⅲ→Cyt c →复合体Ⅳ→O2
4.琥珀酸氧化呼吸链:琥珀酸 →复合体Ⅱ →Q →复合体Ⅲ→Cyt c →复合体Ⅳ→O2
5.ROS主要来源:
线粒体:超氧阴离子O·-2,是体内O·-2的主要来源; O·-2在线粒体中再生成H2O2和·OH。
过氧化酶体:FAD将从脂肪酸等底物获得的电子交给O2生成H2O2和羟自由基·OH。 胞浆需氧脱氢酶(如黄嘌呤氧化酶等)也可催化生成O·-2。
细菌感染、组织缺氧等病理过程,环境、药物等外源因素也可导致细胞产生活性氧类。
1.糖的分类:
单糖
寡糖
多糖
结合糖
2.糖的主要生理功能:
糖在生命活动中的主要作用是提供碳源和能源。
提供合成体内其他物质的原料。
作为机体组织细胞的组成成分。
3.糖的吸收
吸收部位:小肠上段
吸收形式:单糖
4.糖无氧氧化反应过程
第一阶段:由葡萄糖分解成丙酮酸,称之为糖酵解途径
第二阶段:由丙酮酸转变成乳酸。
5.丙酮酸脱氢酶复合体催化的反应过程:
-1. 丙酮酸脱羧形成羟乙基-TPP,由丙酮酸脱氢酶催化(E1)。
-2. 由二氢硫辛酰胺转乙酰酶(E2)催化形成乙酰硫辛酰胺-E2。
-3. 二氢硫辛酰胺转乙酰酶(E2)催化生成乙酰CoA, 同时使硫辛酰胺上的二硫键还原为2个巯基。
-4. 二氢硫辛酰胺脱氢酶(E3)使还原的二氢硫辛酰胺脱氢,同时将氢传递给FAD。
-5. 在二氢硫辛酰胺脱氢酶(E3)催化下,将FADH2上的H转移给NAD+,形成NADH+H+。
6.TCA循环步骤
-1乙酰CoA与草酰乙酸缩合成柠檬酸
-2柠檬酸经顺乌头酸转变为异柠檬酸
-3异柠檬酸氧化脱羧转变为α-酮戊二酸
-4α-酮戊二酸氧化脱羧生成琥珀酰CoA
-5琥珀酰CoA合成酶催化底物水平磷酸化反应
-6琥珀酸脱氢生成延胡索酸
-7延胡索酸加水生成苹果酸
-8苹果酸脱氢生成草酰乙酸
7.三羧酸循环的要点:
经过一次三羧酸循环,
-消耗一分子乙酰CoA;
-经四次脱氢,二次脱羧,一次底物水平磷酸化;
-生成1分子FADH2,3分子NADH+H+,2分子CO2, 1分子GTP;
-关键酶有:柠檬酸合酶,α-酮戊二酸脱氢酶复合体, 异柠檬酸脱氢酶。
-整个循环反应为不可逆反应。
8.影响TCA循环的速率和流量的三因素
底物的供应量,催化循环最初几步反应酶的反馈别构抑制,产物堆积的抑制作用。
9.TCA循环中有3个关键酶
柠檬酸合酶
异柠檬酸脱氢酶
α-酮戊二酸脱氢酶
10.TCA循环在3大营养物质代谢中具有重要生理意义
-TCA循环是3大营养素的最终代谢通路,其作用在于通过4次脱氢,为氧化磷酸化反应生成ATP提供还原当量。
-TCA循环是糖、脂肪、氨基酸代谢联系的枢纽。
11.巴斯德效应机制
有氧时,NADH+H+进入线粒体内氧化,丙酮酸进入线粒体进一步氧化而不生成乳酸; 缺氧时,酵解途径加强,NADH+H+在胞浆浓度升高,丙酮酸作为氢接受体生成乳酸。
12.磷酸戊糖途径的反应过程
-第一阶段:氧化反应 生成磷酸戊糖,NADPH+H+及CO2。
-第二阶段:非氧化反应 包括一系列基团转移。
13.磷酸戊糖途径的特点:
脱氢反应以NADP+为受氢体,生成NADPH+H+。
反应过程中进行了一系列酮基和醛基转移反应,经过了3、4、5、6、7碳糖的演变过程。
反应中生成了重要的中间代谢物——5-磷酸核糖。
一分子G-6-P经过反应,只能发生一次脱羧和二次脱氢反应,生成一分子CO2和2分子NADPH+H+。
14.糖异生过程:
糖异生途径与酵解途径大多数反应是共有的、可逆的;
酵解途径中有3个由关键酶催化的不可逆反应。在糖异生时,须由另外的反应和酶代替。
15.糖异生最主要的生理作用
维持血糖水平的恒定
16.乳酸循环生理意义:
乳酸再利用,避免了乳酸的损失。
防止乳酸的堆积引起酸中毒。
17.血糖水平恒定的生理意义:保证重要组织器官的能量供应,特别是某些依赖葡萄糖供能的组织器官。
18.胰岛素的作用机制:
-促进肌、脂肪组织等的细胞膜葡萄糖载体将葡萄糖转运入细胞。
-通过增强磷酸二酯酶活性,降低cAMP水平,从而使糖原合酶活性增强、磷酸化酶活性降低,加速糖原合成、抑制糖原分解。
-通过激活丙酮酸脱氢酶磷酸酶而使丙酮酸脱氢酶激活,加速丙酮酸氧化为乙酰CoA,从而加快糖的有氧氧化。
-抑制肝内糖异生。这是通过抑制磷酸烯醇式丙酮酸羧激酶的合成以及促进氨基酸进入肌组织并合成蛋白质,减少肝糖异生的原料。
-通过抑制脂肪组织内的激素敏感性脂肪酶,可减缓脂肪动员的速率。
19.胰高血糖素的作用机制:
-经肝细胞膜受体激活依赖cAMP的蛋白激酶,从而抑制糖原合酶和激活磷酸化酶,迅速使肝糖原分解,血糖升高。
-通过抑制6-磷酸果糖激酶-2,激活果糖双磷酸酶-2,从而减少2,6-双磷酸果糖的合成,后者是6-磷酸果糖激酶-1的最强的变构激活剂以及果糖双磷酸酶-1的抑制剂。于是糖酵解被抑制,糖异生则加速。
-促进磷酸烯醇式丙酮酸羧激酶的合成;抑制肝L型丙酮酸激酶;加速肝摄取血中的氨基酸,从而增强糖异生。
-通过激活脂肪组织内激素敏感性脂肪酶,加速脂肪动员,从而间接升高血糖水平。
20.糖皮质激素的作用机制:
-促进肌肉蛋白质分解,分解产生的氨基酸转移到肝进行糖异生。
-抑制肝外组织摄取和利用葡萄糖,抑制点为丙酮酸的氧化脱羧。
21.低血糖的原因:
-胰性(胰岛β-细胞机能亢进、胰岛α-细胞机能低下等);
-肝性(肝癌、糖原累积病等);
-内分泌异常(垂体机能低下、肾上腺皮质机能低下等);
-肿瘤(胃癌等);
-饥饿或不能进食者等。
22.高血糖的原因:
糖尿病;
遗传性胰岛素受体缺陷
某些慢性肾炎、肾病综合症等;
生理性高血糖和糖尿。
细胞传导信号的基本方式:改变细胞内各种信号转导分子的构象,改变信号转导分子的定位,促进各种信号转导分子复合物的形成或结聚,改变小分子信使的细胞浓度或分布。
1.核酸的分类及分布
脱氧核糖核酸:存在于细胞核和线粒体,携带遗传信息,并通过复制传递给下一代。
核糖核酸:分布于细胞核、细胞质、线粒体,是DNA转录的产物,参与遗传信息的复制与表达。某些病毒RNA也可作为遗传信息的载体.
2.核酸的一级结构
定义:核酸中核苷酸的排列顺序。由于核苷酸间的差异主要是碱基不同,所以也称为碱基序列。
6.DNA是遗传信息的物质基础
-DNA的基本功能是以基因的形式荷载遗传信息,并作为基因复制和转录的模板。它是生命遗传的物质基础,也是个体生命活动的信息基础。
-基因从结构上定义,是指DNA分子中的特定区段,其中的核苷酸排列顺序决定了基因的功能。
7.RNA的特点
RNA与蛋白质共同负责基因的表达和表达过程的调控。
RNA通常以单链的形式存在,但有复杂的局部二级结构或三级结构。
RNA比DNA小的多。
RNA的种类、大小和结构远比DNA表现出多样性。
8.mRNA是蛋白质合成中的模板
-信使RNA是合成蛋白质的模板。
-不均一核RNA(hnRNA)含有内含子和外显子。
-外显子是氨基酸的编码序列,而内含子是非编码序列。
-hnRNA经过剪切后成为成熟的mRNA。
9.帽子结构和多聚A尾的功能
mRNA核内向胞质的转位
mRNA的稳定性维系
翻译起始的调控
10.mRNA依照自身的碱基顺序指导蛋白质氨基酸顺序的合成
从mRNA分子5'末端起的第一个AUG开始,每3个核苷酸为一组称为密码子(codon)或三联体密码
AUG被称为起始密码子;决定肽链终止的密码子则称为终止密码子。
位于起始密码子和终止密码子之间的核苷酸序列称为开放阅读框(open reading frame, ORF),决定了多肽链的氨基酸序列 。
11.tRNA是蛋白质合成中的氨基酸载体
转运RNA(transfer RNA, tRNA)在蛋白质合成过程中作为各种氨基酸的载体, 将氨基酸转呈给mRNA。
由74~95核苷酸组成
占细胞总RNA的15%
具有很好的稳定性。
12.tRNA的二级结构:三叶草形
氨基酸臂,DHU环,反密码环,YC环,附加叉
13.以rRNA为组分的核蛋白体是蛋白质合成的场所
核蛋白体RNA(ribosomal RNA,rRNA)是细胞内含量最多的RNA(>80%)。
rRNA与核蛋白体蛋白结合组成核蛋白体(ribosome),为蛋白质的合成提供场所。
14.snmRNA参与了基因表达的调控
细胞的不同部位存在的许多其他种类的小分子RNA,统称为非mRNA小RNA。
RNA组学是研究细胞内snmRNA的种类、结构和功能。同一生物体内不同种类的细胞、同一细胞在不同时空状态下snmRNAs表达谱的变化,以及与功能之间的关系。
15.snmRNAs的种类
核内小RNA,核仁小RNA,胞质小RNA,催化性小RNA,小片段干涉RNA。
16.snmRNAs的功能
参与hnRNA的加工剪接
17.核酸的理化性质
-核酸的酸碱及溶解度性质:核酸为多元酸,具有较强的酸性。
-核酸的高分子性质:粘度:DNA大于RNA dsDNA大于ssDNA。沉降行为:不同构象的核酸分子的沉降的速率有很大差异,这是超速离心法提取和纯化核酸的理论基础。
18.核酸酶分类
依据底物不同分类:DNA酶:专一降解DNA RNA酶:专一降解RNA
依据切割部位不同:核酸内切酶:分为限制性核酸内切酶和非特异性限制性核酸内切酶。 核酸外切酶:5′→3′或3′→5′核酸外切酶。
19.核酸酶的功能
参与DNA的合成、修复以及RNA的剪接。
清除多余的、结构和功能异常的核酸,以及侵入细胞的外源性核酸。
降解食物中的核酸。
体外重组DNA技术中的重要工具酶 。
1.酶的不同形式:
单体酶:仅具有三级结构的酶。
寡聚酶:由多个相同或不同亚基以非共价键连接组成的酶。
多酶体系:由几种不同功能的酶彼此聚合形成的多酶复合物。
多功能酶或串联酶:一些多酶体系在进化过程中由于基因的融合,多种不同催化功能存在于一条多肽链中,这类酶称为多功能酶。
2.全酶分子中各部分在催化反应中的作用:
酶蛋白决定反应的特异性
辅助因子决定反应的种类与性质
3.金属离子是最多见的辅助因子
金属酶:金属离子与酶结合紧密,提取过程中不易丢失。
金属激活酶:金属离子为酶的活性所必需,但与酶的结合不甚紧密。
4.金属离子的作用:
参与催化反应,传递电子;
在酶与底物间起桥梁作用;
稳定酶的构象;
中和阴离子,降低反应中的静电斥力等。
5.辅酶的主要作用:其主要作用是参与酶的催化过程,在反应中传递电子、质子或一些基团。
6.酶与一般催化剂的共同点:
在反应前后没有质和量的变化;
只能催化热力学允许的化学反应;
只能加速可逆反应的进程,而不改变反应的平衡点。
7.酶促反应的特点:
(一)酶促反应具有极高的效率
(二)酶促反应具有高度的特异性(一种酶仅作用于一种或一类化合物,或一定的化学键,
催化一定的化学反应并生成一定的产物。酶的这种特性称为酶的特异性或专一性。)
(三)酶促反应的可调节性
8.酶的特异性可大致分为以下3种类型:
-绝对特异性:只能作用于特定结构的底物,进行一种专一的反应,生成一种特定结构的产
物 。
-相对特异性:作用于一类化合物或一种化学键。
-立体结构特异性:作用于立体异构体中的一种。
9.酶的催化机制呈多元催化作用
一般酸-碱催化作用
共价催化作用
亲核催化作用
10.底物足够时酶浓度对反应速率的影响呈直线关系:在酶促反应系统中,当底物浓度大大
超过酶的浓度,酶被底物饱和时,反应速率达最大速率。此时,反应速率和酶浓度变化呈正
比关系。
11.酶的最适温度不是酶的特征性常数,它与反应进行的时间有关。
酶的活性虽然随温度的下降而降低,但低温一般不使酶破坏。温度回升后,酶又恢复其活性。
12.酶的抑制区别于酶的变性:
抑制剂对酶有一定选择性
引起变性的因素对酶没有选择性
13.抑制作用的类型:
不可逆性抑制
可逆性抑制:竞争性抑制 非竞争性抑制 反竞争性抑制
14.竞争性抑制特点:I与S结构类似,竞争酶的活性中心;抑制程度取决于抑制剂与酶的相
对亲和力及底物浓度;动力学特点:Vmax不变,表观Km增大。
15.非竞争性抑制特点:抑制剂与酶活性中心外的必需基团结合,底物与抑制剂之间无竞争
关系;抑制程度取决于抑制剂的浓度;动力学特点:Vmax降低,表观Km不变。
16.反竞争性抑制特点:抑制剂只与酶-底物复合物结合;抑制程度取决与抑制剂的浓度及
底物的浓度;动力学特点:Vmax降低,表观Km降低。
17.激活剂种类:必需激活剂 非必需激活剂
18.酶的调节方式:酶活性的调节(快速调节) 酶含量的调节(缓慢调节)
19.酶原激活的机理:
酶原---(特定条件下)--一个或几个特定的肽键断裂,水解掉一个或几个短肽----分子构象发
生改变---形成或暴露出酶的活性中心
20.酶原激活的生理意义:避免细胞产生的酶对细胞进行自身消化,并使酶在特定的部位和
环境中发挥作用,保证体内代谢正常进行。
21.酶的分类:
氧化还原酶类
转移酶类
水解酶类
裂解酶类
异构酶类
合成酶类
7. 蛋白质的组成
根据蛋白质组成成分:单纯蛋白质 结合蛋白质=蛋白质部分+非蛋白质部分
根据蛋白质形状:纤维状蛋白质 球状蛋白质
分子伴侣:通过提供一个保护环境从而加速蛋白质折叠成天然构象或形成四级结构。
分子伴侣可逆地与未折叠肽段的疏水部分结合随后松开,如此重复进行可防止错误的聚集发生,使肽链正确折叠。
分子伴侣也可与错误聚集的肽段结合,使之解聚后,再诱导其正确折叠。
分子伴侣在蛋白质分子折叠过程中二硫键的正确形成起了重要的作用。
3.蛋白质的一级结构
定义:蛋白质的一级结构指在蛋白质分子从N-端至C-端的氨基酸排列顺序。
主要的化学键:肽键,有些蛋白质还包括二硫键。
一级结构是蛋白质空间构象和特异生物学功能的基础,但不是决定蛋白质空间构象的唯一因素。
酮体的生成和利用的生理意义。(1) 酮体是脂酸在肝内正常的中间代谢产物,是甘输出能源的一种形式;(2)酮体是肌肉尤其是脑的重要能源。酮体分子小,易溶于水,容易透过血脑屏障。体内糖供应不足(血糖降低)时,大脑不能氧化脂肪酸,这时酮体是脑的主要能源物质。
试述乙酰CoA在脂质代谢中的作用. 在机体脂质代谢中,乙酰CoA主要来自脂肪酸的β氧化,也可来自甘油的氧化分解;乙酰CoA在肝中可被转化为酮体向肝外运送,也可作为脂肪酸生物合成及细胞胆固醇合成的基本原料。
试述人体胆固醇的来源与去路? 来源:⑴从食物中摄取⑵机体细胞自身合成 去路:⑴在肝脏可转换成胆汁酸⑵在性腺,肾上腺皮质可以转化为类固醇激素⑶在欺负可以转化为维生素D3⑷用于构成细胞膜⑸酯化成胆固醇酯,储存在细胞液中⑹经胆汁直接排除肠腔,随粪便排除体外。
酶的催化作用有何特点? ①具有极高的催化效率,如酶的催化效率可比一般的催化剂高10 8~1020 倍;②具有高度特异性:即酶对其所催化的底物具有严格的选择性,包括:绝对特异性、相对特异性、立体异构特异性;③酶促反应的可调节性:酶促反应受多种因素的调控,以适应机体不断变化的内外环境和生命活动的需要。
6 简述km与vm的意义。 Km⑴等于当V=Vm/2时的[S]。Km⑵的意义:Km①值是酶的
特征性常数——代表酶对底物的催化效率。当[S]相同时,Km小——V大;K②m值可近似表示酶与底物的亲和力:1/Km大,亲和力大;1/Km小,亲和力小;③可用以判断酶的天然底物:Km最小者为该酶的天然底物。Vm⑶的意义:Vm是酶完全被底物饱和时的反应速率,与酶浓度成正比。
7 温度对酶促反应有何影响。 (1) 温度升高对V的双重影响:①与一般化学反应一样,温度升高可增加反应分子的碰撞机会,使V增大;②温度升高可加速酶变性失活,使酶促反应V变小(2)温度对V影响的表现:①温度较低时,V随温度升高而增大(低温时由于活化分子数目减少,反应速度降低,但温度升高时,酶活性又可恢复)②达到某一温度时,V最大。使酶促反应V达到最大时的反应温度称为酶的最适反应温度(酶的最适温度不是酶的特征性常数)③反应温度达到或超过最适温度后,随着反应温度的升高,酶蛋白变性,V下降。
8 竞争性抑制作用的特点是什么?(1) 竞争性抑制剂与酶的底物结构相似8 竞争性抑制作用的特点是什么? (1) 竞争性抑制剂与酶的底物结构相似 (2)抑制剂与底物相互竞争与酶的活性中心结合(3)抑制剂浓度越大,则抑制作用越大,但增加底物浓度可使抑制程度减小甚至消除(4)动力学参数:Km值增大,Vm值不变。
说明酶原与酶原激活的意义。 (1)有些酶(绝大多数蛋白酶)在细胞内合成或初分泌时没有活性,这些无活性的酶的前身物称为酶原。酶原激活是指酶原在一定条件下转化为有活性的酶的过程。酶原激活的机制:酶原分子内肽链一处或多处断裂,弃去多余的肽段,构象变化,活性中心形成,从而使酶原激活。(2)酶原激活的意义:①消化道内蛋白酶以酶原形式分泌,保护消化器官自身不受酶的水解(如胰蛋白酶),保证酶在特定部位或环境发挥催化作用;②酶原可以视为酶的贮存形式(如凝血酶和纤维蛋白溶解酶),一旦需要转化为有活性的酶,发挥其对机体的保护作用。
什么叫同工酶?有何临床意义? (1)同工酶是指催化的化学反应相同,而酶蛋白的分子结构、理化性质及免疫学性质不同的一组酶下称为同工酶。(2)其临床意义:①属同工酶的几种酶由于催化活性有差异及体内分布不同,有利于体内代谢的协调。②同工酶的检测有助于对某些疾病的诊断及鉴别诊断.当某组织病变时,可能有特殊的同工酶释放出来,使该同工酶活性升高。如:冠心病等引起的心肌受损患者血清中LDH1 和LDH2 增高,LDH1 大于LDH2 ;肝细胞受损患者血清中LDH5 含量增高。
简述糖酵解的生理意义 (1) 在无氧和缺氧条件下,作为糖分解功能的补充途径(2)在有氧条件下,作为某些组织细胞主要的供能途径:①成熟红细胞(没有线粒体,不能进行有氧氧化②神经、白细胞、骨髓、视网膜、皮肤等在氧供应充足时仍主要靠糖酵解供能。
12 简述糖异生的生理意义 (1) 在饥饿情况下维持血糖浓度的相对恒定。(2)补充和恢复肝糖原。(3)维持酸碱平衡:肾的糖异生有利于酸性物质的排泄。(4)回收乳酸分子中的能量(乳酸循环)。
14 糖酵解与有氧氧化的比较 糖酵解:反应条件:供氧不足或不需氧;进行部位:胞液;关键酶:己糖激酶(或葡萄糖激酶)、磷酸果糖-1、丙酮酸激酶;产物:乳酸、ATP;能量:1mol葡萄糖净得2molATP;生理意义:迅速供能,某些组织依赖糖酵解供能。有氧氧化:反应条件:有氧情况;进行部位:胞液和线粒体;关键酶:己糖激酶等三个酶及丙酮酸脱氢酶系、异柠檬酸脱氢酶、柠檬酸合酶、α-酮戊二酸脱氢酶系;产物:H2O、CO2 、ATP;
能量:1mol葡萄糖净得36mol或38molATP;生理意义:是机体获取能量主要方式
何谓蛋白质的变性作用?引起蛋白质变性的因素有哪些?蛋白质变性的本质是什么?变性后有何特性? (1) 蛋白质的变性作用是指蛋白质分子在某些理化因素作用下,其特定的空间结构被破坏而导致理化性质改变及生物学活性丧失的现象。(2)引起蛋白质变性的因素:物理因素有加热、紫外线、X射线、高压、超声波等;化学因素有极端pH值(强酸、强碱)、重金属盐、丙酮等有机溶剂。(3)蛋白质变性的本质是:次级键断链,空间结构破坏,一级结构不受影响。
(4)变性后的特性:①活性丧失:空间结构破坏使Pr的活性部位解体②易发生沉淀:疏水基团外露,亲水性下降;③易被蛋白酶水解:肽键暴露出来④扩散常数降低,溶液的粘度增加。
比较DNA和RNA分子组成的异同?
组成成分 DNA RNA
磷酸 磷酸P 磷酸P
戊糖 2- 脱氧核糖(dR) 核糖(R)
碱基 腺嘌呤A、鸟嘌呤G、;胞嘧啶C、胸腺嘧啶T ;腺嘌呤A、鸟嘌呤G、;胞嘧啶C、尿嘧啶U
简述DNA结构模型的要点. ①反向平行,右双螺旋;②碱基在螺旋内侧,磷酸核糖的骨架在外侧;③碱基配对A=T,G=C;④螺旋的稳定因素为氢键和碱基堆砌力101p/⑤螺旋,螺旋的螺距为3.4nm,直径为2nm;⑥有大沟,小沟。
血浆脂蛋白的来源主要生理功能如下:
①CM由小肠黏膜细胞合成,功能是转运外源性甘油三酯和胆固醇;②VLDL由肝细胞合成、分泌,功能是转运内源性甘油三酯和胆固醇;③LDL由VLDL在血浆中转化而来,功能是转运内源性胆固醇,即将胆固醇由肝转运至肝外组织;④HDL主要由肝细胞合成、分泌,功能是逆向转运胆固醇,即将胆固醇由肝外组织转运到肝。
脂肪的生物功能: 脂类是指一类在化学组成和结构上有很大差异,但都有一个共同特性,即不溶于水而易溶于乙醚、氯仿等非极性溶剂中的物质。通常脂类可按不同组成分为五类,即单纯脂、复合脂、萜类和类固醇及其衍生物、衍生脂类及结合脂类。 脂类物质具有重要的生物功能。脂肪是生物体的能量提供者。 脂肪也是组成生物体的重要成分,如磷脂是构成生物膜的重要组分,油脂是机体代谢所需燃料的贮存和运输形式。脂类物质也可为动物机体提供溶解于其中的必需脂肪酸和脂溶性维生素。某些萜类及类固醇类物质如维生素A、D、E、K、胆酸及固醇类激素具有营养、代谢及调节功能。有机体表面的脂类物质有防止机械损伤与防止热量散发等保护作用。脂类作为细胞的表面物质,与细胞识别,种特异性和组织免疫等有密切关系。
磷脂的生成 磷脂酸是最简单的磷脂,也是其他甘油磷脂的前体。磷脂酸与CTP反应生成CDP-二酰甘油,在分别与肌醇、丝氨酸、磷酸甘油反应,生成相应的磷脂。磷脂酸水解成二酰甘油,再与CDP-胆碱或CDP-乙醇胺反应,分别生成磷脂酰胆碱和磷脂酰乙醇胺
比较脂肪酸氧化和合成的差异:氧化在线粒体,合成在胞液;氧化的酰基载体是辅酶A,合成的酰基载体是酰基载体蛋白;氧化是FAD和NAD+,合成是NADPH;氧化是L型,合成是D型。氧化不需要CO2,合成需要CO2;氧化为高ADP水平,合成为高ATP水平。
氧化是羧基端向甲基端,合成是甲基端向羧基端;脂肪酸合成酶系为多酶复合体,而不是氧化酶。
软脂酸的合成:软脂酸是十六碳饱和脂肪酸,在细胞液中合成,合成软脂酸需要两个酶系统参加。一个是乙酰CoA羧化酶,他包括三种成分,生物素羧化酶、生物素羧基载体蛋白、转羧基酶。由它们共同作用,催化乙酰CoA转变为丙二酸单酰CoA。另一个是脂肪酸合成酶,该酶是一个多酶复合体,包括6种酶和一个酰基载体蛋白,在它们的共同作用下,催化乙酰CoA和丙二酸单酰CoA,合成软脂酸其反应包括4步,即缩合、还原、脱水、再缩合,每经过4步循环,可延长2个碳。如此进行,经过7次循环即可合成软脂酰—ACP。软脂酰—ACP在硫激酶作用下分解,形成游离的软脂酸。软脂酸的合成是从原始材料乙酰CoA开始的所以称之为从头合成途径。
硬脂酸的合成:在动物中,合成地点有两处,即线粒体和粗糙内质网。在线粒体中,合成硬脂酸的碳原子受体是软脂酰CoA,碳原子的给体是乙酰CoA。在内质网中,碳原子的受体也是软脂酰CoA,但碳原子的给体是丙二酸单酰CoA。在植物中,合成地点是细胞溶质。碳原子的受体不同于动物,是软脂酰ACP;碳原子的给体也不同与动物,是丙二酸单酰ACP。在两种生物中,合成硬脂酸的还原剂都是一样的。
在脂肪酸合成中,乙酰CoA羧化酶起什么作用?
在饱和脂肪酸的生物合成中,脂肪酸碳链的延长需要丙二酸单酰CoA。乙酰CoA羧化酶的作用就是催化乙酰CoA和HCO3-合成丙二酸单酰CoA,为脂肪酸合成提供三碳化合物。乙酰CoA羧化酶催化反应。乙酰CoA羧化酶是脂肪酸合成反应中的一种限速调节酶,它受柠檬酸的激活,但受棕榈酸的反馈抑制。
1mol葡萄糖彻底氧化分解生成多少个ATP
酵解阶段产生2molATP,三羧酸循环阶段产生2molATP,氧化磷酸化阶段产生26—28molATP,总共产生30—32molATP。
常见的呼吸链抑制剂有哪些?它们的作用机制是什么?
呼吸链抑制剂(电子传递抑制剂):使氧化受阻则偶联的磷酸化也无法进行。电子传递抑制剂按其作用部位不同可分为下列三种类型:
鱼藤酮、安密妥、杀蝶素A:阻断电子由NADH脱氢酶的Fe-S中心向CoQ传递。 抗霉素A:阻断电子由细胞色素b向细胞色素c1传递。
CO、H2S、氰化物、叠氮化物:阻断电子由细胞色素aa3向分子氧传递
蛋白激酶C(pkc)的作用:
1、对代谢的调节:PKC被激活后可引起一系列靶蛋白的丝残基发生磷酸化,改
变靶蛋白的活性和性质,影响细胞内信息的传递,启动一系列生理生化反应。
2、对基因表达的调节:PKC能使立早基因的反式作用因子磷酸化,加速立早基
因的表达。立早基因的表达产物具有跨越核膜传递信息的功能,又称第三信使。第三信使受磷酸化修饰后,可活化晚起反应基因并导致细胞增生或核型变化。
3.答:相同点:①均为激素水平的调节;②均以激素-受体复合物形式参与信号转导。 不同点:
膜受体信号转导途径 胞内受体信号转导途径
激素:水溶性激素;脂溶性激素
受体:膜受体;胞内受体
第二信使:有;无
作用机制:通过第二信使激活蛋白激酶,使蛋白磷酸化,表现出生理效应;激素-受体复合物作为核内反式作用因子与激素反应元件结合,调节基因转录,表现生理效应
尿液生成的基本过程
尿生成包括三个过程:(一)肾小球的滤过 血液流经肾小球时,血浆中水、无机盐和小分子有机物在有效滤过压的推动下,透过滤过膜进入肾小囊生成滤液,即原尿。滤过膜具有较大的通透性和有效面积,而滤过的原动力为较高的肾小球的毛细血管血压,减去血浆胶体渗透压和囊内压的阻力,即有效滤过压。在正常的肾血浆流量和有效滤过压的驱使下,每日可生成原尿约180升。(二)肾小管和集合管的重吸收 原尿进入肾小管后成为小管液。小管液经小管细胞的选择性重吸收,将对机体有用的能源物质如葡萄糖、氨基酸等全部重吸收;水、Na+、Cl-、HCO3-等大部分重吸收,对尿素等小部分重吸收;对机体无用的肌酐等代谢物质不被重吸收,反被分泌。重吸收的物质,进入小管周围毛细血管,再入血循环。在水和离子的重吸收中,ADH和醛固酮等体液因子其重要调节作用。(三)肾小管和集合管的分泌和排泄 由肾小管分泌的物质有H+、K+和NH3等;排泄的物质有肌酐、对氨基马尿酸以及进入机体的某些药物如青霉素、酚红等。由肾小球滤出的原尿,经肾小管和集合管的重吸收和分泌,使原尿的质和量都发生了很大变化,最后形成终尿排出。正常每日生成终尿量约
1.5升。
大失血使尿量减少。原因有以下三个方面:
(一) 血压降低引起交感-肾上腺髓质系统兴奋,通过交感神经直接作用和肾上腺髓质激素间接作用,导致肾小球毛细血管血压明显降低,有效滤过压降低;同时肾小球血流量减少,两者均可使肾小球滤过率下降,尿量减少。
(二) 循环血量减少,对左心房容量感受器刺激减弱,反射性地引起ADH释放增加,促进远曲小管和集合管对水的重吸收,使尿量减少
4肾脏的泌尿功能在维持机体内环境稳定中有何生理意义?
肾脏的泌尿机能对于维持机体内环境理化性质的相对恒定,有极为重要的生理意义。
(一)排泄机能 这与肾小球滤过、肾小管和集合管的选择性重吸收和分泌作用有关。可排出大量代谢终产物,主要有尿素、尿酸、肌酐、氨等。此外,尚可排泄进入机体的物质如青霉素、酚红等。
(二)维持水和渗透压的平衡 主要与肾小管和集合管对水的重吸收有关。当摄入水量增加、血浆晶体渗透压降低时,抑制抗利尿激素的分泌,肾小管和集合管对水的重吸收减少,尿量增加;反之,摄入水量减少,抗利尿激素的分泌增加,肾小管和集合管对水的重吸收增加,尿量减少。通过上述作用以维持体液容量和晶体渗透压的相对恒定。
(三)维持电解质平衡 主要与肾小管和集合管对Na+、Ca2+、磷的重吸收以及对K+的分泌作用有关。例如,当血K+浓度升高,血Na+浓度降低可直接刺激肾上腺皮质分泌醛固酮,促进远曲小管和集合管对Na+的重吸收和K+的分泌;而血Ca2+和血磷主要受甲状旁腺激素
和降钙素等的调节。所以,通过对肾小管和集合管重吸收和分泌的调节,可维持血Na+、Ca2+和血磷的正常浓度。
(四)维持pH的相对恒定 主要与肾小管和集合管的泌氢、泌氨等排酸保碱作用有关。体液pH降低时,H+分泌增多,H+-Na+交换增强;NH3形成增多,换回Na+增多,NaHCO3重吸收增多。相反,则碱性物质排出增多,从而维持pH的相对恒定。
何谓氧解离曲线? 试分析氧解离曲线的特点及其生理意义?
氧解离曲线是表示Hb氧饱和度与PCO2关系的曲线。曲线近似“S”形,可分为上、中、下三段。
(一) 氧解离曲线上段 曲线较平坦,相当于PO2由13.6kPa变化到8.0kPa时,表明这段期间PO2的变化较大,而对Hb氧饱和度影响不大。只要PO2不低于8.0kPa,Hb氧饱和度仍能保持90%以上,血液仍有较高的载氧能力,从肺部携带足够量的氧气到组织,不致发生明显的低氧血症,显示该段对吸入气的PO2变化有缓冲功能。
(二) 氧解离曲线中段 该段曲线较陡,相当于PO28.0-5.3kPa,是HbO2释放O2的部分,在此段,PO2稍有下降,Hb氧饱和度下降较大,因而能释放较多的O2满足机体在安静状态或轻微活动时对O2的需求。
(三) 氧解离曲线的下段 相当于PO2 5.3-2.0kPa,此段曲线为最陡的一段。表明O2大量释放出来,此时,O2的利用系数可提高到75%,为安静时的3倍,以满足组织活动增强时对O2的需要。因此,该段曲线也代表了机体对O2的储备。
试从正负两方面叙述动脉血中二氧化碳CO2分压升高,O2分压降低对呼吸的影响及其机制 CO2是调节呼吸的最重要的化学因素,在血液中保持一定的浓度,可以维持呼吸中枢的正常兴奋性。在一定范围内,动脉血PCO2升高,可引起呼吸加深加快,肺通气量增加。CO2对呼吸的刺激作用是通过两条途径实现的。(一)刺激中枢化学感受器中枢化学感受器对脑脊液中的H+敏感,而CO2却很容易通过。当血液中PCO2升高时,CO2通过血-脑屏障进入脑脊液,与H2O结合成H2CO3,随即解离出H+以刺激中枢化学感受器。在通过一定的神经联系使延髓呼吸中枢兴奋,而增强呼吸运动。(二)刺激外周化学感受器血液中PCO2升高,刺激颈动脉体和主动脉体的外周化学感受器,兴奋经窦神经和主动脉神经传入到延髓,使呼吸中枢兴奋,呼吸加深加快。在CO2对呼吸调节的上述两种途径中,中枢化学感受器的兴奋途径是主要的。但是,当吸入气中的CO2浓度大于7%时,可引起呼吸中枢麻痹,使呼吸抑制。吸入气中PO2下降可以反射性的引起呼吸加深加快。低O2对呼吸中枢的直接作用为抑制,缺O2对呼吸的刺激作用完全是通过外周化学感受器来实现的。当机体PO2低于10.6Pa以下时,来自外周化学感受器的传入冲动,在一定程度上可以对抗低O2对中枢的直接抑制作用,促进呼吸中枢兴奋,反射性的是呼吸增强。动脉血PO2降低通过刺激外周化学感受器而兴奋呼吸的这种作用,对于正常呼吸的调节意义不大,但是在某些特殊情况下,却是机体的一种重要的保护机制,可防止呼吸中枢因缺乏兴奋来源而呼吸停止。例如,在严重肺气肿、肺心病患者,长期的肺换气障碍导致低O2和CO2滞留,中枢化学感受器对CO2的敏感性降低。此时,将主要依靠低O2刺激外周化学感受器的途径增强肺通气量,以补偿肺部的气体交换不足。但是,在机体严重缺O2时,由于外周化学感受器的兴奋作用不足以克服缺O2对呼吸中枢的直接抑制作用,则将发生呼吸渐弱,甚至呼吸停止。
胆汁酸的肠肝循环:
胆汁酸由肝细胞分泌,经肝左右管-肝总管-胆总管.进入十二指肠.参加消化.然后在小肠胆汁酸可被重吸收,经肝门静脉进入肝.完成循环.
生理意义:①保证了胆汁酸的量;②增加了胆汁酸的利用率.
遗传密码如何编码?有哪些基本特性?
mRNA上每3个相邻的核苷酸编成一个密码子,代表某种氨基酸或肽链合成的起始或终止信(4种核苷酸共组成64个密码子)
其特点有:1方向性:编码方向是5\'-3\';2无标点性:密码子连续排列,既无间隔又无重叠;3简并性:除了Met和Trp各只有一个密码之外,其余每种氨基酸都有2--6个密码子;4通用性:不同生物共用一套密码5摆动性:在密码子与反密码子相互识别的过程中密码子的第一个核苷酸起决定性作用,而第二个,尤其是第三个核苷酸能够在一定范围内进行变动
简述各种RNA在蛋白质合成中的作用
mRNA:在蛋白质生物合成中,mRNA能够作为翻译的直接模板,由mRNA线性单链分子中每相邻3个核苷酸碱基组成代表一种氨基酸的密码子。决定蛋白质分子中的氨基酸排列顺序。
tRNA:在蛋白质生物合成过程中,tRNA分子依赖其反密码环上的3个反密码子辨认mRNA密码子,依赖3\'端的CCA--OH末端结合特定的氨基酸。从而按密码子指令将特定氨基酸带到核糖体上“对号入座”,参与蛋白质多肽链的合成。 rRNA:核糖体是由几种rRNA与数十种蛋白质共同构成的超大分子复合体。核糖体的作用是将氨基酸连接起来构成多肽链的“装配机”,即是蛋白质生物合成的场所。
酶的催化作用有哪些特点?
高度不稳定(反应条件温和);催化活性高(比普通催化剂效能高10^7~10^3倍);具有高度选择性(延胡索酸酶对反式有活性);酶催化活性可以调节(激素,底物反馈调节,共价修饰调节,别构调节)。
