高中化学知识概括
一、俗名
无机部分:
纯碱、苏打、天然碱 、口碱:Na2CO3 小苏打:NaHCO3 大苏打:Na2S2O3 石膏(生石膏):CaSO4.2H2O 熟石膏:2CaSO4·.H2O 莹石:CaF2 重晶石:BaSO4(无毒) 碳铵:NH4HCO3 石灰石、大理石:CaCO3 生石灰:CaO 食盐:NaCl 熟石灰、消石灰:Ca(OH)2 芒硝:Na2SO4·7H2O (缓泻剂) 烧碱、火碱、苛性钠:NaOH 绿矾:FaSO4·7H2O 干冰:CO2 明矾:KAl (SO4)2·12H2O 漂白粉:Ca (ClO)2 、CaCl2(混和物) 泻盐:MgSO4·7H2O 胆矾、蓝矾:CuSO4·5H2O 双氧水:H2O2 皓矾:ZnSO4·7H2O 硅石、石英:SiO2 刚玉:Al2O3 水玻璃、泡花碱、矿物胶:Na2SiO3 铁红、铁矿:Fe2O3 磁铁矿:Fe3O4 黄铁矿、硫铁矿:FeS2 铜绿、孔雀石:Cu2 (OH)2CO3 菱铁矿:FeCO3 赤铜矿:Cu2O 波尔多液:Ca (OH)2和CuSO4 石硫合剂:Ca (OH)2和S 玻璃的主要成分:Na2SiO3、CaSiO3、SiO2 过磷酸钙(主要成分):Ca (H2PO4)2和CaSO4 重过磷酸钙(主要成分):Ca (H2PO4)2 天然气、沼气、坑气(主要成分):CH4 水煤气:CO和H2 硫酸亚铁铵(淡蓝绿色):Fe (NH4)2 (SO4)2 溶于水后呈淡绿色 光化学烟雾:NO2在光照下产生的一种有毒气体 王水:浓HNO3与浓HCl按体积比1:3混合而成。
铝热剂:Al + Fe2O3或其它氧化物。 尿素:CO(NH2) 2
有机部分:
氯仿:CHCl3 电石:CaC2 电石气:C2H2 (乙炔) TNT:三硝基甲苯 酒精、乙醇:C2H5OH
氟氯烃:是良好的制冷剂,有毒,但破坏O3层。 醋酸:冰醋酸、食醋 CH3COOH
裂解气成分(石油裂化):烯烃、烷烃、炔烃、H2S、CO2、CO等。 甘油、丙三醇 :C3H8O3
焦炉气成分(煤干馏):H2、CH4、乙烯、CO等。 石炭酸:苯酚 蚁醛:甲醛 HCHO
福尔马林:35%—40%的甲醛水溶液 蚁酸:甲酸 HCOOH 葡萄糖:C6H12O6 果糖:C6H12O6 蔗糖:C12H22O11 麦芽糖:C12H22O11 淀粉:(C6H10O5)n
硬脂酸:C17H35COOH 油酸:C17H33COOH 软脂酸:C15H31COOH
草酸:乙二酸 HOOC—COOH 使蓝墨水褪色,强酸性,受热分解成CO2和水,使KMnO4酸性溶液褪色。
二、 颜色
铁:铁粉是黑色的;一整块的固体铁是银白色的。 Fe2+——浅绿色 Fe3O4——黑色晶体
Fe(OH)2——白色沉淀 Fe3+——黄色 Fe (OH)3——红褐色沉淀 Fe (SCN)3——血红色溶液
FeO——黑色的粉末 Fe (NH4)2(SO4)2——淡蓝绿色 Fe2O3——红棕色粉末 FeS——黑色固体
铜:单质是紫红色 Cu2+——蓝色 CuO——黑色 Cu2O——红色 CuSO4(无水)—白色 CuSO4·5H2O——蓝色 Cu2 (OH)2CO3 —绿色 Cu(OH)2——蓝色 [Cu(NH3)4]SO4——深蓝色溶液
BaSO4 、BaCO3 、Ag2CO3 、CaCO3 、AgCl 、 Mg (OH)2 、三溴苯酚均是白色沉淀
Al(OH)3 白色絮状沉淀 H4SiO4(原硅酸)白色胶状沉淀
Cl2、氯水——黄绿色 F2——淡黄绿色气体 Br2——深红棕色液体 I2——紫黑色固体
HF、HCl、HBr、HI均为无色气体,在空气中均形成白雾
CCl4——无色的液体,密度大于水,与水不互溶 KMnO4--——紫色 MnO4-——紫色
Na2O2—淡黄色固体 Ag3PO4—黄色沉淀 S—黄色固体 AgBr—浅黄色沉淀
AgI—黄色沉淀 O3—淡蓝色气体 SO2—无色,有剌激性气味、有毒的气体
SO3—无色固体(沸点44.8 0C) 品红溶液——红色 氢氟酸:HF——腐蚀玻璃
N2O4、NO——无色气体 NO2——红棕色气体 NH3——无色、有剌激性气味气体
三、 现象:
1、铝片与盐酸反应是放热的,Ba(OH)2与NH4Cl反应是吸热的;
2、Na与H2O(放有酚酞)反应,熔化、浮于水面、转动、有气体放出;(熔、浮、游、嘶、红)
3、焰色反应:Na 黄色、K紫色(透过蓝色的钴玻璃)、Cu 绿色、Ca砖红、Na+(黄色)、K+(紫色)。
4、Cu丝在Cl2中燃烧产生棕色的烟; 5、H2在Cl2中燃烧是苍白色的火焰;
6、Na在Cl2中燃烧产生大量的白烟; 7、P在Cl2中燃烧产生大量的白色烟雾;
8、SO2通入品红溶液先褪色,加热后恢复原色;
9、NH3与HCl相遇产生大量的白烟; 10、铝箔在氧气中激烈燃烧产生刺眼的白光;
11、镁条在空气中燃烧产生刺眼白光,在CO2中燃烧生成白色粉末(MgO),产生黑烟;
12、铁丝在Cl2中燃烧,产生棕色的烟; 13、HF腐蚀玻璃:4HF + SiO2 = SiF4 + 2H2O
14、Fe(OH)2在空气中被氧化:由白色变为灰绿最后变为红褐色;
15、在常温下:Fe、Al 在浓H2SO4和浓HNO3中钝化;
16、向盛有苯酚溶液的试管中滴入FeCl3溶液,溶液呈紫色;苯酚遇空气呈粉红色。
17、蛋白质遇浓HNO3变黄,被灼烧时有烧焦羽毛气味;
18、在空气中燃烧:S——微弱的淡蓝色火焰 H2——淡蓝色火焰 H2S——淡蓝色火焰
CO——蓝色火焰 CH4——明亮并呈蓝色的火焰 S在O2中燃烧——明亮的蓝紫色火焰。
19.特征反应现象: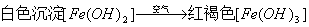
20.浅黄色固体:S或Na2O2或AgBr
21.使品红溶液褪色的气体:SO2(加热后又恢复红色)、Cl2(加热后不恢复红色)
22.有色溶液:Fe2+(浅绿色)、Fe3+(黄色)、Cu2+(蓝色)、MnO4-(紫色)
有色固体:红色(Cu、Cu2O、Fe2O3)、红褐色[Fe(OH)3] 黑色(CuO、FeO、FeS、CuS、Ag2S、PbS)
蓝色[Cu(OH)2] 黄色(AgI、Ag3PO4) 白色[Fe(0H)2、CaCO3、BaSO4、AgCl、BaSO3]
有色气体:Cl2(黄绿色)、NO2(红棕色)
二十二、几个很有必要熟记的相等式量



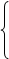
 Ne CaCO3 Fe CuO Ar
Ne CaCO3 Fe CuO Ar
20 100 KHCO3 56 CaO 80 SO3 40 Ca
HF Mg3N2 KOH Br、NH4NO3 MgO
NaOH





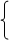 N2 H2SO4 C3H8 SO2 CuSO4 CH3COOH
N2 H2SO4 C3H8 SO2 CuSO4 CH3COOH
28 C2H4 98 44 CO2 64 160 Fe2O3 60 CH3CH2CH2OH
CO H3PO4 N2O Cu Br2 HCOOCH3
1.常用相对分子质量
Na2O2:78 Na2CO3:106 NaHCO3:84 Na2SO4:142
BaSO4:233 Al (OH)3:78 C6H12O6:180
2.常用换算
5.6L——0.25 mol 2.8L——0.125 mol 15.68L——0.7 mol
20.16L——0.9 mol 16.8L——0.75 mol
十二.主要实验操作和实验现象的具体实验80例
1.镁条在空气中燃烧:发出耀眼强光,放出大量的热,生成白烟同时生成一种白色物质。
2.木炭在氧气中燃烧:发出白光,放出热量。
3.硫在氧气中燃烧:发出明亮的蓝紫色火焰,放出热量,生成一种有刺激性气味的气体。
4.铁丝在氧气中燃烧:剧烈燃烧,火星四射,放出热量,生成黑色固体物质。
5.加热试管中碳酸氢铵:有刺激性气味气体生成,试管上有液滴生成。
6.氢气在空气中燃烧:火焰呈现淡蓝色。 7.氢气在氯气中燃烧:发出苍白色火焰,产生大量的热。
8.在试管中用氢气还原氧化铜:黑色氧化铜变为红色物质,试管口有液滴生成。
9.用木炭粉还原氧化铜粉末,使生成气体通入澄清石灰水,黑色氧化铜变为有光泽的金属颗粒,石灰水变浑浊。
10.一氧化碳在空气中燃烧:发出蓝色的火焰,放出热量。
11. 向盛有少量碳酸钾固体的试管中滴加盐酸:有气体生成。
12.加热试管中的硫酸铜晶体:蓝色晶体逐渐变为白色粉末,且试管口有液滴生成。
13.钠在氯气中燃烧:剧烈燃烧,生成白色固体。
14.点燃纯净的氯气,用干冷烧杯罩在火焰上:发出淡蓝色火焰,烧杯内壁有液滴生成。
15.向含有C1-的溶液中滴加用硝酸酸化的硝酸银溶液,有白色沉淀生成。
16.向含有SO42-的溶液中滴加用硝酸酸化的氯化钡溶液,有白色沉淀生成。
17.一带锈铁钉投入盛稀硫酸的试管中并加热:铁锈逐渐溶解,溶液呈浅黄色,并有气体生成。
18.在硫酸铜溶液中滴加氢氧化钠溶液:有蓝色絮状沉淀生成。
19.将Cl2通入无色KI溶液中,溶液中有褐色的物质产生。
20.在三氯化铁溶液中滴加氢氧化钠溶液:有红褐色沉淀生成。
21.盛有生石灰的试管里加少量水:反应剧烈,发出大量热。
22.将一洁净铁钉浸入硫酸铜溶液中:铁钉表面有红色物质附着,溶液颜色逐渐变浅。
23.将铜片插入硝酸汞溶液中:铜片表面有银白色物质附着。
24.向盛有石灰水的试管里,注入浓的碳酸钠溶液:有白色沉淀生成。
25.细铜丝在氯气中燃烧后加入水:有棕色的烟生成,加水后生成绿色的溶液。
26.强光照射氢气、氯气的混合气体:迅速反应发生爆炸。
27. 红磷在氯气中燃烧:有白色烟雾生成。 28.氯气遇到湿的有色布条:有色布条的颜色退去。
29.加热浓盐酸与二氧化锰的混合物:有黄绿色刺激性气味气体生成。
30.给氯化钠(固)与硫酸(浓)的混合物加热:有雾生成且有刺激性的气味生成。
31. 在溴化钠溶液中滴加硝酸银溶液后再加稀硝酸:有浅黄色沉淀生成。
32.在碘化钾溶液中滴加硝酸银溶液后再加稀硝酸:有黄色沉淀生成。
33.I2遇淀粉,生成蓝色溶液。 34.细铜丝在硫蒸气中燃烧:细铜丝发红后生成黑色物质。
35.铁粉与硫粉混合后加热到红热:反应继续进行,放出大量热,生成黑色物质。
36.硫化氢气体不完全燃烧(在火焰上罩上蒸发皿):火焰呈淡蓝色(蒸发皿底部有黄色的粉末)。
37.硫化氢气体完全燃烧(在火焰上罩上干冷烧杯):火焰呈淡蓝色,生成有刺激性气味的气体(烧杯内壁有液滴生成)。
38.在集气瓶中混合硫化氢和二氧化硫:瓶内壁有黄色粉末生成。
39.二氧化硫气体通入品红溶液后再加热:红色退去,加热后又恢复原来颜色。
40.过量的铜投入盛有浓硫酸的试管,并加热,反应毕,待溶液冷却后加水:有刺激性气味的气体生成,加水后溶液呈天蓝色。
41.加热盛有浓硫酸和木炭的试管:有气体生成,且气体有刺激性的气味。
42.钠在空气中燃烧:火焰呈黄色,生成淡黄色物质。
43.钠投入水中:反应激烈,钠浮于水面,放出大量的热使钠溶成小球在水面上游动,有“嗤嗤”声。
44.把水滴入盛有过氧化钠固体的试管里,将带火星木条伸入试管口:木条复燃。
45. 加热碳酸氢钠固体,使生成气体通入澄清石灰水:澄清石灰水变浑浊。
46.氨气与氯化氢相遇:有大量的白烟产生。
47. 加热氯化铵与氢氧化钙的混合物:有刺激性气味的气体产生。
48. 加热盛有固体氯化铵的试管:在试管口有白色晶体产生。
49.无色试剂瓶内的浓硝酸受到阳光照射:瓶中空间部分显棕色,硝酸呈黄色。
50.铜片与浓硝酸反应:反应激烈,有红棕色气体产生。
51.铜片与稀硝酸反应:试管下端产生无色气体,气体上升逐渐变成红棕色。
52. 在硅酸钠溶液中加入稀盐酸,有白色胶状沉淀产生。
53.在氢氧化铁胶体中加硫酸镁溶液:胶体变浑浊。 54.加热氢氧化铁胶体:胶体变浑浊。
55.将点燃的镁条伸入盛有二氧化碳的集气瓶中:剧烈燃烧,有黑色物质附着于集气瓶内壁。
56.向硫酸铝溶液中滴加氨水:生成蓬松的白色絮状物质。
57.向硫酸亚铁溶液中滴加氢氧化钠溶液:有白色絮状沉淀生成,立即转变为灰绿色,一会儿又转变为红褐色沉淀。
58. 向含Fe3+的溶液中滴入KSCN溶液:溶液呈血红色。
59.向硫化钠水溶液中滴加氯水:溶液变浑浊。S2-+Cl2=2Cl2-+S↓
60.向天然水中加入少量肥皂液:泡沫逐渐减少,且有沉淀产生。
61.在空气中点燃甲烷,并在火焰上放干冷烧杯:火焰呈淡蓝色,烧杯内壁有液滴产生。
62.光照甲烷与氯气的混合气体:黄绿色逐渐变浅,时间较长,(容器内壁有液滴生成)。
63. 加热(170℃)乙醇与浓硫酸的混合物,并使产生的气体通入溴水,通入酸性高锰酸钾溶液:有气体产 生,溴水褪色,紫色逐渐变浅。
64.在空气中点燃乙烯:火焰明亮,有黑烟产生,放出热量。
65.在空气中点燃乙炔:火焰明亮,有浓烟产生,放出热量。
66.苯在空气中燃烧:火焰明亮,并带有黑烟。 67.乙醇在空气中燃烧:火焰呈现淡蓝色。
68.将乙炔通入溴水:溴水褪去颜色。 69.将乙炔通入酸性高锰酸钾溶液:紫色逐渐变浅,直至褪去。
70. 苯与溴在有铁粉做催化剂的条件下反应:有白雾产生,生成物油状且带有褐色。
71.将少量甲苯倒入适量的高锰酸钾溶液中,振荡:紫色褪色。
72.将金属钠投入到盛有乙醇的试管中:有气体放出。
73.在盛有少量苯酚的试管中滴入过量的浓溴水:有白色沉淀生成。
74.在盛有苯酚的试管中滴入几滴三氯化铁溶液,振荡:溶液显紫色。
75.乙醛与银氨溶液在试管中反应:洁净的试管内壁附着一层光亮如镜的物质。
76.在加热至沸腾的情况下乙醛与新制的氢氧化铜反应:有红色沉淀生成。
77.在适宜条件下乙醇和乙酸反应:有透明的带香味的油状液体生成。
78.蛋白质遇到浓HNO3溶液:变成黄色。 79.紫色的石蕊试液遇碱:变成蓝色。
80.无色酚酞试液遇碱:变成红色。
1. 原子核不一定都是由质子和中子构成的。如氢的同位素(11H)中只有一个质子。
2. 酸性氧化物不一定都是非金属氧化物。如Mn2O7是HMnO4的酸酐,是金属氧化物。
3. 非金属氧化物不一定都是酸性氧化物。如CO、NO等都不能与碱反应,是不成盐氧化物。
4.金属氧化物不一定都是碱性氧化物。如Mn2O7是酸性氧化物,Al2O3是两性氧化物。
5.电离出的阳离子都是氢离子的不一定是酸。如苯酚电离出的阳离子都是氢离子,属酚类,不属于酸。
6.由同种元素组成的物质不一定是单质。如金刚石与石墨均由碳元素组成,二者混合所得的物质是混合物;由同种元素组成的纯净物是单质。
7.晶体中含有阳离子不一定含有阴离子。如金属晶体中含有金属阳离子和自由电子,而无阴离子。
8.有单质参加或生成的化学反应不一定是氧化还原反应。如金刚石→石墨,同素异形体间的转化因反应前后均为单质,元素的化合价没有变化,是非氧化还原反应。
9. 离子化合物中不一定含有金属离子。如NH4Cl属于离子化合物,其中不含金属离子。
10.与水反应生成酸的氧化物不一定是酸酐,与水反应生成碱的氧化物不一定是碱性氧化物。如NO2能与水反应生成酸—硝酸,但不是硝酸的酸酐,硝酸的酸酐是N2O5,Na2O2能与水反应生成碱—NaOH,但它不属于碱性氧化物,是过氧化物。
11.pH=7的溶液不一定是中性溶液。只有在常温时水的离子积是1×10-14 ,此时pH=7的溶液才是中性。
12.用pH试纸测溶液的pH时,试纸用蒸馏水湿润,测得溶液的pH不一定有误差。
13.分子晶体中不一定含有共价键。如稀有气体在固态时均为分子晶体,不含共价键。
14.能使品红溶液褪色的气体不一定是SO2,如Cl2、O3均能使品红溶液褪色。
15.金属阳离子被还原不一定得到金属单质。如Fe3+可被还原为Fe2+。
16.某元素由化合态变为游离态时,该元素不一定被还原。如2H2O=2H2↑+O2↑,氢元素被还原而氧元素被氧化。
17.强氧化物与强还原剂不一定能发生氧化还原反应。如浓硫酸是常见的强氧化剂,氢气是常见的还原剂,但可用浓硫酸干燥氢气,因二者不发生反应。
18.放热反应在常温下不一定很容易发生,吸热反应在常温下不一定不能发生。如碳与氧气的反应为放热反应,但须点燃;Ba(OH)2·8H2O与NH4Cl反应为吸热反应,但在常温下很容易发生。
19.含金属元素的离子不一定都是阳离子。如AlO2-。
20. 最外层电子数大于4的元素不一定是非金属元素。如周期表中ⅣA、ⅤA、ⅥA中的金属元素最外层电子数均多于4个。
21.不能在强酸性溶液中大量存在的离子,不一定能在强碱性溶液中大量存在。如HCO3-、HS- 等离子既不能在强酸性溶液中大量存在,也不能在强碱性溶液中大量存在。
22.组成和结构相似的物质,相对分子质量越大,熔沸点不一定越高。一般情况下该结论是正确的,但因H2O、HF、NH3等分子间能形成氢键,熔沸点均比同主族元素的氢化物高。
23.只由非金属元素组成的晶体不一定属于分子晶体。如NH4Cl属于离子晶体。
24.只含有极性键的分子不一定是极性分子。如CCl4、CO2等都是含有极性键的非极性分子。
25.铁与强氧化性酸反应不一定生成三价铁的化合物。铁与浓硫酸、硝酸等反应,若铁过量则生成亚铁离子。
26.具有金属光泽并能导电的单质不一定是金属。如石墨、硅都具有金属光泽,它们属于非金属单质。
27.失去电子难的原子获得电子的能力不一定强。如稀有气体原子既不易失去电子也不易得到电子。
28.浓溶液不一定是饱和溶液,饱和溶液不一定是浓溶液。如KNO3的浓溶液不一定是饱和溶液,因KNO3的溶解度较大;Ca(OH)2的饱和溶液浓度很小,因Ca(OH)2微溶于水。
29. 强电解溶液的导电能力不一定强。导电性的强弱与溶液中自由离子的浓度大小有关,如果某强电解质溶液的浓度很小,那么它的导电性可以很弱,而某弱电解质虽然电离程度小,但如果离子浓度大时,该溶液的导电能力也可以较强。
30.弱电解质被稀释时,离子浓度不一定减小。如冰醋酸在稀释时,H+、CH3COO-浓度先逐渐增大而后减小。
31.平衡向正反应方向移动,反应物的转化率不一定增大。
32. 1 mol某气体的体积是22.4 L,该气体所处的状态不一定是标准状态。
