 待定系数法
待定系数法
高三化学组
 假设方程式中各物质的化学计量系数,根据质量守恒定律,列出方程求解。
假设方程式中各物质的化学计量系数,根据质量守恒定律,列出方程求解。
1.将适量CO2通入含0.8 g NaOH的碱溶液中,将产物在减压、低温下蒸干后得到1.37 g固体物质。则产物是_______________,通入的CO2的质量是_____g。
2.一定量的H2S气体通入到300 mL、0.4 mol/L的NaOH溶液中被充分吸收,然后在减压、低温条件下蒸发水分,得到5.36 g固体,求固体的组成是及H2S的物质的量。
3.将一定量的碳与8 g氧气置于一密闭容器中,使之在高温下反应,当恢复至原温度时,容器内压强比原来大0.4倍,则参加反应的碳的质量为
A.2.4 g B.3 g C.4.2 g D.6 g
4.120℃时,H2S与O2混合气体全部燃烧后恢复至原状态体积减少30%,则原混合气体中H2S的体积含量为_____46.1%
 配平法
配平法
有些题目用配平法来解题更为直观,简便。这种方法有些与“待定系数法”类似。
1.24 mL H2S和30 mL O2混合,点燃完全反应,则所得产物中的SO2的体积(相同状况)是_____mL。18。
2.红磷在Cl2是燃烧,其物质的量之比为1:1.8时,所得产物中PCl3和PCl5的物质的量之比为
A.3:5 B.5:3 C.3:7 D.7:3
3.一定物质的量的SO2和NaOH溶液反应,所得溶液中含Na2SO3与NaHSO3的物质的量之比为3:5,则SO2和NaOH的物质的量之比是
A.3:5 B.1:2 C.18:8 D.8:11
4.已知反应a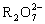 +xM2++14H+¾®bR3++xM3++cH2O,则系数x的值是
+xM2++14H+¾®bR3++xM3++cH2O,则系数x的值是
A.3 B.4 C.5 D.6
规律法
根据知识的内在联系,通过分析、归纳,使微观知识宏观化,零散知识整体化,重点知识条理化,总结出带有规律性的结论或经验公式,并运用这些规律性求解。
1.根据反应式:① 2Fe3++2I-¾®2Fe2++I2;② Br2+2Fe2+¾®2Br-+2Fe3+。可判断离子的还原性从强到弱的顺序是
A.Br-、Fe2+、I- B.I-、Fe2+、Br- C.Br-、I-、Fe2+ D.Fe2+、I-、Br-
2.两个体积相同的容器,一个盛有一氧化氮,另一个盛有氮气和氧气,在同温同压下,两个容器内的气体一定具有相同的
A.原子总数 B.质子总数 C.分子总数 D.质量
3.物质的量浓度相同的三种盐NaX、NaY和NaZ的溶液,其pH值依次为8、9、10,则HX、HY和HZ的酸性由强到弱的顺序是
A.HX、HZ、HY B.HZ、HY、HX C.HX、HY、HZ D.HY、HZ、HX
4.下列各组物质中,按熔点从低到高顺序排列的是
A.氯化钠、硫磺、金刚石 B.汞、碘、二氧化硅
 C.金刚石、氯化钠、干冰 D.干冰、氯化钠、金属钠
C.金刚石、氯化钠、干冰 D.干冰、氯化钠、金属钠


 5.下面是苯和一组稠环芳香烃的结构简式,这组化合物的分子式的通式为________
5.下面是苯和一组稠环芳香烃的结构简式,这组化合物的分子式的通式为________
C4n+2H2n+4
① 苯 ② 萘 ③ 蒽 ④ 并四苯
6.NH4Cl溶于重水中,反应生成的水合氨分子和水合氢离子均正确的是
A.NH3 H2O和D3O+ B.NH3 D2O和HD2O+
C.NH3 HDO和D3O+ D.NH2D H2O和H2DO+
7.在pH值都等于9的NaOH和CH3COONa两种溶液中,设由水电离产生的OH-浓度分别为A和Bz,则A与B的关系为
A.A > B B.A=10-4B C.B=10-4A D.A=B
假设法
假设使得问题符合简单的一般规律,然后通过演绎推理,得出结论的方法。
1.将100 g浓度为18 mol/L(密度为 r g/cm3)的浓硫酸加入一定量的水中,稀释成9 mol/L的硫酸,则水的体积为
A.小于100 mL B.等于100 mL C.大于100 mL D.无法确定
2.31.2 g KOH和KHCO3混合物在密闭容器中加热到250℃,充分反应后排出气体、冷却,测得固体质量减少了3.2 g。若混合物中KOH和KHCO3的物质的量分别为a mol和b mol,则a与b的关系为
A.a=b B.a > b C.a < b D.无法确定
3.容积相同的两个容器A和B,A中盛有SO2和O2各1 g,B中盛有SO2和O2各2 g,在相同温度下反应达到平衡。设A中SO2转化率为a%,B中SO2转化率为b%,则A、B两容器中SO2转化率关系正确的是
A.a=b B.a > b C.a < b D.无法确定
4.某一元弱酸HA的稀溶液与某一元强碱BOH的稀溶液等体积混合后,溶液的pH=7,则HA与BOH的物质的量浓度关系是
A.[HA] > [BOH] B.[HA]=[BOH] C.[HA] > [BOH] D.无法确定
 5.相同体积的甲、乙两个容器中,分别都充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2(g)+O2(g) 2SO3(g),并达平衡,在这过程中,甲容器保持体积不变,乙容器保持压力不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率为
5.相同体积的甲、乙两个容器中,分别都充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2(g)+O2(g) 2SO3(g),并达平衡,在这过程中,甲容器保持体积不变,乙容器保持压力不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率为
A.小于p% B.等于p% C.大于p% D.无法判断
6.将体积都为10 mL,pH都等于3的醋酸和盐酸,加水稀释a mL和b mL,测得稀释后溶液的pH值均为5,则稀释后溶液的体积为
A.a=b=1 L B.a=l L,b=100 mL C.a > b=1 L D.a < b=1 L
待定系数法巧解
1.nCO2+0.02NaOH®xNa2CO3+yNaHCO3+zH2O;x=0.005 mol,y=0.01 mol。m(CO2)=0.66 g
2.nH2S+0.12NaOH®xNa2S+yNaHS+zH2O,x=0.04 mol,y=0.04 mol,n=0.08 mol。
3.mC+0.25O2®pCO2+qCO,p+q=0.35,m=0.35×12=4.2 g。
4.aH2S+(b+0.5a)O2®bSO2+(a-b)S+aH2O(g),a+b=(1-30%)(a+b+0.5a),a=1.5b;
a/(a+b+0.5a)=46.1%。
配平法巧解
1.24H2S+30O2¾®6S+18SO2+24H2O。
2.P+1.8Cl2¾®0.7PCl3+0.3PCl5。
3.8SO2+11NaOH¾®3Na2SO3+5NaHSO3+3H2O。
4.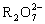 +6M2++14H+¾®2R3++6M3++7H2O。由得失电子守恒可直接得出x=6,更为简便。
+6M2++14H+¾®2R3++6M3++7H2O。由得失电子守恒可直接得出x=6,更为简便。
规律法巧解
1.根据“还原剂的还原性强于还原产物的还原性”的规律,可得到:I- > Fe2+,Fe2+ > Br-。
2.依据四同定律可得:同温同压同体积,则物质的量相同;即分子数(双原子)或原子数相同。
3.根据“在同温同浓度下,弱酸根离子的水解程度越大,溶液的pH值就越大,则酸就越弱”。
4.依据:原子晶体 > 离子晶体 > 分子晶体;同种晶体是键能越大熔点越高。根据常识归纳。
5.分别求出分子式,找出规律即等差数列;其系差为C4H2,根据an=a1+(n-1)C4H2。
6.NH4Cl促进水解:与OD-结合,生成NH3 HDO分子;D+与水结合,生成D3O+。
7.NaOH抑制水的电离,CHCOONa促进水的电离:A < B。
假设法巧解
1.设密度不变,则溶液质量为原来的2倍,体积为100 mL;稀硫酸密度小,体积小于100 mL。
2.设a=b,则减轻3.6 g,而题目是3.2 g,显然KOH过量。
3.设B的容积是A的两倍,则a=b;当B的容器加压至体积与A相同时,则转化率增大。
4.设[HA]=[BOH],溶液呈碱性;题目是呈中性,所以[HA] > [BOH]。
5.设容积不变,则a=b;由于是物质的量减小的反应,乙压力大于甲压力,则转化率增大。
6.设均为强酸,则a=b=1 L;由于醋酸是弱酸,稀释后电离度增大,所以a > b。
第二篇:高中化学计算方法总结:十字交叉法
 十字交叉法
十字交叉法
高三化学组
 十字交叉法是进行二组分混合物平均量与组分计算的一种简便方法。凡可按M1n1+M2n2=M(n2+n2)计算的问题,均可按十字交叉法计算。
十字交叉法是进行二组分混合物平均量与组分计算的一种简便方法。凡可按M1n1+M2n2=M(n2+n2)计算的问题,均可按十字交叉法计算。

 式中,M表示混合物的某平均量,M1、M2则表示两组分对应的量。如M表示平均相对分子质量,M1、M2则表示两组分各自的相对分子质量,n1、n2表示两组分在混合物中所占的份额,n1:n2在大多数情况下表示两组分的物质的量之比,有时也可以是两组分的质量之比,判断时关键看n1、n2表示混合物中什么物理量的份额,如物质的量、物质的量分数、体积分数,则n1:n2表示两组分的物质的量之比;如质量、质量分数、元素质量百分含量,则n1:n2表示两组分的质量之比。十字交叉法常用于求算:
式中,M表示混合物的某平均量,M1、M2则表示两组分对应的量。如M表示平均相对分子质量,M1、M2则表示两组分各自的相对分子质量,n1、n2表示两组分在混合物中所占的份额,n1:n2在大多数情况下表示两组分的物质的量之比,有时也可以是两组分的质量之比,判断时关键看n1、n2表示混合物中什么物理量的份额,如物质的量、物质的量分数、体积分数,则n1:n2表示两组分的物质的量之比;如质量、质量分数、元素质量百分含量,则n1:n2表示两组分的质量之比。十字交叉法常用于求算:
(1)有关质量分数的计算;
(2)有关平均相对分子质量的计算; 十字交叉法计算的式子如下:


 (3)有关平均相对原子质量的计算; n1:M1 M2-M
(3)有关平均相对原子质量的计算; n1:M1 M2-M


 (4)有关平均分子式的计算; M
(4)有关平均分子式的计算; M
 (5)有关反应热的计算; n2:M2 M-M1
(5)有关反应热的计算; n2:M2 M-M1

 (6)有关混合物反应的计算。 n1/n2=(M2-M)/(M-M1)
(6)有关混合物反应的计算。 n1/n2=(M2-M)/(M-M1)
一.有关质量分数的计算
1.实验室用密度为1.84 g/cm3 98%的浓硫酸与密度为1.1 g/cm3 15%的稀硫酸混合配制密度为1.4 g/cm3 59%的硫酸溶液,取浓、稀硫酸的体积比最接近的值是
A.1:2 B.2:1 C.3:2 D.2:3
2.在苯和苯酚组成的混合物中,碳元素的质量分数为90%,则该混合物中氧元素的质量分数是
A.2.5% B.5% C.6.5% D.7.5%
二.有关平均相对分子质量的计算
3.标准状况下,在容积为1 L的干燥烧瓶中用向下排空气法充入NH3后,测得烧瓶中的气体对H2的相对密度为9.7,若将此气体进行喷泉实验,当喷泉停止后所得溶液体积为_____L。4/5 L。
4.Li2CO3和BaCO3的混合物与盐酸反应所消耗盐酸的量同等质量的CaCO3和同浓度的盐酸反应所消耗盐酸的量相等,则混合物中Li2CO3和BaCO3的质量之比为
A.3:5 B.5:3 C.7:5 D.5:7
三.有关平均相等原子质量的计算
5.晶体硼由10B和11B两种同位素构成,已知5.4 g晶体硼与H2反应全部转化为乙硼烷(B2H6)气体,可得标准状况下5.6 L,则晶体硼中10B和11B两种同位素原子个数比为
A.1:1 B.1:3 C.1:4 D.1:2
6.已知Cl的平均相对原子质量为35.5。则由23Na和35Cl、37Cl微粒组成的NaCl晶体29.25 g中含37Cl的质量是_____g。4.625 g。
四.有关平均分子式的计算
7.在1.01×105 Pa和120℃下,1 L A、B两种烷烃组成的混合气体在足量的O2充分燃烧后得到同温同压下2.5 L CO2和3.5 L H2O,且A分子中比B分子中少2个碳原子,试确定A和B的分子式和体积比(A、B两种烷烃在常温下为气态)。1:3,3:1。
8.常温下,一种烷烃A和一种单烯烃B组成混合气体,A或B分子最多只含4个碳原子,且B分子的碳原子数比A分子多。
(1)将1 L该混合气体充分燃烧,在同温同压下得到2.5 L CO2气体。试推断原混合气体中A和B所有可能的组合及其体积比。1:3,1:1,1:1,3:1。
(2)120℃时取1 L该混合气体跟9 L氧气混合,充分燃烧后,当恢复到120℃和燃烧前的压强时,体积增大6.25%,试通过计算确定A和B的分子式。C2H6和C4H8。
五.有关反应热的计算
9.已知下列两个热化学方程式:2H2(g)+O2(g)¾®2H2O(l)+571.6 kJ/mol,C3H8(g)+5O2(g)¾®3CO2(g)+4H2O(l)+2220 kJ/mol,实验测得氢气和丙烷的混合气体共5 mol,完全燃烧时放热3847 kJ,则混合气体中氢气和丙烷的体积之比是
A.1:3 B.3:1 C.1:4 D.1:1
六.有关混合物反应的计算
10.把NaCl和NaBr的混合物0.5 g溶于水后加入足量的AgNO3溶液,把所得沉淀过滤、洗涤、干燥,最后得到卤化银1.10 g,则原混合物中NaCl的质量分数是_____%。60
11.已知白磷和氧气可发生如下反应:P4+3O2¾®P4O6,P4+5O2¾®P4O10。在某一密闭容器中加入62 g白磷和50.4 L氧气(标况),使之恰好完全反应,所得到的P4O10与P4O6的物质的量之比为
A.1:3 B.3:1 C.3:2 D.1:1
七.巧练
12.把100 g Na2CO3与NaHCO3的混合物跟足量的HCl作用,放出22.4 L(标况)CO2,则原混合物中Na2CO3的质量分数是_____%。77.1%。
13.电解水和重水的混合物18.5 g,放出气体33.6 L(标况),所生成的气体中D和H原子数之比是_____。1:3。
14.乙烯和乙炔混合气体共x mL,使其在空气中燃烧,共用去O2 y mL(相同条件下),则混合气体中乙烯与乙炔的体积比是
A.(2x-y)/(3x-y) B.(2x-y)/(y-x) C.(2y-5x)/(6x-2y) D.(y-2x)/(x-2y)
15.某烯烃和烷烃组成的混合气体对H2的相对密度为12,则该混合气体中烯烃的体积百分含量x与烯烃分子碳原子数n的关系是
A.n=4(1+2x)/7x B.n=4(1-2x)/7x C.x=4/(7n-8) D.无法确定
十字交叉法巧解
一.有关质量分数的计算
1.设取用98%的浓硫酸X g,取用15%的稀硫酸Y g。
根据溶质质量守恒可得:98%X+15%Y=59%(X+Y),X和Y之比是溶液质量之比。
由十字交叉法可得:X/Y=44/39;再换算成体积比为:44/1.84:39/1.1=2/3。
2.M(C6H6)=78,其中碳质量分数为:C%=72/78=92.3%;
M(C6H6O)=94,其中碳的质量分数为:C%=72/94=76.6%。
依据碳元素质量守恒和十字交叉法可得混合物中苯酚的质量分数,再进一步求出氧的质量分数。
m(C6H6O)/m(C6H6)=2.3/13.4;O%=(2.3×16/92)/(2.3+13.4)=2.5%。(O%=1-90%×13/12)
二.有关平均相对分子质量的计算
3.M=2×9.7=19.4 > 17,说明混有空气;
根据质量守恒和十字交叉法可得:n(NH3)/n(空气)=9.6/2.4=4/1;
所以烧瓶内含NH3体积为4/5 L;空气不溶于水,当喷泉停止后,则烧瓶内的溶液为4/5 L。
4.74x+197y=100(x+y),由十字交叉法可得:x/y=97/26;
所以质量比为:m(Li2CO3)/m(BaCO3)=(97×74)/(26×197)=7/5。
三.有关平均相对原子质量的计算
5.n(B2H6)=5.6/22.4=0.25 mol,n(B)=0.25×2=0.5 mol;
M(B)=5.4/0.5=10.8 g/mol,n(10B)/n(11B)=0.2/0.8=1/4。
6.n(NaCl)=29.25/58.5=0.5 mol,n(37Cl)/n(35Cl)=0.5/1.5=1/3;
m(37Cl)=0.5×1/4×37=4.625 g。
四.有关平均分子式的计算
7.由C和H的原子守恒以及十字交叉法可得平均分子式为M=C2.5H7;
V(CH4)/V(C3H8)=1/3,V(C2H6)/V(C4H10)=3/1。
8.(1)由C原子守恒和十字交叉法可得平均分子式为M=C2.5Hy;依据题意有如下结果:
V(CH4)/V(C3H6)=1/3,V(CH4)/V(C4H8)=1/1,V(C2H6)/V(C3H6)=1/1,V(C2H6)/V(C4H8)=3/1。
(2)y=6.5,得平均分子式为M=C2.5H6.5;依据题意有如下结果:A是C2H6,B是C4H8。
五.有关反应热的计算
9.已知:Q氢气=571.6/2=285.8 kJ/mol,Q混合=3847/5=769.4 kJ/mol,Q丙烷=2220 kJ/mol;
由十字交叉法可得:V氢气/V丙烷=Q氢气/Q丙烷=1450.6/483.6=3/1。
六.有关混合物反应的计算
10.若皆为NaCl可得沉淀1.227 g,若皆为NaBr可得沉淀0.913 g;
由十字交叉法可得:mNaCl/mNaBr=0.187/0.127,故NaCl%=0.187/(0.187+0.127)=60%。
11.生成1 mol P4O10耗氧5 mol,生成1 mol P4O6耗氧3 mol,n(O2)=50.4/22.4=2.25 mol;
5x+3y=4.5(x+y),由十字交叉法可得:x/y=1.5/0.5=3/1。
七.巧练
12.n(CO2)=22.4/22.4=1 mol,由十字交叉法可得:n(Na2CO3)/n(NaHCO3)=16/6=8/3;
Na2CO3%=8×106/(8×106+3×84)=77.1%。
13.M=18.5,由十字交叉法可得:n(H2O)/n(D2O)=1.5/0.5=3/1,则n(D)/n(H)=3/1。
14.混合气体每mL耗O2 y/x mL,乙烯每mL耗O2 3 mL,乙炔每mL耗O2 2.5 mL;
由十字交叉法可得:n(C2H4)/n(C2H2)=V(C2H4)/V(C2H2)=(y/x-2.5)/(3-y/x)=(2y-5x)/(6x-2y).
15.M=24,则必有CH4,由十字交叉法可得:n(CH4)/n(C2nH2n)=(14n-24)/8;
x=8/(14n-24+8)=4/(7n-8),则n=(4/x+8)/7=4(1+2x)/7x。
第三篇:高中数学方法总结
数学学习方法
高中学生学数学靠的也是一个字:悟!
1.先看笔记后做作业。每天在做作业之前,一定要把课本的有关内容和当天的课堂笔记先看一看。能否坚持如此,常常是好学生与差学生的最大区别。尤其练习题不太配套时,作业中往往没有老师刚刚讲过的题目类型,因此不能对比消化。如果自己又不注意对此落实,天长日久,就会造成极大损失。
2.做题之后加强反思。学生一定要明确,现在正做着的题,一定不是考试的题目。而是要运用现在正做着的题目的解题思路与方法。因此,要把自己做过的每道题加以反思,总结一下自己的收获。要总结出:这是一道什么内容的题,用的是什么方法。做到知识成片,问题成串。日久天长,构建起一个内容与方法的科学的网络系统。俗话说:“有钱难买回头看”。我们认为,做完作业,回头细看,价值极大。这个回头看,是学习过程中很重要的一个环节。要看看自己做对了没有;还有什么别的解法;题目处于知识体系中的什么位置;解法的本质什么;题目中的已知与所求能否互换,能否进行适当增删改进。
3.主动复习总结提高。进行章节总结是非常重要的。初中时是教师替学生做总结,做得细致,深刻,完整。高中是自己给自己做总结,老师不但不给做,而且是讲到哪,考到哪,不留复习时间,也没有明确指出做总结的时间。我们进行章节总结的过程也是大体如此。1,要把课本,笔记,区单元测验试卷,校周末测验试卷,都从头到尾阅读一遍。要一边读,一边做标记,标明哪些是过一会儿要摘录的。要养成一个习惯,在读材料时随时做标记,告诉自己下次再读这份材料时的阅读重点。长期保持这个习惯,学生就能由博反约,把厚书读成薄书。积累起自己的独特的,也就是最适合自己进行复习的材料。这样积累起来的资料才有活力,才能用的上。2,把本章节的内容一分为二,一部分是基础知识,一部分是典型问题。要把对技能的要求(对“锯,斧,凿子?”的使用总结),列进这两部分中的一部分,不要遗漏。3,在基础知识的疏理中,要罗列出所学的所有定义,定理,法则,公式。要做到三会两用。即:会文字表述,会图象符号表述,会推导证明。同时能从正反两方面对其进行应用。4,把重要的,典型的各种问题进行编队。(怎样做“板凳,椅子,书架?”)要尽量地把他们分类,找出它们之间的位置关系,总结出问题间的来龙去脉。就象我们欣赏一场团体操表演,我们不能只盯住一个人看,看他从哪跑到哪,都做了些什么动作。我们一定要居高临下地看,看全场的结构和变化。不然的话,陷入题海,徒劳无益。这一点,是提高高中数学水平的关键所在。5,总结那些尚未归类的问题,作为备注进行补充说明。6,找一份适当的测验试卷,例如北京四中的本章节测试试卷,电脑网校的本节试卷,我校去年此时所用的试卷。一定要计时测验。然后再对照答案,查漏补缺。
4.积累资料随时整理。要注意积累复习资料。把课堂笔记,练习,区单元测验,各种试卷,都分门别类按时间顺序整理好。每读一次,就在上面标记出自己下次阅读时的重点内容。这样,复习资料才能越读越精,一目了然。
6.精挑慎选课外读物。
7.配合老师主动学习。高一新生的学习主动性太差是一个普遍存在的问题。小学生,常常是完成了作业就可以尽情地欢乐。初中生基本上也是如此,听话的孩子就能学习好。高中则不然,作业虽多,但是只知做作业就绝对不够;老师的话也不少,但是谁该干些什么了,老师并不一一具体指明。因此,高中新生必须提高自己学习的主动性。准备向将来的大学生的学习方法过渡。
8.合理规划步步为营。高中的学习是非常紧张的。每个学生都要投入自己的几乎全部的精力。要想能迅速进步,就要给自己制定一个较长远的切实可行的学习目标和计划,例如第一学期的期末,自己计划达到班级的平均分数,第一学年,达到年级的前三分之一,如此等等。此外,还要给自己制定学习计划,详细地安排好自己的零星时间,并及时作出合理的微量调整。
