第一章 绪论
1、定义:分析化学是发展和应用各种理论、方法、仪器和策略以获取有关物质在相对时空内的组成和性质的一门学科,又称为分析科学
2、分析化学的分类
⑴定性分析、定量分析和结构分析
定性分析的任务是鉴定物质有哪些元素、原子团或化合物所组成;定量分析的任务是测定物质中有关成分的含量;结构分析的任务是研究物质的分子结构、晶体结构或综合形态。
⑵化学分析和仪器分析
以物质的化学反应及其剂量关系为基础的分析方法称为化学分析法。化学分析法是分析化学的基础,又称经典分析法,主要有重量分析(称重分析)法和滴定分析(容量分析)法等。主要用于高含量和中含量组分(又称常量组分,即待测组分的质量分数在1%以上)的测定。重量分析法的准确度很高,但操作繁琐,分析速度较慢。滴定分析法操作简便,条件易于控制,省时快速且测定结果准确度高(相对误差约为?0.2%)。
以物质的物理性质和物理化学性质为基础的分析方法称为物理分析法和物理化学分析法。这类方法是通过测定物质的物理或物理化学参数来进行的,需要较特殊的一起,通常称为仪器分析。
化学分析和仪器分析互为补充且前者是后者的基础之一。
⑶有机分析和无机分析
有机分析的对象是有机物质,无机分析的对象是无机物质。
3 ⑴待测组分的化学表示形式 分析结果通常以待测组分的实际存在的含量表示,若待测组分的实际存在形式不清楚,分析结果最好以氧化物或元素形式的含量表示,电解质溶液的分析结果常以所存在离子的含量表示。
⑵待测组分含量表示方法
① 固体试样
固体试样的待测组分含量通常以质量分数表示。即以待测组分的质量相当于试样总质量的百分率。若待测组分含量非常低,可采用?g?g,ng?g,pg?g来表示。 ② 液体试样
液体试样中待测组分的含量常以以下方式表示 ?1?1?1
a、物质的量浓度 表示待测组分的物质的量除以试液的体积,常用单位mol?L
b、质量摩尔浓度 表示待测组分的物质的量除以溶剂的质量,常用单位mol?Kg?1 c、质量分数 表示待测组分的质量除以试液的质量,量纲为1
d、体积分数 表示待测组分的体积除以试液的体积,量纲为1
e、摩尔分数 表示待测组分的物质的量除以试液的物质的量,量纲为1
f、质量浓度 表示待测组分的质量除以试液的体积,以
?1mg?L?1,?g?L?1,?g?mL,ng?mL?1,pg?mL?1等表示 ?1
③气体试样中的常量或微量组分的含量常一体机分数或质量浓度表示。
4、滴定分析概述
⑴滴定分析法又称容量分析法,是将一种已知准确浓度的试剂即标准溶液滴加到被测物
质的溶液中,或是将北侧物质的溶液滴加到标准溶液中,直到所加的试剂与被测物质按化学计量关系定量反应完为止。然后根据试剂溶液的浓度和用量,计算被测物质的含量。 通常将已知准确浓度的试剂溶液称为“标准溶液”,把滴定剂从滴定管滴加到被测物质溶液中的过程叫“滴定”,加入的标准物质与被测物质定量反应完全时,反应即达到了“化学计量点”(简称计量点,以sp表示),一般依据指示剂变色来确定化学计量点,在滴定中指示剂颜色改变的那一点称为“滴定终点”(简称终点,以ep表示)。化学计量点与滴定终点不一定恰好吻合,由此造成的分析误差称为“终点误差”,以Et 表示。
⑵滴定分析对化学反应的要求
① 反应具有确定的化学计量关系,即反应按一定的反应方程式进行
② 反应必须定量的进行
③ 反应必须具有较快的速率。对于反应速率较慢的反应,有时可加热或加入催化剂来
加速反应的进行。
④ 必须有适当简便的方法确定滴定终点。
⑶滴定方式
① 直接滴定法 凡是能满足上述要求的反应,都可以用直接滴定法即用标准溶液直接
滴定待测物质。直接滴定法是滴定分析中最常用和最基本的方法。
② 返滴定法 当试液中的待测物质与滴定剂反应很慢(如Al3?与EDTA反应),或者用
滴定剂直接滴定固体试样(如用HCl溶液滴定固体CaCO3)时,反应不能立即完成,
故不能用直接滴定法进行滴定。此时可先准确的加入过量的标准溶液,使之与试剂
中的待测物质或固体试样进行反应,待反应完成后,在用另一种标准溶液滴定剩余
的标准溶液,这种方法称为返滴定法。有时采用返滴定是因为某些反应没有合适的
指示剂(如用AgNO3滴定Cl)。
③ 置换滴定法 当待测组分所参与的反应不按一定的反应式进行或伴有副反应时,不
能采用直接滴定法。可先采用适当的试剂与待测组分反应,使其定量的转化为另一
种物质,再用标准溶液滴定这种物质,这种方法称为置换滴定法(如Na2S2O3滴定
氧化剂的反应)。 ?
④ 间接滴定法 不能与滴定剂直接起反应的物质,有时可以通过另外的化学反应,以
滴定法间接进行滴定。
5、基准物质 滴定分析中离不开标准溶液。能用于直接配置标准溶液或标定溶液准确浓度的物质称为基准物质。
基准物质应符合下列要求:
⑴试剂的组成与化学式完全相符,若含结晶水,其结晶水的含量应与化学式相符; ⑵试剂的纯度足够高(质量分数在99.9%以上);
⑶性质稳定,不易与空气中的O2及CO2反应,也不易吸收空气中的水分; ⑷试剂参加反应时应按反应式定量进行,没有副反应;
⑸摩尔质量足够大。
6、标准溶液的配制
⑴直接法 准确称取一定量的基准物质,溶解后配成一定体积的溶液,根据物质质量和溶液体积,即可计算出该标准溶液的准确浓度。
⑵标定法 有很多物质不能直接用来配制标准溶液,但可将其先配制成一种近似于所需浓度的溶液,然后用基准物质(或已经用基准物质标定过放入标准溶液)来标定它的准确浓度。
7、滴定度是指每毫升标准溶液相当于被测物质的质量。
第二篇:分析化学知识点总结
第二章
第三章
第四章:
准确度:指测量值与真实值接近的程度。精确度:指各平行测量值之间相互接近的程度。
系统误差:由某种确定原因造成的误差,可用进行比较、校准仪器、对照试验、空白试验、以及回收试验等方法进行校正。
偶然误差:也叫随机误差,是由偶然因素引起的误差。可用增加平行试验次数进行处理。
有效数字:是指在分析工作中实际上能测量到的数字,通常包括全部准确值和最后一位欠准确的值。
相对平均偏差: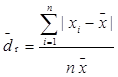 相对标准偏差:
相对标准偏差: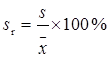
有效数字的计算:四舍六入五留双,例如:0.0250精确到一位有效数字0.02,0.0150则为0.02。
第五章;
化学计量点:当加入的滴定剂的量与被测物质的量之间恰好满足化学反应式所表示的计量关系时,即为化学计量点。
滴定终点:滴定剂刚好变色时便停止滴定,这一点便为滴定终点。
滴定突跃:在化学计量点前后+-0.1%范围内,被测溶液浓度以及相关参数所发生的急剧变化称为滴定突跃。
In+X=XIn,指示剂具有两种明显不同的颜色,在滴定突跃范围内由一种型体变化为另一种型体,溶液颜色发生明显变化。
基准物质:是用以直接配制标准溶液或者标定标准溶液浓度的物质。条件:组成与化学式完全相符、纯度足够高、性质稳定、最好有较大的摩尔质量,以减少称量时的误差、应按滴定反应式定量进行反应,且没有副反应。
滴定度:每毫升标准溶液相当于被测物质的质量。
分布系数:指溶液中某型体的平衡浓度在溶质总浓度中所占的分数。
质子条件式:可用质量平衡和电荷平衡推出。
第六章:
酸碱指示剂:一类有机弱酸或弱碱,它们的共轭酸碱对具有不同结构,呈现不同颜色。HIn=H+In(In为碱式色)
非水滴定:1.酸性溶剂:给出质子能力较强的溶剂,例如冰醋酸,丙酸。滴定弱碱性物质的介质。2.碱性溶剂:接受质子的溶剂,例如乙二胺。3.两性溶剂:既能接受质子又能给出质子的溶剂。滴定不太弱的酸碱。
第七章:
M+Y=MY(M为金属离子,Y为EDTA)
配位剂的副反应:酸效应,共存离子效应。酸效应系数:表示未与M配位的EDTA的各种型体的总浓度是游离EDTA浓度的@倍。
条件稳定常数:形成配合化合物的总浓度比上(未参加主反应的金属离子浓度和配位剂的浓度积)用K'my表示。
第八章:
可逆电对的电极电位:aOx+ne=bRed(氧化型得到电子变成还原型)
自身指示剂:反应物自身带有很深的颜色,生成物无色或很浅。
特殊指示剂:有些物质本身并不具有氧化还原性质,但它能与反应物产生特殊可逆的颜色变化以指示滴定终点,这些物质称为特殊指示剂。
碘量法:基于I2的氧化性或I-的还原性进行氧化还原滴定的方法。
高锰酸钾法:以高锰酸钾为滴定剂的氧化还原滴定法。在强酸中,高锰酸钾是强氧化剂,高锰酸根离子被还原为y二价锰离子。
亚硝酸钠法:以亚硝酸钠为标准溶液,利用亚硝酸钠与有机胺类物质发生重氮化反应或者亚硝基化反应进行的氧化还原滴定法。
第九章:
沉淀滴定法:以沉淀滴定法为基础的一种滴定分析的方法。
沉淀反应的要求:1.沉淀的溶解度必须要小2.沉淀反应必须迅速完成3.有适当方法指示化学计量点。
银量法:利用生成难溶性盐进行测定的方法。例如:卤素离子,CN-,SCN-。
铬酸钾指示法(Mohr法):以铬酸钾为指示剂,用AgNO3标准溶液直接滴定Cl-,由于AgCl的溶解度小于铬酸银,硝酸银先沉淀,只要银离子稍过量铬酸银就会沉淀,变成砖红色。在中性或弱碱性溶液进行,酸度过高,铬酸银沉淀推迟;过低,则Ag+被反应成Ag2O。
铁铵矾指示剂法(Volhard法)是以铁铵矾(NH4Fe(SO4)2.12H2O)为指示剂的银量法。
1.直接滴定法:先生成AgSCN白色,后Fe3+和SCN-显红色。在0.1到1mol的HNO3溶液中,防止Fe3+生成一系列配合物。防止Ag+被吸附,要充分震荡。
2.返滴定法:在含有卤素离子的HNO3溶液中,先加入过量的AgNO3溶液,后用铁铵矾为指示剂,再用NH4SCN标准溶液返滴定过量的AgNO3。
影响沉淀的溶解度:
1.同离子效应:沉淀反应达到平衡后,增加某构晶离子的浓度使沉淀溶解度降低。
2.酸效应:达到平衡后,增加酸度会降低盐沉淀增大溶解度。
3.配位效应:构晶离子生成可溶性配合物使溶解度增大。
4.盐效应:随着溶液中的电解质浓度的增大而增大的现象。
沉淀的污染和提纯:
污染:共沉淀是某些可溶性杂质夹杂在沉淀中从而沉淀下来的现象。后沉淀:某些原来在原溶液不能析出沉淀的组分,也在沉淀表面沉积出来。
沉淀的选择:晶形沉淀的条件:稀,热,慢,搅,陈。不定形沉淀:浓,慢,快,搅,加入电解质溶液,不陈化。
第八章:
1.电极类型:
1.指示电极和参比电极:金属基电极(响应机制基于电子转移)和膜电极(响应机制基于离子交换和扩散)。常用参比电极:饱和甘汞电池和银-氯化银电极,二者均属于金属-金属难溶盐电极。
2.PH玻璃电极:溶液中H+与溶胀水化层中的H+交换作用才产生膜电位。
第九章:
1.光学分析法:根据物质与辐射能之间的相互作用所建立起来的定性、定量和结构分析的方法。
2.光谱:当物质与辐射能相互作用时,物质内部发生能级迁越,记录有能级迁越所产生的辐射能强度,随波长变化所得的图谱。
3.光谱分析法:利用物质光谱进行定性、定量和结构分析的方法。
电磁辐射:电磁波,一种以巨大速度穿过空间而不需要任何媒介的光子流。
电磁波的波粒二象性:波长=光速/频率,波数=1/波长。能量E=hv(h为普朗克系数=6.06262*1
0﹣34次方),1ev=1.6020*10-19次方。
第十章:
透光率:透过样品的光强度与入射光强度之比T=I/Io。
吸光度:A=-lgT
朗伯比尔定律:溶液对光的吸光度与溶液的浓度及厚度的乘积成正比。A=Ecl。
E为吸光系数:物理意义是在一定波长、温度下,单位厚度、单位厚度的吸光度。
摩尔吸光系数:一定波长时,物质的浓度为1mol/L,液层厚度为1cm时的溶液吸光度。
百分数吸光度:一定波长时,物质的浓度为1g/100ml,液层厚度为1cm的溶液吸光度。
溶液吸光度的加和性:溶液同时存在多种无相互作用的吸光物质时,体系吸光度等于各物质的吸光度之和。
偏离比尔定律的因素:化学因素:介质不均匀,溶液发生化学反应、溶液折射率虽浓度变化而变化。光学因素:非单色光、杂散光、散射光、反射光、非平行光等。
第十六章:
色谱分析法:简称“色谱法”,是一种物理或物理化学分离分析方法。色谱法的特点:高灵敏度、高选择性、高效能、分析速度快以及应用范围广等优点。
色谱法的基本条件:具有相对运动的两相,一为固定相,另为流动相,由于不同组分的性质不同,被流动相带动的速度不同,实现分离。
1.保留时间tR:是从进样到某组分在柱后出现浓度极大时的时间间隔,即从进样开始到某个组分的色谱峰顶点的时间间隔。
2.死时间t0:是分配系数为零的组分,即不被固定相吸附或溶解的组分的保留时间。
3.调整保留时间t'R:是某组分由于溶解(或被吸附)于固定相,比不溶解(或不被吸附)的组分在柱中多停留的时间。调整保留时间=保留时间-死时间。
保留体积Vr:是从进样开始到某个组分在柱后出现浓度极大时所需通过的流动相体积。
4.相对保留值:是两组分的调整保留值之比。r2,1=调整时间1/调整保留时间2
色谱峰区域宽度:
1.标准差:0.607倍峰高处的峰宽之半。
2.半峰宽:W1/2=2.335标准差。
3.峰宽:W=4标准差。或1.699W1/2。
4.分离度:是相邻组分色谱峰保留时间之差与两色谱峰峰宽均值之比。R=2(tR2-tR1)/(W1+W2)。
5.分配系数K:是达到分配平衡时,组分在固定相(s)与流动相(m)中的浓度之比。
6.保留因子k:达到分配平衡时,组分在固定相和流动相中质量之比,或者摩尔质量之比。k=t’R/t0.
7.理论塔板高度和理论板数:H=L/n,n=(tR/标准差)的平方或者=16(tR/W)的平方。有效塔板数Heff=L/neff,neff=(t’R/标准差)的平方。
第十七章:
1.气象色谱法:是以气体为流动相的色谱方法,主要用于分离分析易挥发、热稳定性的物质。分为气液色谱和气固色谱两种,前者属于吸附色谱,后者属于分配色谱。
2.特点:分离效能高,选择性高,灵敏度高,应用范围广。
3.气象色谱的组成部分:供气系统、进样系统、色谱柱系统、检测记录系统、控制系统。
4.气象色谱检测器:热导检测器、氢焰离子化检测器、电子捕获检测器、;热离子检测器等。
第十八章:
高效液相色谱:是在经典液相色谱法的基础上,引入了气相色谱法的理论和实验技术,以高压输送流动相,采用高效固定相及高灵敏度检测器,发展而成的现代液相色谱分析方法。简称HPLC。
主要优点:1.应用了颗粒极细、规则均匀的固定相,传质阻抗小,柱效高,分离效率高。2.分析速度快3.灵敏度大
固定相的要求:颗粒均匀、传质快、机械强度高,能耐高压、化学稳定性好,不与流动相发生反应。
流动相的要求:化学稳定性好、对试样有适宜的溶解度、必须与检测器相适应、纯度要高,黏度要低。 .
第十九章:
平面色谱法:是在平面上进行分离的一种色谱法,包括薄层色谱法和纸色谱法。
薄层色谱:1.比移值 Rf:在一定条件下,溶质移动距离和流动相移动的距离之比。2.相对保留值Rr=Rf1/Rf2,即被测组分的比移值比上参考物的比移值。
比移值Rf=1/(1+k),k为保留因子。
