醋酸解离度和解离常数的测定











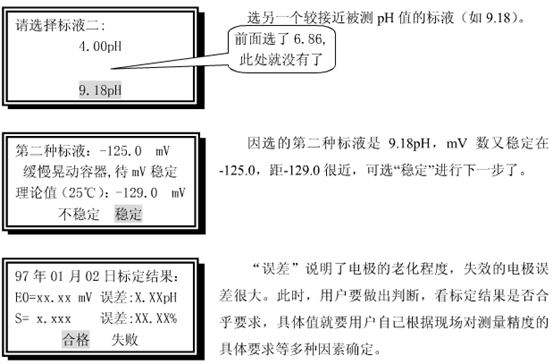


…… …… 余下全文
实验四 醋酸解离常数的测定
(一) pH法
一. 实验目的
1. 学习溶液的配制方法及有关仪器的使用
2. 学习醋酸解离常数的测定方法
3. 学习酸度计的使用方法
二. 实验原理
醋酸(CH3COOH,简写为HAc)是一元弱酸,在水溶液中存在如下解离平衡:
HAc(aq) + H2O(l) D H3O+(aq) + Ac- (aq)
其解离常数的表达式为
[c (H3O+)/cθ][c(Ac-)/ cθ]
Kθa HAc(aq) = —————————————
c(HAc)/ cθ
…… …… 余下全文
醋酸解离常数的测定
一、实验目的
1.了解酸度计测定醋酸解离常数的原理和测定方法。
2.进一步理解并掌握解离平衡的概念。
3.熟悉酸度计的使用方法。
二、实验原理
本实验通过测定不同浓度的醋酸的PH来球算醋酸的标准解离常数。
醋酸在水中存在下列解离平衡:HAc==H++Ac-
在一定的温度下,这个过程很快达到了平衡,平衡常数的表达式为:
K= [H+][Ac-]/[HAc]
式中 [H+]、[Ac-]、[HAc]分别为H+、Ac-、HAc的平衡浓度。
在一定温度下,用酸度计测定一系列已知浓度的醋酸溶液的PH,根据PH=-lg[H+],可换算出相应的C(H+),将C(H+)的不同值代入上式,可求出一系列对应的K(HAc)值,取其平均值,即为该温度下醋酸的解离常数。
三、仪器和药品
仪器:酸度计(其配套的指示电极是玻璃电极),酸式滴定管,小烧杯
药品:醋酸溶液(0.1mol/L)
四、实验步骤
1.配制不同浓度的醋酸溶液
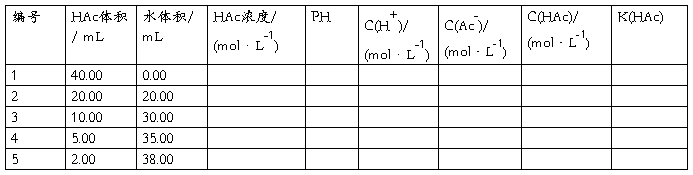
将5只烘干的小烧杯,用滴定管依次加入已知浓度的醋酸溶液40.00mL,20.00mL,10.00mL,5.00mL,和2.00mL,再从另一滴定管中依次加入0.00mL,20.00 mL,30.00 mL,35.00 mL和38.00 mL蒸馏水,并分别搅拌均匀。
2.醋酸溶液PH的测定
3.计算醋酸溶液的(标准)解离常数K(HAc)
根据实验数据计算出各溶液K(HAc),求出平均值。
由实验可知:在一定的温度条件下,醋酸的解离常数为一个定值,与溶液的浓度无关。
五、数据处理
六、思考
实际测得的K与附表中的解离常数存在一定差距,那么怎样减少误差?
…… …… 余下全文
实验名称:醋酸解离和解离常数的测定——pH计的使用
实验日期: 温度: 气压:
一、实验目的
1.测定醋酸的解离度和解离常数
2.掌握滴定原理,滴定操作及正确判断滴定终点
3.学习使用pH计
二、实验原理(详见课本P139)
三、基本操作
1.滴定管的使用,参见第四章二
2.移液管,吸量管的使用,参见第四章二
3.容量瓶的使用,参加第四章二
4.pH计的使用,参见第七章一
四、实验内容
1.醋酸溶液浓度的测定
以酚酞为指示液,用已知浓度的氢氧化钠标准溶液标定HAc溶液的标准浓度,把结果填入下表。

2.配制不同浓度的HAc溶液
用移液管和吸量管分别取25.00ml,5.00ml,2.50ml已测定得准确浓度的HAc溶液,把它们分别加入三个50ml容量瓶中,再用蒸馏水稀释至刻度,摇匀,并计算出这三个容量瓶中HAc溶液的准确浓度。(数据仅供参考)
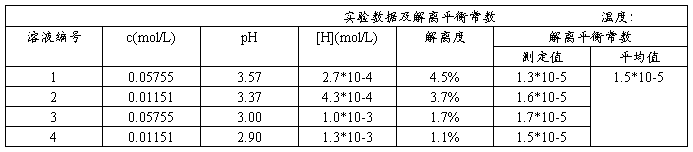
3.测定醋酸溶液的pH,计算醋酸的解离度和解离平衡常数
把以上四种不同浓度的HAc溶液分别加入四只洁净干燥的50ml烧杯中,按稀到浓的次序在pH计上分别测定它们的pH,并将有关数据填入表中:

五、实验习题
1.以氢氧化钠标准装入碱式滴定管中滴定待测HAc溶液,以下情况对滴定结果有何影响?
1) 滴定过程中滴定管下端产生了气泡;偏小
2) 滴定近终点时,没有用用蒸馏水冲洗瓶的内壁;偏大
…… …… 余下全文
电导滴定法测定醋酸的解离常数
实验报告
学校:西安文理学院
系院:
班级:
姓名:
学号:
电导滴定法测定醋酸的解离常数
一、实验目的
1.熟悉电导滴定法的基本原理;
2.掌握电导滴定法测定弱酸解离常数的实验方法。
二、实验原理
溶液的电导随离子的数目、电荷和大小而变化,也随着溶剂的某些特性如粘度的变化而变化。这样可以预料,不同品种的离子对给定溶液产生不同的电导。因此,如果溶液里一种离子通过化学反应被另一种大小或电荷不同的离子取代,必然导致溶液的电导发生显著变化。电导滴定法正是利用这一原理完成欲测物质的定量测定。
一个电解质溶液的总电导,是溶液中所有离子电导的总和。即:
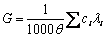 (2-1)
(2-1)
式中ci为第i种离子的浓度(mol?L-1),λi为其摩尔电导,θ为电导池常数。
弱酸的解离度α与其电导的关系可表示为:
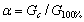 (2-2)
(2-2)
Gc为任意浓度时实际电导值,它是从实验中实际测量的,G100%为同一浓度完全解离时的电导值,它可从不同的滴定曲线计算而得。
醋酸在溶液中的解离平衡为:
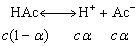
解离常数Ka为:
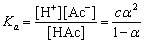 (2-3)
(2-3)
根据电解质的电导具有加和性的原理,对任意浓度醋酸在完全解离时的电导值,能从有关滴定曲线上求得。假如选用氢氧化钠滴定醋酸和盐酸溶液,可从滴定曲线上查得有关电导值后,按下式计算醋酸在100%解离时的电导值。
 (2-4)
(2-4)
式中GNaAc为醋酸被氢氧化钠滴定至终点的电导值,GNaCl为盐酸被滴定至终点的电导值。(注意:所述电导值应按式(2-1)校正至相同的物质的量浓度,式(2-4)才成立)。
三、仪器与试剂
1.DZDS-A电导仪(南京多助科技发展有限公司);
DJ51C型电导电极(铂黑电极)(南京多助科技发展有限公司);
2.电磁搅拌器(78-1磁力加热搅拌器)(金台市富华仪器有限公司);
…… …… 余下全文
醋酸解离度和解离常数的测定
实验目的
1. 学习测定弱酸解离度和解离常数的方法
2. 进一步熟悉滴定管和移液管的使用方法。
实验原理
醋酸是弱酸,在水溶液中存在解离平衡:
HAc=H+ + Ac-
若HAc的起始浓度为c,α为解离度,Ka为解离常数。则
Ka=([H+][Ac-])/[HAc]
=[H+]?/(c-[H+])
α=[H+]?/c×100%
当α<5%时,Ka≈[H+]?/c
因此,测定出已知浓度的HAc溶液的pH,即可计算其解离度和解离常数。
实验步骤
1. NaOH溶液的标定
2. 醋酸的标定
(同NaOH的标定类似,用移液管准确移取25ml 0.1mol/L的HAc溶液于250ml的锥形瓶中,加几滴酚酞指示剂,用已标定的NaOH去滴定此溶液至微红色,30s不退色即为终点。重复滴定3次,计算此HAc溶液的浓度。
3. 配制不同浓度的HAc溶液
用移液管分别量取上述HAc标准溶液25ml,10ml,和5ml,置于50ml容量瓶中,分别用蒸馏水稀释到刻度,摇匀。
4. 测定不同浓度HAc溶液的pH
将原溶液及上述3种不同浓度的HAc溶液分别转入4只干燥的50ml烧杯中,按照由稀至浓的顺序用pH计分别测定它们的pH,纪录数据和室温。计算HAc的解离度和解离常数。
…… …… 余下全文
醋酸解离度、解离常数的测定
一、实验目的
1、加深对弱电解质解离平衡、同离子效应的理解;
2、了解pH计的原理及其使用;
3、学习用pH计测定醋酸解离度和解离常数。
二、实验原理
醋酸(HAc)是弱电解质,在溶液中存在如下解离平衡:

或写成

在一定温度下,达到平衡后,溶液中[H+]=[Ac-]=[HAc]已解离,[HAc]=[HAc]起始-[HAc]已解离。若用c表示[HAc]起始,则


在醋酸—醋酸钠(NaAc)体系中,NaAc完全解离,产生大量的Ac-,因此,[HAc]已解离= [H+]≠[Ac-]。由于同离子效应,[Ac-]=[NaAc]。所以,该体系中
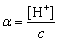

三、实验步骤
1、测定不同浓度醋酸的pH
①用吸管分别吸取25.00 mL、5.00 mL、2.50 mL 0.10 mol·L-1(需标定)的HAc溶液于三个50mL容量瓶中,用纯水稀释至标线,摇匀。编号为2、3、4 ,0.10 mol·L-1 HAc溶液编号为1。
②用pH计由稀到浓分别测定HAc溶液的pH。
2、同离子效应
分别吸取25.00 mL 0.10 mol·L-1 HAc 溶液、5.00 mL 0.10 mol· L-1 NaAc 溶液于同一个50 mL容量瓶中,用纯水稀释至标线,摇匀。编号为5,测定pH 。
四、实验数据记录与处理
c(HAc): c(NaAc): 温度:
…… …… 余下全文
