蛋白质的等电点测定及性质实验
一、实验目的
初步学会测定蛋白质等电点的基本方法,并了解蛋白质的性质。
二、实验原理
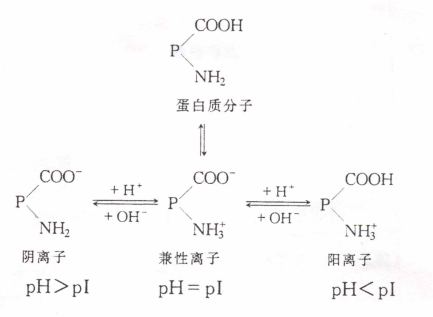
蛋白质分子是两性电解质,当调节溶液的酸碱度,使蛋白质分子上所带的正负电荷相等时,在电场中,该蛋白质分子既不向正极移动,也不向负极移动,这时溶液的pH值,就是该蛋白质的等电点(pI)。不同蛋白质,等电点不同。在等电点时,蛋白质溶解度最小,容易沉淀析出。因此,可以借助在不同pH溶液中的某蛋白质的溶解度来测定该蛋白质的等电点。
在蛋白质溶液中加入一定浓度的中性盐,蛋白质即从溶液中沉淀析出,这种作用称为盐析。盐析法常用的盐类有硫酸铵、硫酸钠等。蛋白质的盐析作用是可逆过程。由盐析获得的蛋白质沉淀,当降低其盐类浓度时,又能再溶解。而重金属离子与蛋白质结合成不溶于水的复合物。
三、试剂和器材
⑴ 高筋面粉、低筋面粉。
⑵ 1mol/L醋酸。(每组自配0.1mol/L醋酸、0.01mol/L醋酸)
⑶ 0.5%酪蛋白溶液。
称取2.5克酪蛋白,放入烧杯中,加入40℃的蒸馏水,再加入50毫升1N氢氧化钠溶液,微热搅拌直到蛋白质完全溶解为止。将溶解好的蛋白溶液转到500毫升容量瓶中,并用少量蒸馏水洗净烧杯,一并倒入容量瓶。在容量瓶中再加入1N醋酸溶液50毫升,摇匀,再加蒸馏水定容至500毫升,得到略显混浊的、在0.1N NaAc溶液中的酪蛋白溶液。
⑷ 鸡蛋白溶液。
将80mL鸡蛋清与800mL蒸馏水混合均匀后,用洁净的多层湿纱布垫在漏斗上过滤,滤液即为鸡蛋白溶液(不能有不溶性物悬浮)。要现配现用,最好使用经过煮沸并封在容器中隔绝空气冷却的蒸馏水。
⑸ 质量分数为5%的CuSO4溶液。(每排3组合配)
⑹ (NH4)2SO4饱和溶液。(确保有固体析出)
⑺ 天平、水浴锅、移液管、试管等。
四、操作步骤
1、蛋白质的等电点测定
⑴ 取5支同种规格的试管,编号,按表1顺序精确加入各种试剂,特别注意0.5%酪蛋白溶液最后加入,然后逐一振荡试管,使试管混合均匀。此时1、2、3、4、5管的pH值依次为5.9、5.3、4.7、4.1、3.5。
…… …… 余下全文