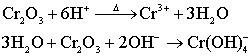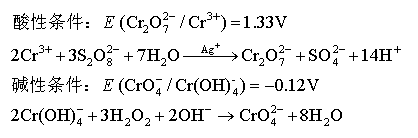实验八、铬、锰、铁、钴、镍
Chromium, Manganese, Iron, Cobalt,Nickel
实验学时:3 实验类型:验证性
实验所属实验课程名称:大学基础化学实验-1
实验指导书名称:无机化学实验讲义
相关理论课程名称:大学基础化学-1
撰稿人:谢亚勃 日期:2004.11.8
一、目的与任务:
本实验属验证性实验,是过渡元素教学过程中的一部分,对本科生进行这部分的理解和探索能力的培养方面有重要的作用。本实验将一部分课堂教学外的知识,放在实验课堂上进行研究。使学生在获得课堂知识的基础上,进一步探索元素及化合物的其它重要性质和反应,巩固和加深理解课堂上所学基本理论和基本知识;使学生受到观察实验现象,研究实验问题,总结实验结果及基本技能的训
练,培养学生具有观察问题和分析问题的能力、严谨的科学态度、实事求是的作风、勇于创新的精神。
二、内容、要求与安排方式:
1、实验项目内容 通过过渡元素性质的验证,对混合液设计分离鉴定方案,并通过实验对实验元素的性质进行总结。
2、实验要求要求通过实验加深对重要过渡元素和其化合物性质的理解,掌握定性分析的原理和方法,掌握过渡元素和化合物性质的重要递变规律。
3、为了使实验达到教学目标,对学生的要求如下:
(1)实验前要完成预习报告在阅读实验教材和参考资料的基础上,明确实验的目的和要求,弄清实验原理和方法,了解实验中的注意事项。预习报告简明扼要,切忌抄书,字迹清晰,实验方案思路清晰。
(2)实验过程要求认真按照实验内容和操作规程进行实验。如发现实验现象与理论不符,应独立思考,认真分
析查找原因,直到得出正确的结论。认真观察实验现象,记录实验数据。严格遵守实验室规则,爱护仪器设备,注意安全操作。
(3)实验记录要求在细心观察实验现象的基础上,将实验现象和数据记录预习报告上,不允许随手记在纸片或手上。
…… …… 余下全文




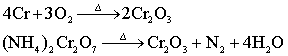 制备:
制备: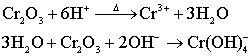 性质:
性质:
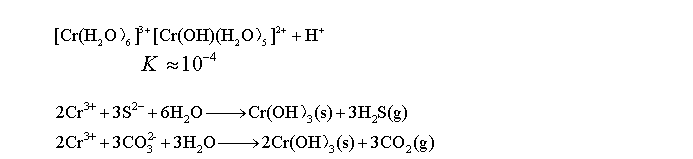

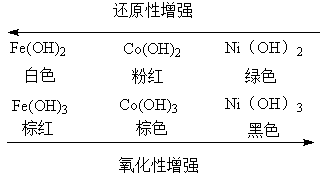
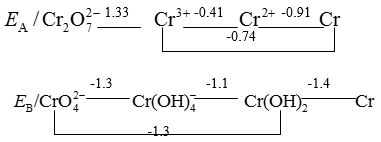
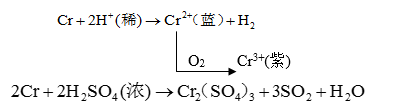
 铬单质
铬单质