EDTA标准溶液的标定和水的硬度测定
(四川农业大学生命科学与理学院(625014)应用化学09-2 王雨20096824 )
【摘 要】本实验利用络合滴定法分别标定了EDTA标准溶液、测定了自来水的硬度。
首先,以CaCO3为基准物质、钙指示剂指示滴定终点标定了EDTA标准溶液的浓度,得到其平均浓度为0.01592 mol·L-1。再以铬黑T为指示剂、用标定后的EDTA测定了水的总硬为12.61±0.01(°),以钙指示剂为指示剂测得水的钙硬为9.46±0.01(°),
则有镁硬为3.15±0.01(°)。
【关键词 】EDTA ;标定 ;水 ;硬度
1引言
EDTA是乙二胺四乙酸或其二钠盐的简称(缩写为H4Y或Na2H2Y·2H2O),由于前者的溶解度小,通常用其二钠盐配制标准溶液。尽管EDTA可制得纯品,但EDTA具有与金属离子配位反应普遍性的特点,即使是水和试剂中的微量金属离子或器壁上溶出的金属离子也会与EDTA反应,故通常仍用间接法配制标准溶液。一般先配成浓度约为0.01mol·L-1的溶液,再用基准物质来标定,常用的基准物质是Zn、ZnO、CaCO3、Bi、Cu、MgSO4 7H2O、Hg、Ni、Pb等。本实验控制pH在12~13的酸度下,以钙指示剂指示终点滴定,用CaCO3作为基准物质进行滴定。
7H2O、Hg、Ni、Pb等。本实验控制pH在12~13的酸度下,以钙指示剂指示终点滴定,用CaCO3作为基准物质进行滴定。
首先,所加钙指示剂与少量Ca2+反应,形成具有“足够”稳定性的酒红色配合物,滴定过程中滴加的EDTA与游离的Ca2+配位形成更稳定的(与指示剂配合物比较)配合物,最后EDTA再夺取指示剂配合物中的Ca2+而指示剂游离出来,溶液呈现出指示剂自身(在一定pH范围)的纯蓝色而显示终点。其相关反应:
HIn2- (纯蓝色)+ Ca2+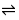 CaIn-(酒红色) +H+
CaIn-(酒红色) +H+
…… …… 余下全文

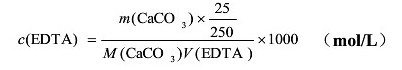

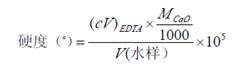
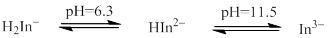
 (CaIn/MgIn)-
(CaIn/MgIn)- (CaEDTA/MgEDTA)+HIn2-
(CaEDTA/MgEDTA)+HIn2-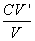 ×1000
×1000