氢氧化钠溶液的配制与酸碱滴定
一、 实验目的
1.掌握氢氧化钠溶液的配制方法
2.学习正确使用量筒、移液管、容量瓶、滴定管的方法
3.掌握酸碱滴定的原理和操作,测定HCl溶液的浓度
二、 实验基本原理
对于酸碱中和反应
满足关系式
c碱V碱 = c酸V酸
采取中和滴定的方法测定酸的浓度,用酚酞指示剂的颜色变化来确定滴加的溶液是否与被测溶液定量反应。
酚酞在酸性条件下为无色,碱性条件下为红色,以酚酞作指示剂用碱滴定酸时颜色由无色变到红色,滴定终点很容易判断
本实验以酚酞作指示剂,用氢氧化钠配成标准溶液滴定盐酸,便于滴定终点的判断。 HCl+NaOH = NaCl + H2O
三、 实验用品
容量瓶(250 mL),移液管(25 mL),碱式滴定管(50 mL),锥形瓶(250 mL),烧杯(100 mL),洗瓶,量筒,玻璃棒,药匙。
NaOH固体(AR),稀盐酸溶液(1 mol·L-1),酚酞指示剂,蒸馏水
四、 实验内容
(一)容量瓶、移液管和滴定管的洗涤
将容量瓶、移液管和碱式滴定管用蒸馏水润洗三次。
(二)NaOH溶液的配制
1.配制NaOH标准溶液(1 mol·L-1)
用天平准确称取10g氢氧化钠粉末(NaOH),倒入烧杯中,加适量蒸馏水溶解。溶液用玻璃棒引流转入250 mL容量瓶中,烧杯用少量蒸馏水洗,洗涤液转入容量瓶中,共需洗涤3~4次。加蒸馏水至离容量瓶的刻度线1cm处,改用胶头滴管,定容时要注意溶液凹液面的最低处和刻度线相切,眼睛视线与刻度线呈水平,不能俯视 或仰视,否则都会造成误差,摇匀静置。
(三)NaOH标准溶液(1 mol·L-1)滴定盐酸
1.用移液管移取适量NaOH标准(1 mol·L-1)对碱式滴定管进行润洗,用移液管移取适量NaOH标准(1 mol·L-1)于碱式滴定管中
2.用左手挤压碱式滴定管下端胶管中的玻璃球,使NaOH溶液滴入右手拿的锥形瓶中,同时右手持锥形瓶沿同一方向做圆周摇动,使溶液混合均匀。开始滴定时,溶液滴出速度可快一些,但应成滴而不成线。碱溶液滴入盐酸中溶液局部出现粉红色,随着锥形瓶的摇动颜色很快消失。当接近终点时,颜色消失较慢,这时应减慢滴加溶液速度,每加一滴溶液摇匀后由溶液颜色变化再决定是否滴加溶液。最后,当溶液颜色消失很慢时,每次滴入半滴溶液,并用洗瓶冲下摇匀。滴定至溶液的红色在30 s不褪色,即为终点。记下消耗碱的体积。
(四)数据记录与结果处理

五、注意事项
(1)根据所配溶液的体积选取相应规格的容量瓶
(2)容量瓶在使用前要检查是否漏水
(3)容量瓶中不能将固体或浓溶液直接溶解或稀释,容量瓶不能作为反应容器
(4)引流时,玻璃棒下端应伸到刻度线以下;
(5)在容量瓶的使用过程中,移动容量瓶,手应握在瓶颈刻度线以上部位,一面瓶内溶液受热而发生体积变化,使溶液浓度不准确.
(6)容量瓶是刻度精密的玻璃仪器,不能用来溶解
(7)溶解完溶质后溶液要放置冷却到常温再转移
(8)溶解用烧杯和搅拌引流用玻璃棒都需要在转移后洗涤两三次
(9)把小烧杯中的溶液往容量瓶中转移,由于容量瓶的瓶口较细,为避免溶液洒出,同时不 要让溶液在刻度线上面沿瓶壁流下,用玻璃棒引流
(10)定容时要注意溶液凹液面的最低处和刻度线相切,眼睛视线与刻度线呈水平,不能俯视 或仰视,否则都会造成误差
(11)定容一旦加入水过多,则配制过程失败,不能用吸管再将溶液从容量瓶中吸出到刻度
(12)摇匀后,发现液面低于刻线,不能再补加再补加蒸馏水,因为用胶头滴管加入蒸馏水定 容到液面正好与刻线相切时,溶液体积恰好为容量瓶的标定容量。摇匀后,竖直容量瓶时会出现液面低于刻线,这是因为有极少量的液体沾在瓶塞或磨口处。所以摇匀以后不需要再补加蒸馏水,否则所配溶液浓度偏低
(13) 滴定时,最好每次都从零位开始或接近零的任一刻度开始。这样可固定在某一段体积范围内滴定,减少测量误差。 滴定管在使用前应先做一些初步检查,碱式管的胶管孔径与玻璃珠大小是否合适,胶管是否有孔洞、裂纹和硬化,滴定管是否完好无损
(14) 滴定管下端不能有气泡,轻轻抬起尖嘴玻璃管,并用手指挤压玻璃球,可赶走碱式滴定管中气泡
(15)左手挤压碱式滴定管下端胶管中的玻璃球,右手拿的锥形瓶中,同时右手持锥形瓶沿同一方向做圆周摇动,使溶液混合均匀
六、实验时间
1小时以内
七、参赛人员(16人)
八、比赛时间
20xx年6月13日
八、评分标准(参照评分表格评分)
第二篇:酸碱标准溶液的配制和比较滴定
实验九酸碱标准溶液的配制和比较滴定
一、试验目的
1. 掌握酸碱溶液的配制方法。
2. 掌握酸碱滴定的原理和正确判断滴定终点。
3. 学习滴定的基本操作。
二、实验原理
在酸碱滴定中,常用的酸碱溶液是盐酸和氢氧化钠,由于它们都不是基准试剂,因此必须采用间接法配制,即先配成近似浓度,然后再用基准物质进行标定。
酸碱中和反应的实质是:
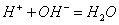
当反应达到化学计量点时,用去的酸与碱的量符合化学反应式所表示的化学计量关系,对于以NaOH溶液滴定HCl溶液,这种关系是
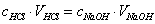
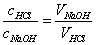
由此可见,NaOH溶液和HCl溶液经过比较滴定,确定它们完全中和时所需体积比,即可确定它们的浓度比。如果其中一溶液的浓度确定,则另一溶液的浓度即可求出。
本实验以酚酞为指示剂,用NaOH溶液滴定HCl溶液,当指示剂由无色变为微红色时,即表示达到终点。
三、仪器与药品
1.仪器:酸式滴定管、碱式滴定管、锥形瓶、500ml烧杯、小量筒。
2.药品:浓盐酸、氢氧化钠固体、0.2%酚酞、0.2%甲基橙。
四、实验步骤
1.0.2mol·L-1酸碱溶液的配制
用洁净的小量筒量取一定量的浓盐酸(自己计算体积),倒入500ml试剂瓶中,用蒸馏水稀释至500ml,盖上玻璃塞,摇匀,贴上标签备用。
在台秤上称取一定量的固体氢氧化钠(自己计算质量),置于500ml烧杯中,加50ml水使之全部溶解,转入500ml试剂瓶中,再加水稀释到500ml。用橡皮塞塞好瓶口,充分摇匀,贴上标签备用。
2.酸碱溶液浓度的比较
用0.2mol·L-1盐酸溶液荡洗已洗净的酸式滴定管,每次5~10ml溶液,从滴定管嘴放出弃去,共洗三次,以除去沾在管壁及旋塞上的水分。然后装满滴定管,取碱式滴定管按上述方法荡洗三次并装入氢氧化钠溶液,除去橡皮管下端的空气泡。
调节滴定管内溶液的弯月面在刻度零处或略低于零的下面,静止1min,准确读数,并记录在报告纸上,不得随意记录在纸片上。
由酸式滴定管放出20~30ml盐酸溶液于250ml锥形瓶中(准确记下体积数),加入50ml去离子水稀释,再加入滴酚酞指示剂,用氢氧化钠溶液滴定至出现微红色且30s不褪色,即为终点。记下所消耗的氢氧化钠溶液的体积。
重新把滴定管装满溶液,按上法再滴定两次(平行滴定,每次滴定应使用滴定的同一段体积),计算氢氧化钠与盐酸的体积比。
五、思考题
1.配制盐酸标准溶液时采用什么量器量取浓盐酸?为什么?
2.配制氢氧化钠标准溶液时用什么容器称取固体氢氧化钠?可否用纸做容器称取固体氢氧化钠?为什么?
3.滴定管在使用时,记录应记准几位有效数字?
4.在做完第一次比较实验时,滴定管中的溶液已差不多用去一半,问做第二次滴定时继续用剩余的溶液好,还是将滴定管中的标准溶液添加至零刻度附近再滴定为好?说明原因。
5.既然酸、碱标准溶液都是间接配制的,那么在滴定分析中所使用的滴定管、移液管为什么需要用操作液润洗几次?锥形瓶和烧杯是否也需要用操作液润洗?为什么?
