化学综合设计性实验报告
三草酸根合铁(III)的制备与性质和组成分析
教学院: 化学与制药工程学院
班 级: 药剂0901班
姓 名: 黄启
学 号: 09240132
实验日期: 2011年11月1日
摘要:
三草酸根合铁(III)酸合成工艺有多种,例如,可采用氢氧化铁和草酸氢钾反应;也可用硫酸亚铁铵与草酸反应得到草酸亚铁,再在过量草酸根存在下用过氧化氢,本实验采用三氯化铁和草酸钾直接反应制备。
通过本实验,我们应掌握三草酸根合铁(III)酸钾的制备方法;熟悉化学分析、热分析、等方法在化合物组成分析中的应用;了解三草酸根合铁(III)酸钾的光化学性质。
一、实验目的
1、掌握三草酸根合铁(III)酸钾的制备方法。
2、熟悉化学分析、热分析、电导率测定等方法在化合物组成分析中的应用。
3、了解三草酸根合铁(III)酸钾的光化学性质。
二、实验原理
1、K3[Fe(C2O4)3]·3H2O为亮绿色晶体,溶于水(0℃时4.7g/100g水,100℃时117.7g/100g水),难溶于乙醇、丙酮等有机溶剂。110℃失去结晶水,230℃分解。
 2、该配合物对光敏感;可进行下列光反应:
2、该配合物对光敏感;可进行下列光反应:
 2 K3[Fe(C2O4)3] 2FeC2O4+3K2C2O4+2CO2
2 K3[Fe(C2O4)3] 2FeC2O4+3K2C2O4+2CO2
3、用稀H2SO4可使三草酸根合铁﹝III﹞酸钾分解产生Fe3+和C2O2-4 用高锰酸钾标准溶液滴定试样中的C2O2-4 此时Fe3+不干扰测定,滴定后的溶液用锌粉还原为Fe3+。
4、过滤除去过量的锌粉,使用高锰酸钾标准溶液滴定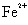 。
。
5、通过消耗高锰酸钾标准溶液的体积及浓液计算得到C2O2-4和Fe3+的含量并确定化学式和原子结合的方式。
三、主要仪器装置与试剂
天平,台秤,电导率仪,抽滤瓶 , 布氏漏斗循环水泵 , 棕色容量瓶 ,烧杯 ,量筒 蒸发皿。
草酸钾(K2C2O4 H2O,化学纯)三绿化铁(FeCl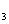 6H2O,化学纯 ),K
6H2O,化学纯 ),K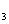 ﹝Fe(CN)6﹞(化学纯), NaOH(2mol/L),H2SO4 (2mol/L,0.2mol/L),
﹝Fe(CN)6﹞(化学纯), NaOH(2mol/L),H2SO4 (2mol/L,0.2mol/L), 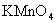 标准溶液(0.0200mol/L)
标准溶液(0.0200mol/L)
四、实验内容与步骤
1、三草酸根合铁(III)酸钾的制备
称取6g草酸钾放入100mL烧杯中,加10mL水,加热使全部溶解.在溶液近沸时边搅拌加入4mL水和2.7g三氯化铁,将此溶液在冷水中冷却既有绿色晶体析出,析出完全后减压过滤得粗产品。
将粗产品溶解在约10mL热水中,趁热过滤。将滤液在冰水中冷却,待结晶完全后抽滤晶体产物先用少量冰水和丙酮洗涤,晾干,称重,计算,产率
2.、配合物的组成分析
①C2O2-4 的测定:准确称取约1g合成的三草酸合铁(III)酸钾绿色晶体于烧杯中,加入25mL 3mol/L的硫酸使之溶解再转移至250mL容器瓶中,稀释至刻度,摇均。移取25mL试液于锥形瓶中加入20mL3mol/L硫酸,在70~80℃水浴中加热5min后,趁热用高锰酸钾标准溶液滴定到溶液呈浅粉色,且30s 不褪色即为终点,计下读数。平行测定三次,每次滴定完后溶液保留。
②Fe3+的测定:往上述滴定后的每份溶液中加入1g锌粉、5mL3moL/L硫酸振荡8~10min后,过滤除去过量的锌粉,滤纸用另一个锥行瓶承接。用40mL 0.2mol/L的硫酸溶液洗涤原锥行瓶和沉淀,然后用高锰酸钾标准溶液滴定到溶液呈浅粉色,30s不褪色即为终点计下读数平行测定三次。
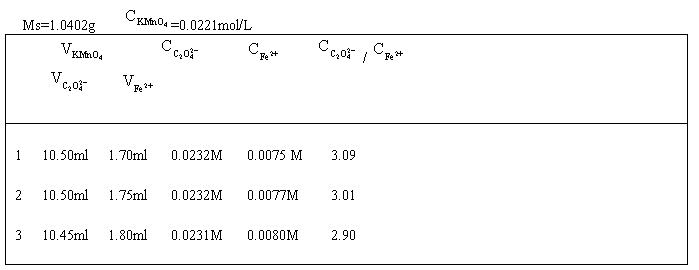
五、实验数据记录与处理
所得三草酸根合铁(Ⅲ)酸钾的质量 3.2g
实验所取三草酸根合铁(Ⅲ)酸钾的质量Ms=1.0402 g
1、计算25ml三草酸根合铁(Ⅲ)酸钾之中草酸根的浓度
 = 0.0221 moL/L
= 0.0221 moL/L
2MnO + 5C2O2-4 +16H
+ 5C2O2-4 +16H = =2Mn
= =2Mn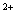 + 10CO2+8 H2O
+ 10CO2+8 H2O
由方程式可知 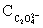 *
*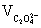 =
= 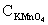 *
* 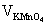 × 5/2得:
× 5/2得:
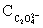 1=0.0232moL/L
1=0.0232moL/L
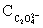 2=0.0232 moL/L
2=0.0232 moL/L
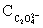 3=0.0231 moL/L
3=0.0231 moL/L
其平均值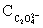 =(0.0232+0.0232+0.0231)/3=0.0232moL/L
=(0.0232+0.0232+0.0231)/3=0.0232moL/L
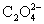 的含量
的含量 =
=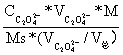 *100%=
*100%=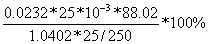 =49.08%
=49.08%
2、计算25ml三草酸根合铁(Ⅲ)酸钾之中 Fe3+的浓度
MnO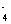 + 5Fe
+ 5Fe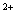 + 8H
+ 8H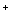 == Mn
== Mn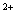 +5Fe3+ +4H2O
+5Fe3+ +4H2O
由化学方程式可知:n(Fe3+) : n(KMnO ) = 5 : 1
) = 5 : 1 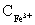 ×
× =
= 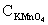 ×
× 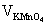 × 5×10
× 5×10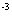 得:
得:
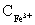 1= 0.0075 moL/L
1= 0.0075 moL/L
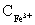 2=0.0077moL/L
2=0.0077moL/L
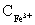 3= 0.0080 moL/L
3= 0.0080 moL/L
其平均值 =(0.0075+0.0077+0.0080)/3 mol/L=0.0077mol/L
=(0.0075+0.0077+0.0080)/3 mol/L=0.0077mol/L
同理可得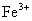 的含量
的含量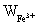 =
=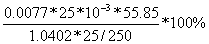 =10.34%
=10.34%
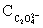 1 :
1 :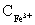 1= 0.0232/0.0075=3.09
1= 0.0232/0.0075=3.09
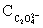 2 :
2 :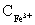 2 =0.0232/0.0077=3.01
2 =0.0232/0.0077=3.01
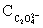 3 :
3 :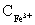 3=0.0231/0.0080=2.90
3=0.0231/0.0080=2.90
取平均值得 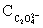 :
: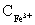 =3.00 。即
=3.00 。即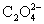 与
与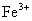 的配合比为3.00:1.00。
的配合比为3.00:1.00。
3、求三草酸根合铁(Ⅲ)酸钾之中的结晶水数量:
由所计算数据三草酸根合铁(Ⅲ)酸钾的化学式为K3[Fe(C2O4)3。00] ·nH2O
由化学式可知 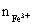 :
: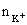 = 1:3
= 1:3
则 的百分含量
的百分含量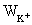 =
=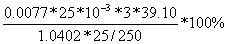 =21.71%
=21.71%
故 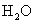 的百分含量为
的百分含量为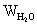 =1-
=1- -
-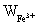 -
-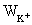 =18.87%
=18.87%
且 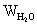 =
=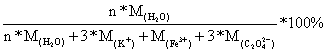
代入数据得 n=3.88
即化学式为 K3[Fe(C2O4)3.35] ·3.88H2O
六、注意事项
制备三草酸根合铁
I)酸钾时,可以往溶液中加入少量丙酮或乙醇,促使晶体析出完全。
七、误差分析与讨论
1、读数误差:称量药品、配制溶液以及量取溶液时,都会有人为因素导致读数误差,因此读数误差给本实验带来的影响是影响实验准确性的原因之一;
2、滴定误差:在滴定待测溶液时,不能很好的把握终点,容易滴过终点,会造成实验数据的不准确,所以亦影响本实验;
3、操作误差:本实验的化学反应或滴定反应都要在特定的温度范围内,如果操作时没有达到温度范围,会影响化学反应进行的程度而使实验不准确;
4、药品本身带来的误差:本实验的药品在实验反应的条件下会由于发生副反应或会发而使得实验有一定的误差;
5、实验一定要按着规范的流程进行,否则也可能给实验带来不利影响。
通过本次实验的学习,使我对设计性的实验有了一定的了解,同时掌握了三草酸根合铁(Ⅲ)酸钾的制备方案,在实验过程中应该认真操作,规范对仪器的使用,加深了我们对实验仪器操作时的规范要求的印象,提高我们的实验技巧和实验能力,对以后的学习和工作会有很大的帮助的。
八、思考题
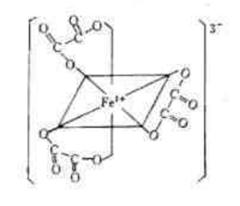 1、[Fe(C2O4)3]3-的结构式为?
1、[Fe(C2O4)3]3-的结构式为?
 [Fe(C2O4)3]3-的结构式为
[Fe(C2O4)3]3-的结构式为
2、.三草酸根合铁(III)酸钾固体和溶液应如何保存?
由于其具有光敏性,应避光保存
3、用化学式表示本实验Fe3+和C2O2- 4的测定原理。
 2MnO
2MnO + 5C2O2-4 +16H
+ 5C2O2-4 +16H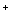 == 2Mn
== 2Mn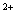 + 10CO2 +8 H2O
+ 10CO2 +8 H2O
MnO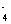 + 5Fe
+ 5Fe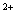 + 8H
+ 8H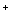 == Mn
== Mn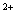 +5Fe3+ +4H2O
+5Fe3+ +4H2O
4.设计实验方案,定性说明产物中的Fe3+和C2O2- 4是处在配合物的外界还是内界。
(1).检定K+时分别取少量l mol/L K2C2O4及产品溶液,分别与饱和酒石酸氢钠NaHC4H4O6溶液作用。充分摇匀。观察现象是否相同。如果现象不明显,可用玻璃棒摩擦试管内壁。
(2).检定C2O42-。在少量l mol/L K2C2O4 及产品溶液中。分别加入2滴0.5 mol/L
CaCl2溶液,观察现象有何不同。
(3).检定Fe3+。在少量0.2 mol/L FeCl3及产品溶液中。分别加入1滴l mol/L KSCN溶液,观察现象有何不同。
综合以上实验现象。确定所制得的配合物中。哪种离子在内界,哪种离子在外界。
九、原始数据粘贴处:
十、教师评阅意见:
成绩 指导教师
第二篇:甲烷的制法与性质2实验报告1
甲烷的制法与性质
段玉霞 学号:40907145
20##级化学3班,第二实验小组,邮箱275167260@qq.com
一、实验目的与要求
1、掌握甲烷的实验室制法及了解甲烷的性质
2、熟练掌握固热加热制备气体的装置。
3、初步掌握本实验的演示教学方法。
4、掌握并熟练实验仪器正确的使用方法。
5、锻炼中学化学实验展示技能。
二、实验原理
1、制备反应

 CH3COONa + NaOH Na2CO3 + CH4
CH3COONa + NaOH Na2CO3 + CH4
链引发:CH3COONa → ·CH3 + ·COONa
甲烷生成:·CH3 + NaOH → CH4 +·ONa
碳酸钠生成:·ONa + CH3COONa →·CH3 + Na2CO3
链中止:·ONa + ·COONa → Na2CO3
当反应温度过高时:·CH3 + CH3COONa → CH3COOCH3 +·ONa
 链中止时产生CO:2·COONa → Na
2CO
3 + CO
链中止时产生CO:2·COONa → Na
2CO
3 + CO
故表现为的总反方程式为:CH3COONa + NaOH === Na2CO3 + CH4↑
2、甲烷的性质
(1)、分子结构:正四面体形非极性分子,一个C以sp3杂化位于正四面体中心,4个H位于正四面体的4个顶点上。

甲烷的立体结构
(2)、物理性质:通常条件下甲烷是无色、无味、可燃和微毒的气体。甲烷对空气的重量比是0.54,比空气约轻一半。熔点:-182.5℃,沸点:-161.5℃ ,甲烷溶解度很小,极难溶于水(可以用排水法收集甲烷气体)。
(3)、化学性质:
1)、与高锰酸钾和溴水反应不褪色:把制得的甲烷气体通入盛有高锰酸钾溶液(加几滴稀硫酸)的试管里,没有变化。再把甲烷气体通入溴水,溴水不褪色。
2)、取代反应:与氯气在光照条件下可以发生取代反应,生成多氯代物。
 甲烷与Cl
2的取代反应:
甲烷与Cl
2的取代反应:
 CH
4 + Cl
2 → CH
3Cl + HCl,
CH
4 + Cl
2 → CH
3Cl + HCl,
 CH
3Cl + Cl
2 → CH
2Cl
2 + HCl,
CH
3Cl + Cl
2 → CH
2Cl
2 + HCl,
 CH
2Cl
2 + Cl
2 → CHCl
3 + HCl,
CH
2Cl
2 + Cl
2 → CHCl
3 + HCl,
CHCl3 + Cl2 → CCl4 + HCl。
3)、氧化反应:
点燃纯净的甲烷,在火焰的上方罩一个干燥的烧杯,很快就可以看到有水蒸气在烧杯壁上凝结。倒转烧杯,加入少量澄清石灰水,振荡,石灰水变浑浊。说明甲烷燃烧生成水和二氧化碳。甲烷燃烧发出淡蓝色的火焰。

 CH4 + O2 H2O + CO2
CH4 + O2 H2O + CO2
三、实验材料与试剂
铁架台、酒精灯、托盘天平、研钵、水槽、坩埚钳、药匙、玻璃棒、火柴、集气瓶、毛玻璃片、分液漏斗
无水乙酸钠、碱石灰、生石灰、NaOH、Fe2O3、H2O2、MnO2、溴水、澄清石灰水、高门酸钾溶液
四、实验内容
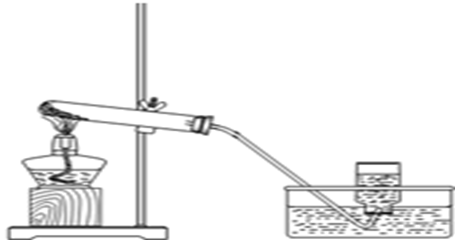

1、甲烷的制备
方法一:
1)、清洗与干燥大试管(由于反应试剂中有无水乙酸钠)。
2)、用固固加热装置制备甲烷气体,检查装置气密性,导管没入水中,用手捂住大试管,如果有气泡冒出,并且松手后形成一段液柱,就说明该套装置气密性良好。
3)、称取药品,分别称取1.5gCH3COONa 、0.5gNaOH、0.5gCaO(氧化钙在甲烷制备中的作用有四:一是吸水;二是吸收反应生成的二氧化碳;三是分散高温下对玻璃试管有严重腐蚀的氢氧化钠;四是把加热时因熔化(CH3COONa 熔点3240C,NaOH 熔点3180C )而易流动的无水醋酸钠和氢氧化钠固定在试管的加热部位)。,分别放入研钵研细,之后用玻璃棒混匀后倒入到预先叠好的纸槽里,装入干燥的大试管中,然后用带导管的单孔橡皮塞塞紧试管。
4)、将试管固定在铁架台上点燃酒精灯,均匀加热后,固定在药品的底部加热点燃酒精灯后,先均匀预热试管,然后集中在靠近试管口的药品部位加热,
5)、用排水法收集甲烷,导气管开始有气泡冒出,待气泡快速、均匀冒出时,将导气管伸进试管中。当气泡量略有减小时,可移动酒精灯向试管底部加热。当试管口冒出第一个气泡时,用大拇指堵住试管口后移出水面。
6)、将导管移出水面后再将酒精灯移开验纯,将收集好的甲烷气体的试管倾斜倒置后,移到酒精灯火焰后,松开大拇指后听到“噗”声后说明收集的气体较纯。
7)、清洗装置(清洗时可以用少量稀硫酸),并烘干使用。
方法二:
1)、用天平称取6gCH3COONa,4gNaOH,4gFe2O3,分别研细混匀。将药瓶装入干燥试管,管口略向下倾斜,塞上带导管橡皮塞并固定于铁架台上。预热1min后,再对试管底部加热,约1~2min,既有大量CH4生成。用排水法收集甲烷气体备用。
实验改进的优点:该反应不需要烘干药瓶,产气快,气流稳,气量多,火焰大,节省时间,操作简便,并且Fe2O3传热性快,密度较大,固着作用较强。
2、甲烷的性质
(1)、甲烷与酸性高锰酸钾溶液反应:取一支试管,加入约3mL酸性高锰酸钾溶液,通入甲烷气体,观察溶液颜色并没有褪去,说明甲烷不与酸性高锰酸钾溶液反应。
(2)、甲烷与溴水反应:取一支试管,加入约3mL溴水,通入甲烷气体,观察溶液颜色并没有褪去,说明甲烷不与溴水反应。
(3)、甲烷在空气中燃烧 :点燃纯净的甲烷,在火焰的上方罩一个干燥的烧杯,很快就可以看到有水蒸气在烧杯壁上凝结。倒转烧杯,加入少量澄清石灰水,振荡,石灰水变浑浊。说明甲烷燃烧生成水和二氧化碳。甲烷燃烧发出淡蓝色的火焰。
(4)、甲烷与氧气混合爆鸣实验:在集气瓶中分别收集甲烷气体体积为1/3、1/2、2/3后,再用二氧化锰催化双氧水制备氧气的装置制备氧气,分别用排水法在集气瓶中收集剩余体积的氧气,盖好瓶口,用抹布包住集气瓶,瓶口对住火焰点燃,发生爆鸣。甲烷的爆炸极限的体积比为5%~15%,所以甲烷体制越少爆炸越激烈。
五、实验注意事项
1、此实验必须保证药品是无水的,在做实验之前必须要烘干仪器。
2、加热硬质试管时,首先得预热以防止局部受热引起试管破裂,然后再在药品上加热让其反应。
3、碱石灰是苛性钠和生石灰的混合物(1:1),该实验中的CaO并不参与反应,它的作用是除去苛性钠中的水分、减少苛性钠与玻璃的作用,防止试管炸裂,同时也使反应混合物疏松,便于甲烷的气体的逸出。
4、实验中生石灰(CaO)没有参与反应,但其含量的多少对反应的成败至关重要。生石灰用量过少,氢氧化钠浓度高,与试管接触面大,由于氢氧化钠对玻璃的腐蚀作用使试管破损率高;而当生石灰用量过多时,将仿碍CH3COONa 跟NaOH 的接触,致使反应速度减慢,甲烷产率降低。适量的生石灰,有利于主反应的进行。
5、实验装置中大试管口必须向下倾斜,由于固体颗粒不会发生迸溅所以试管口不需要放一团棉花。
6、、收集完气体时必须要先撤导管再撤酒精灯。
7、做甲烷与氧气混合爆鸣实验时,集气瓶口不要对准有人的地方,操作时集气瓶略微向上,略高于火焰,否则爆炸的气流可将酒精灯扑灭。
六、实验改进
1、在学生实验时考虑到反应产物中含有不饱和烃、二氧化碳等杂质气体对甲烷性质实验的干扰,建议实验时除了要用干燥的硬质大试管外,还应安装缓冲和洗气装置。实验装置按:反应试管→洗气瓶→缓冲瓶→水槽这一顺序为宜。
1、药品用量的改进
(1)、氢氧化钠要充分过量
充足的氢氧化钠是甲烷制备实验取得良好效果的重要保证.理由有三: (a)提高反应速度( 由质量作用定律知) .在实验中,因无水醋酸钠价格较高,所以无水醋酸钠作限量试剂,氢氧化钠作过量试剂有益于主反应发生和阻止副反应发生.由此可知道,参加反应的无水醋酸钠与氢氧化钠的物质的量之比为1∶1,但从反应机理的第二、第三可以看出,若要让氢氧化钠完全作用掉醋酸根脱羧得到的二氧化碳,二者的物质的量之比应为1∶2,也就是说,只有当氢氧化钠的量约为理论用量的二倍时才能顺利启动该反应.实验表明,CH3COONa∶NaOH=1∶1 (质量比)混合反应时实验效果最佳.
(2)、合理地选择掺入物
在制备甲烷的实验中, 要慎用掺入物. 一方面,该反应是在熔融状态下进行的,反应物的充分接触有利于反应的发生.若加入掺入物,特别是加入分散程度很高的粉末状掺入物,必然阻碍醋酸钠与氢氧化钠接触,使反应速度减慢,还可能引起副反应发生,使产气量降低,另一方面,有些掺入物会直接与甲烷反应,不仅降低了甲烷的产率,而且也影响到甲烷的纯度.通过热力学计算[和前沿分子轨道(FMO)能量分析,常见金属氧化物与甲烷反应趋势为: AgO2>HgO>CuO>PbO>NiO>CoO>MnO2>Fe2O3>SnO2>ZnO>Cr2O3>Al2O3>MgO>CaO,实验表明,CuO、MnO2、Fe2O3、ZnO 等作为掺入物时可与甲烷发生反应,而Cr2O3、Al2O3、MgO、CaO作为掺入物时不与甲烷发生反应,因此,ZnO 以前的氧化物不适合作甲烷制备的掺入物。
2、实验装置的改进
(1)、在学生实验时考虑到反应产物中含有不饱和烃、二氧化碳等杂质气体对甲烷性质实验的干扰,建议实验时除了要用干燥的硬质大试管外,还应安装缓冲和洗气装置。实验装置按:反应试管→洗气瓶→缓冲瓶→水槽这一顺序为宜。
(2)、采取必要的导热措施
实验中副反应较多的原因是在反应体系透气性差,局部过热条件下发生的,因此,要想阻止该副反应发生,必须在反应器中安装一个导热装置或采用其它导热措施。
(3)、避免反应混合物与试管直接接触
如果反应物与试管直接接触,可能出现下面结果:
(a)试管在反应中途破裂.高温下,熔融的氢氧化钠强烈腐蚀试管,造成试管强度降低.这就是教材或其它文献不直接使用氢氧化钠与无水醋酸钠混合的重要原因。
(b)反应结束后,试管内残渣难以立即清除,试管在冷却过程中发生了破裂.一般发生在停止加热后100- 120s 内.这是因试管冷却时由于内外温
差而引起的应力所致。
(c)试管禁不起再用.采用掺入物的做法,尽管减轻了氢氧化钠对试管的腐蚀,但并不能克服试管出现斑点和发毛现象的发生,致使试管的强度大大降低,再用时极易破裂.且造成的危害或损失可能更大。
改进的方法:
1)、方法一———铝箔绝缘法
用铝箔将反应物与试管隔开,用还原铁粉或铜粉掺入混合物中作为导热材料.操作步骤为:
(a)取没有破损的“锡纸”(来自香烟盒内),用水浸湿后除去纸层即得铝箔.若有皱纹,可将其放在平面玻璃上用干净的试管辗平即可.晾干或烤干备用。
(b)根据实验需要,剪取大小合适的铝箔片(一般长为试管长度的4 /5,宽为试管外壁周长的2 /3)将备好的药品平铺在重叠的2- 3 张铝箔片上,然后将铝箔片窝成半圆槽状,慢慢送入试管底部用玻璃棒轻轻压实药品,保证试管与铝箔,铝箔与药品紧密接触,提高传热效果按教材要求装好仪器,进行实验反应结束后,卸下试管,轻轻摇动,粘在铝箔上的残渣即可整体倒出。
2)、方法二———铁屑绝缘法
该方法是用铁屑将反应混合物与烧瓶隔开(铁屑起绝缘和导热双重作用,用量较大).操作步骤为:
(a)取新刨的铸铁屑(来自机械厂车床),放入坩埚或铁皮筒中,烧去油污(灼烧过程中禁止搅拌,以防氧化),冷却待用。
(b)取以上处理过的铁屑110g左右,装入100mL的圆底烧瓶中,竖直轻轻震荡,使铁屑平铺在烧瓶底部,并使细末落入最下层。
(c)将烧瓶竖直固定在铁架台上,配上单孔橡皮塞和导气管,检查气密性。
(d)称取醋酸钠3g,氢氧化钠3g,迅速研细混匀,借助一根粗玻管(比烧瓶颈口稍细)将药品放置到烧瓶内的铁屑表面的中央位置
(e)按要求连接其它仪器,即可进行甲烷的制备实验
(f)反应结束,待烧瓶自然冷却后,卸下烧瓶,轻轻摇动,先倒出未结块的铁屑(回收之)
然后向烧瓶中加入适量的水,待结块完全“溶解”后再一并倒出(铁屑还可以回收)。
3)、方法三———铁皮绝缘法
用铁皮将反应混合物与试管隔开,用螺旋状细铁丝圈作为导热材料. 操作步骤为:
(a) 剪取一块长为16cm,宽为5 的薄铁皮(来自废饮料筒、油漆桶等,越薄越好),烧去表面的涂层,窝成槽状,以能塞入直径为25cm的大试管为宜, 并使其能与试管壁紧密接触。
(b)取一根足够长的细铁丝, 借助玻棒缠绕成3- 4 个螺旋铁丝圈(直经5- 6mm,长约14mm),置于铁皮槽内。
(c)称取醋酸钠3g,氢氧化钠3g,迅速研细混匀,平铺在放有铁丝圈的槽内, 然后送入25mm×200mm的大试管中.在紧靠试管口的铁槽一端堆积一些粉笔细末,防止熔化的药品流出槽外。
(d)按要求连接好仪器即可进行实验。
(e)反应结束,待试管冷却后,卸下试管,用带钩的铁丝取出铁皮槽和铁丝圈,洗涤、干燥后以 备再用。
(3)、甲烷实验室制备的绿色装置设计
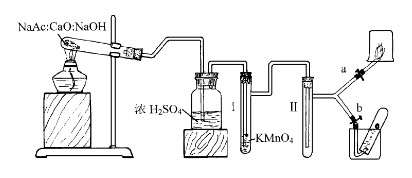
此制取甲烷气体装置的优点有:1)、通过浓H2SO4除去了甲烷气体中的少量杂质,确保了进行甲烷进行稳定性性质实验时的准确性。2)、利用Ⅱ具支试管起缓冲作用,能获得平稳的甲烷气流,做可燃性气体实验时,点燃后的的火焰平稳且大。3)、省时省药品,实验现象和效果明显。
七、实验教学技能反思
优点:
1、教态自然,大方,教师角色定位较好。
2、讲解连贯,完整和详细。
3、讲课过程中声音洪亮、清晰,对实验讲解与操作也做好的很好的准备。
缺点:
1、眼神与学生缺少交流,并且目光没有照顾到全体同学。
2、口语化语言和口误过多,语言没有科学性,课堂上应该多用陈述句来告知,且表达时要有有逻辑性。
3、仪器与实验过程讲解凌乱,应该有条理的讲解。
4、课堂上还是缺少互动,课堂氛围不够浓厚。
5、知识性错误较多:(1)、检查气密性良好时,观察水柱时不应该将导管移除水槽观察水柱;(2)、送药品的纸槽不应太大,否则药品就会洒出来;(3)、讲解氧化钙的作用时太过简单,没有把握住知识的重难点。
6、学生回答完问题时应该做出及做出评判和评价。
八、参考文献
[1]李建东 碱石灰对甲烷制备实验影响的探讨[J].化学教育 20##年6 月第2 期 ;
[2]黄静 丁伟 王星乔 甲烷制备反应机理及最佳条件的再探讨《教学仪器与实验》第25 卷20##年第8 期 第21页
[3]任有良 张国春 刘萍 甲烷制备实验的认识与改进 20## 年6 月 第21 卷第2 期 第85页
