五年级英语期末复习知识点归纳:
1. 每个单元culture time 的内容要熟练掌握。
(1) Coffee is popular in Western countries. Tea is popular in China.
(2) In the UK, this is the ground floor. In the US, this is the first floor.
(3) You can see pandas in China. You can see bald eagles in the US.
You can see polar bears in Canada. You can see kangaroos in Australia.
(4) In the US, we call a policeman a “cop”. In the UK, we call a firefighter a “fireman”.
(5) We write Chinese addresses like this .
( 北京市朝阳区八里庄第三小学 张华 收 ) ( 大—— 小)
We write English addresses like this.
( Mr. George Smith 8 Garden Street Cambridge , MA 02138 USA ) ( 小 --- 大 )
(6) Basketball is very popular in the US. Football is very popular in the UK.
Table tennis is very popular in China.
2. there be 句型: 表示某地有某物。翻译为:“有”。
各种句式:
肯定句:There is a book on the desk. There are some students in the classroom.
否定句:There isn’t a book on the desk. There aren’t any students in the classroom.
一般疑问句:Is there a book on the desk ? Yes, there is. / No, there isn’t.
Are there any students in the classroom ? Yes, there are. / No, there aren’t.
特殊疑问句:What’s on the desk ? There’s a book. / There’re some books.
*** 请注意不可数名词, 表示单数概念,用 is 。
There is some water in the bottle.
There isn’t any water in the bottle.
Is there any water in the bottle? Yes, there is. / No, there isn’t.
What’s in the bottle ? There’s some water.
How many classrooms are there in our school ? There are 24 classrooms.
( 注意:how many 的后面一定要加名词复数哦 )
3. some 与 any 的用法:
(1) 一般情况下,some 用于肯定句,any 用于否定句和疑问句。
如: I have some apples, but I don’t have any oranges.
There are some students in the playground.
There aren’t any students in the playground .
Is there any water in the bottle ? No, there isn’t.
(2) 但在说话人希望得到对方肯定回答时,疑问句中也用some 。
如:Would you like some coffee ? Can you give me some water ?
4. , 表示:太。。。 如:too cold 太冷;too hot 太热; too thirsty 太渴了; too soft太柔软 ;
too hard 太硬 ; too old 太老 ; too tired 太累 ; too high 太高
, 表示:如此,这么。。。 如:so heavy 如此重; so tired 这么累 ; so lovely 如此可爱 ,表示:看起来。。。 , 如:look great 看起来很棒; look nice看起来很漂亮 ;
look sad 看起来很伤心
1
5. 序数词: first 第一 ; second 第二 ; third 第三 ,在用的时候前面要加“the“。 如:
the first teacher ; on the second floor ; on the third floor.
6. time for +名词; time to + 动词;如:time for school ; time to go to school 该上学了
time for bed ; time to go to bed 该睡觉了
time for home ; time to go home 该回家了
7. have / has 的用法:第三人称单数用:has ; 其他人称(第一、第二和复数人称)用:have . 如:I have a book. You have two animal friends. They have four legs. The teachers have many books. He has long hair. She has a big face. It has a short tail. My father has a new car.
*** 注意:在否定句或疑问句中,虽然主语是第三人称单数,但如果前面出现了助动词“does”,后面就
要用have 。 如:He doesn’t have a brother. Does he have a brother ? What does he have ?
8. have 句型否定句的两种形式: They don’t have any legs or arms = They have no legs or arms.
9. can 的句型中,动词都用原形。如:I can jump. You can run. They can sing. He can talk .
10. 喜欢做某事:like + 动名词 ( 动词+ ing ) 如:like playing football ; like reading ; like watching films ;
11. 动词+ing 变成动名词的方法:
(1) 直接加 ing ,如:play --- playing ; draw --- drawing ; read --- reading ; sing --- singing 等等。
(2) 不发音的e 结尾的,去e 加 ing ,如:dance --- dancing ; live --- living ; ride --- riding ; write ---
writing ; come--- coming , skate--- skating , 等等。
(3) 重点闭音节结尾只有一个辅音字母的,双写结尾字母,再加ing , 如:swim--- swimming ; run ---
running ; sit --- sitting ; 等等。
12. 平时读课文时,请注意一些介词的用法,如: in , on , to , for , with , of , at , 等。
13. 一般现在时:描述经常性发生或常规性的事情。提示词:always ; usually ; often ; sometimes ; every day ,
等等。
构成:当主语是“第三人称单数“时,动词要变化,其他人称(第一、第二和复数人称),动词用原形。各种句式如下:
主语是第一、第二或复数人称时:( 动词用原形)
I ( We / You / They ) often go to school on foot.
I ( We / You / They ) don’t often go to school on foot.
Do you ( they ) often go to school on foot ? Yes, I (we, they ) do. / No, I ( we , they ) don’t.
How do you ( they ) often go to school ? I ( We , They ) often go to school on foot.
主语是:第三人称单数。(动词要加s 或es 等)
He / She goes to school on foot.
He / She doesn’t go to school on foot.
Does he / she go to school on foot?
How does he / she go to school ?
*** 注意:在否定句或疑问句中,由于前面出现了助动词: does , 后面的动词就恢复原形了。
2
如:My mother doesn’t go shopping at weekends. Does her sister have a doll ? What does he like ?
*** “三单“变化方法:
(1) 动词后加:s , 如:help--- helps ; make--- makes ; take--- takes ;
(2) 以s , x , sh , ch , o 结尾的动词一般加:es , 如:do --- does ; go --- goes ; teach--- teaches ; watch
--- watches ; wash --- washes ; 等等。
(3) 以辅音字母加y 结尾的动词,去y 加:ies , 如:study --- studies ; fly --- flies ; cry --- cries 等
等。
play the + 乐器, 如: play the piano ; play the guitar 等等; play + 球类 ,如:play football , play basketball ;
all ; both 的用法:both 表示两者“都”,all 表示三者或更多人“都。如:
My brother and I are both students.
All of my classmates are in the playground now.
每个单元的 Sound time 字母的发音和例词都要读熟哦。
3 14. 15.16.
第二篇:高一化学期末复习章节知识点归纳1-4章
《高一化学期末复习章节知识点归纳》之一
第一章 从实验学化学
一、化学实验基本方法
1.化学实验安全
⑴遵守实验室规则 ⑵了解安全措施(化学药品存放和使用、着火和烫伤处理、化学灼伤的处理等等)⑶掌握正确的操作方法(仪器和药品的使用、加热方法、气体收集方法)⑷熟悉污染物和废弃物的处理方法
①做有毒气体的实验时,应在通风厨中进行,并注意对尾气进行适当处理(吸收或点燃等)。进行易燃易爆气体的实验时应注意验纯,尾气应燃烧掉或作适当处理。
②浓酸沾在皮肤上,用水冲净然后用稀NaHCO3溶液淋洗,然后请医生处理。
③浓碱撒在实验台上,先用稀醋酸中和,然后用水冲擦干净。浓碱沾在皮肤上,宜先用大量水冲洗,再涂上硼酸溶液。浓碱溅在眼中,用水洗净后再用硼酸溶液淋洗。
④钠、磷等失火宜用沙土扑盖。
⑤酒精及其他易燃有机物小面积失火,应迅速用湿抹布扑盖。
⑥可以直接加热的: 、 、 、燃烧匙
⑦用石棉网加热的:烧杯、烧瓶、锥形瓶
⑧玻璃棒的作用:a. 搅拌加速溶解;b. 引流防止溅出;c. 防止局部过热,使小液滴飞溅。
2.认识一些常用危险化学品的标志
3.混合物的分离和提纯
⑴过滤 ⑵蒸发 ⑶蒸馏 ⑷萃取 ⑸分液
过滤、蒸发、蒸馏、萃取(萃取剂的选择原则等)、分液的操作步骤及注意事项
实验1-3 蒸馏操作(装置以老师补充的为准)
仪器:,,,石棉网,铁架台,酒精灯,牛角管,锥形瓶。
注意事项:①温度计的处。②蒸馏烧瓶中放少量 是为了防止液体 。③冷凝管中冷却水从 进, 出。 ④先打开冷凝水,再加热。⑤溶液不可蒸干。
实验1-4 萃取操作
原理: 用一种溶把溶质从它与另一溶剂所组成的溶液里提取出来。
仪器: , 烧杯
步骤:①检验分液漏斗是否 。
②量取10mL碘的饱和溶液倒入分液漏斗, 注入4mLCCl4,盖好瓶塞。
③用右手压住分液漏斗口部, 左手握住活塞部分, 把分液漏斗倒转过来用力振荡。 ④将分液漏斗放在铁架台上,静置。
⑤待液体分层后, 将分液漏斗上的玻璃塞打开,从
1
注意事项: a.检验分液漏斗是否漏水; b.萃取剂: 与原溶剂互不相溶,不能反应,溶质在萃取剂中溶解度大于在原溶剂中的溶解度; c.上层溶液从上口倒出,下层溶液从下口放出。
4.化学方法除杂的原则:“
除去泥沙后的粗盐提纯的步骤:一定注意加入试剂的先后顺序: 一定加在BaCl2后面;HCl最后加。
检验SO42-:先加入HCl,若没有白色沉淀,再加入BaCl2,有白色沉淀证明有SO42-。加入盐酸的目的是排除Ag+、SO32-、CO32-的干扰。
二、化学计算在实验中的应用
1.物质的量的单位——摩尔
⑴物质的量是一个物理量,表示含有一定数目粒子的集合体,它的符号是n 。粒子可以是离子、分子、原子或电子、质子、中子等。
⑵12g12C所含碳原子数,叫做阿伏加德罗常数,是个物理量,符号为NA ,单位为 。 ⑶含有阿伏加德罗常数个粒子的任何粒子集体称为1摩尔。摩尔简称摩,符号为mol。 ⑷物质的量与微粒数之间的关系可以表示为:n= 。
⑸1mol任何粒子或物质的质量是以克为单位,数值上等于该粒子 或 M,常用单位为g/mol。
⑹物质的量、质量和摩尔质量之间的关系:n=
2.气体摩尔体积
⑴物质体积的大小取决于粒子 、粒子的 和粒子之间的 等三要素。 ⑵单位物质的量的气体所占的体积叫做气体摩尔体积,符号为Vm,常用单位为 。
⑶在标准状况的条件下,气体摩尔体积为22.4L/mol 。
⑷物质的量、气体体积和气体摩尔体积的关系:n=
⑸阿伏加德罗理论:在相同温度和压强下,相同体积的任何气体都含有相同数目的粒子。 推论之一:T、P相同,V1/V23.物质的量在化学实验中的应用
⑴单位体积溶液里所含溶质B的物质的量,称为B的物质的量浓度,符号为cB,常用单位为 。
⑵物质的量浓度可表示为:cB⑶配制一定物质的量浓度的溶液
所需的主要仪器: 或 、 (按需要选择合适的容量瓶)、烧杯、玻棒、胶头滴管。
配制溶液的主要操作步骤:A.检查容量瓶是否漏水;B.配制溶液 ①计算;② ;③溶解;④转移;⑤ ;⑥定容;⑦ ;⑧装瓶;⑨贴标签。
注意事项:a.选用与欲配制溶液体积相同的容量瓶。 b.使用前必须检查是否漏水。 c.不能在容量瓶内直接溶解。 d.溶解完的溶液等冷却至室温时再转移。 e.定容时,当 2
液面离刻度线1―2cm时改用滴管,以平视法观察加水至液面 为止。 f.答题时,需填容量瓶时,容量瓶一定要说体积,如250mL容量瓶。计算时,需要用480mL 溶液,则要用500mL容量瓶来配制,计算时要用哪个数据? (480mL还是500mL)。 ⑷配制物质的量浓度的误差分析:称量、溶解、转移、洗涤、定容等过程都有可能产生误差。
⑸浓溶液配制稀溶液,常用的关系式:
4.质量、物质的量、粒子数、标准状况下气体的体积、溶质的物质的量浓度等相互转化关系:n=N/NA=m/M=V/Vm=cBV
在一定体积的一种溶液中:离子的物质的量浓度=溶液的物质的量浓度×所含离子的个数。 补充:①标准状况下,气体摩尔质量(或相对分子质量):M=
②物质的量浓度与质量分数的关系:c=
《高一化学期末复习章节知识点归纳》之二
第二章 化学物质及其变化
一、物质的分类
1.简单分类法及应用
⑴分类的方法: 分类法、 分类法
⑵化学反应的分类:
①根据反应物和生成物的类别以及反应前后物质种类的多少:分解反应、化合反应、复分解反应和置换反应。②根据反应中是否有离子参加: 和非离子反应。③根据反应中是否有电子转移: 和非氧化还原反应。
2.分散系及其分类
⑴把一种(或多种)物质分散在另一种(或多种)物质中所得到的体系,叫做分散系。被分散的物质,称作分散质;容纳分散质的作用,称作分散剂。按照分散质或分散剂所处的状态,它们之间可以有9种组合方式。
⑵常见的分散系分为溶液、胶体和浊液。溶液中的溶质粒子直径 ,浊液中的粒子直径 ,胶体粒子,其大小 。通常浊液不能通过 孔隙,只有溶液可以透过 孔隙。
⑶当光束通过胶体时可以看到光亮的通路,这种现象叫做丁达尔效应。利用丁达尔效应区分 和 的一种常用物理方法。
⑷胶体有较强的吸附作用,胶体离子由于吸附而带电荷,胶体介稳定。胶体的应用有: 明矾净水、石膏或盐卤做豆腐、制涂料、墨水、静电除尘、三角洲的形成、制纳米材料等。
二、离子反应
1.在叫做电解质,在水溶液里或熔融状态下不能够导电的化合物叫做非电解质。常见的酸、碱、盐、绝大多数金属氧化物、水等都属于电解质。绝多数的非金属氧化物、绝大多数有机物属于非电解质。
2.电解质溶于水后自动离解为 3
离子导电,溶液中离子浓度越大,溶液导电能力越强。电离不需要通电,电离方程式书写不需要写条件(有同学与“电解”混淆)。
3.电离时生成的阳离子是氢离子的化合物叫做酸,电离时生成的阴离子全部是氢氧根离子的化合物叫做碱,电离时生成金属阳离子(或NH4+离子)和酸根离子的化合物叫做盐。
4.电解质在溶液中进行的反应,称作离子反应。
5.用实际参加反应的离子符号来表示反应的式子叫做离子方程式,离子方程式的书写步骤:写、拆、删、查。离子方程式正误的判断:反应要符合事实、质量守恒(原子个数)、电荷守恒、拆还是不拆(最关键)等。
不能拆写成离子符号:难溶的物质、气体(或易挥发物质)、难电离的物质(如水)、单质、氧化物。
可以拆写成离子符号:易溶于水、易电离的物质(易溶酸、碱、盐)
6.离子共存问题
所谓离子在同一溶液中能大量共存,就是指离子之间不发生任何反应;若离子之间能发生反应,则不能大量共存。
判断离子能否大量共存的依据:生成沉淀、放出气体、生成水、结合为弱酸(如碳酸、醋酸等)、结合为弱碱(如氨水NH3·H2O)。
a.结合生成难溶物质的离子不能大量共存:如Ba2+和SO42-、Ag+和Cl-、Ca2+和CO32-、Mg2+和OH-等。
b.结合生成气体或易挥发性物质的离子不能大量共存:如H+和CO32-,HCO3-,
SO32-,OH-和NH4+等。
c.结合生成难电离物质(水)的离子不能大量共存:如H+和OH-、CH3COO-,OH-和HCO3-等。
注意:题干中的条件:如无色溶液应排除有色离子:Fe2+、Fe3+、Cu2+、MnO4-等离子,酸性(或碱性)则应考虑所给离子组外,还有大量的H+(或OH-)。
三、氧化还原反应
1.定义:有电子转移(或者化合价升降)的反应。
2.本质:电子转移(包括电子的得失和偏移)。
3.特征:化合价的升降(判断氧化还原反应的依据)
4.关系:
还原剂(具有还原性)——失电子——化合价升高——被氧化——氧化产物
口诀:升价失电还原剂,氧化反应要牢记。
四种基本反应类型和氧化还原
反应关系:(如右图)
5.常用氧化剂和还原剂
氧化剂:氧气、氯气、浓硫酸、
硝酸、高锰酸钾、三氯化铁等。
还原剂:金属单质、碳、氢气、

4
一氧化碳等
6.注意:a.常见元素的化合价一定要记住。b.在同一氧化还原反应中,
氧化剂得电子总数=还原剂失电子总数;氧化剂化合价降低总数=还原剂化合价升高总数。
《高一化学期末复习章节知识点归纳》之三
第三章 金属及其化合物
一、金属的化学性质
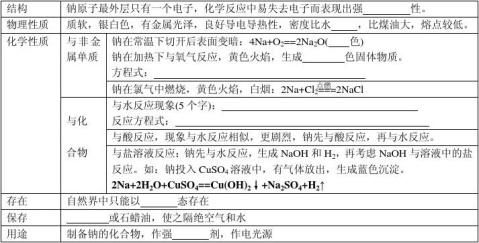
2.铝
⑴物理性质:银白色,较软的固体,导电、导热,延展性
⑵化学性质:Al—3e-==Al3+ 点燃 点燃 ①与非金属:4Al+3O2====2Al2O3,2Al+3Cl2===2AlCl3
②与酸:如与硫酸反应(方程式):。 常温常压下,铝遇浓硫酸或浓硝酸会发生钝化,所以可用铝制容器盛装浓硫酸或浓硝酸。
③与强碱:2Al+2NaOH+2H2O==2NaAlO2(偏铝酸钠)+3H2↑ 离子方程式为:
大多数金属不与碱反应,但铝却可以,铝是两性单质。
3.铁
⑴物理性质:银白色光泽,密度大,熔沸点高,延展性,导电导热性较好,能被磁铁吸引。铁在地壳中的含量仅次于氧、硅、铝,排第四。
⑵化学性质:注意:铁表面不能有氧化膜 点燃 点燃 △ ①与非金属:Fe+S==FeS,3Fe+2O2===Fe3O4,2Fe+3Cl2===2FeCl3
②与水蒸气反应:
③与酸(非氧化性酸):Fe+2H+==Fe2++H2↑
与氧化性酸,如硝酸、浓硫酸,会被氧化成三价铁。
5
④与盐:如CuCl2、CuSO4等,Fe+Cu2+==Fe2++Cu
4.注意:
⑴金属氧化物,活泼金属在空气中易与氧气反应,表面生成一层氧化物。有的氧化膜疏松,不能保护内层金属,如氧化钠;有的氧化膜致密,可以保护内层金属不被继续氧化,如氧化铝等。
⑵金属元素在自然界中多以化合态存在,只有极少数不活泼的金属如金等以游离态存在。
二、几种重要的金属化合物
1.氧化物
自然界中的金属有很多是以含金属氧化物的矿物的形式存在的,如铝土矿(主要成分是氧化铝)和赤铁矿(主要成分是氧化铁)等。
⑴多数金属氧化物不溶于水,只有少数金属氧化物能与水反应,生成可溶或微溶的碱。 例如:生石灰与水反应CaO + H2O = Ca(OH)2
⑵多数不溶于水的金属氧化物可与酸反应,生成盐和水
例如:氧化镁、氧化铁、氧化铜分别与盐酸反应
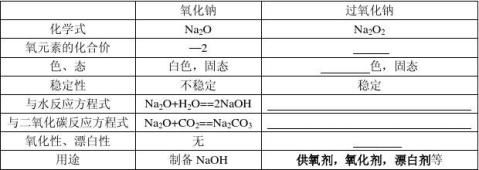
⑷氧化铝的两性:①跟盐酸反应方程式:
离子方程式:
②跟氢氧化钠溶液反应反应方程式:
离子方程式: ⑸金属氧化物除可作为冶炼金属的原料外,还有着广泛的用途。氧化铁(俗称铁红)是一种 色的粉末,制造红色油漆和涂料;氧化铝白色难熔,耐火材料;制造耐火坩埚和耐火管;氧化铜呈黑色,可制造铜盐。
2.氢氧化物
⑴铁的氢氧化物
①氢氧化亚铁制取:硫酸亚铁溶液与氢氧化钠溶液反应:
离子方程式:
性质:a.受分解跟酸反应
b.易氧化生成氢氧化铁:现象:
反应方程式:
6
②氢氧化铁制取:离子方程式:
a.跟酸反应,离子方程式:
b.受分解,化学方程式: ⑵氢氧化铝 ①制取:硫酸铝溶液与氨水反应(注意为什么用氨水?)
反应方程式:
离子反应方程式: ②性质:a.不溶于水,但能凝聚水中的悬浮物,并能吸附色素。
b.既能跟酸反应,也能跟强碱反应,是两性氢氧化物。
离子反应方程式:
c.是医用抗酸药之一。
d.加热能分解,反应方程式:
3.盐
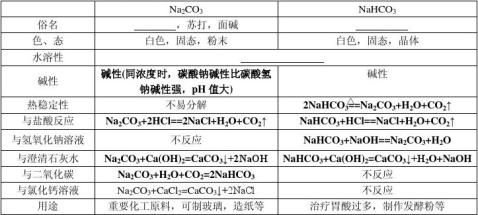
⑵明矾:十二水合硫酸铝钾,可用作净水剂
⑶三价铁的氧化性
①Fe2+和Fe3+离子的检验: a.溶液是浅绿色的
Fe b.与KSCN溶液作用不显红色,再滴氯水则变色 c.加NaOH溶液现象: 红褐色 a.与无色KSCN溶液作用显
Fe3+ b.溶液显黄色或棕黄色
c.加入NaOH溶液产生红褐色沉淀
②注意:三价铁跟还原剂反应可变成二价铁,二价铁跟强氧化剂反应可变成三价铁 ⑷铜盐溶液有毒,可使蛋白质变性。
7
⑸焰色反应:很多金属或它们的化合物在灼烧时都会使火焰呈特殊的颜色,这叫做焰色反应,钠焰色反应黄色,钾焰色反应透过蓝色钴玻璃观察是紫色。
三、用途广泛的金属材料
1.常见合金的重要应用
合金具有许多优良的物理、化学或机械性能,许多方面不同于各成分金属。
⑴铜合金:青铜、黄铜、白铜
⑵铁与钢的区别:a.含碳量在 的铁合金叫做生铁。
b.含碳量在 的铁合金叫做钢。
⑶钢:碳素钢、合金钢
2.正确选用金属材料
主要用途、外观、物理性质、化学性质、价格、加工难度、日常维护、对环境的影响。
《高一化学期末复习章节知识点归纳》之四
第四章 非金属及其化合物
一、无机非金属材料的主角——硅
硅在地壳中含量仅次于氧,主要形成四价的化合物,原子结构示意图: 。
1.二氧化硅和硅酸
硅是一种亲氧元素,在地壳中主要以熔点很高的氧化物及硅酸盐的形式存在。
⑴二氧化硅
地球上存在的天然二氧化硅称为硅石,形态有结晶形和无定形两种。
注意:二氧化硅晶体内是没有单个分子存在的。
石英晶体是结晶的二氧化硅,无色透明的石英晶体是水晶,具有彩色环带状或层状的称为玛瑙。沙子中含有小粒的石英晶体。
①物理性质:不溶于水,熔点高
②化学性质(很不活泼)
酸性氧化物,是H2SiO3的酸酐,但不溶于水。
SiO2+CaO===CaSiO3
SiO2+2NaOH==Na2SiO3+H2O 离子方程式: SiO2+4HF==SiF4↑+2H2O (氢氟酸可以雕刻玻璃)
⑵常用的硅酸盐是硅酸钠,其水溶液俗称水玻璃,可用作肥皂填料、木材防火剂及黏胶剂。 ⑶硅酸盐产品——陶瓷、玻璃、水泥(最重要的无机非金属材料),水泥的原料是黏土和石灰石;玻璃的原料是 、 和 ,成份是Na2SiO3·CaSiO3·6SiO2;陶瓷的原料是黏土。注意:三大传统硅酸盐产品的制备原料中,只有陶瓷没有用到石灰石。 ⑷用氧化物形式表示硅酸盐的方法:活泼金属氧化物·较活泼金属氧化物·二氧化硅·水。如:滑石Mg3(Si4O10)(OH)2可表示为3MgO·4SiO2·H2O
⑸碳化硅俗称金刚砂,硬度很大,可以作砂轮的磨料;硅钢,导磁性,制变压器铁芯;硅橡胶,耐高温又耐低温;人工制造分子筛,吸附剂和催化剂。
2.硅
单质硅有晶体和无定形两种
⑴物理性质:带有金属光泽的灰黑色固体,熔点高、硬度大、有脆性。
⑵化学性质:在常温下化学性质不活泼(只与F2、HF、NaOH反应)。加热能与O2等反应。 8
⑶用途:良好的半导体材料、制成光电池。
二、富集在海水中的元素——氯
氯原子很容易得到一个电子形成氯离子,表现为典型的非金属性。
1.氯气
⑴物理性质:氯气在通常情况下呈 色,是一种有强烈刺激性气味的有毒气体,易液化变成液氯。能溶于水,氯气水溶液称为氯水(新制氯水含分子和离子:
⑵化学性质
①能与大多数金属反应:例如,与钠、铁、铜等金属反应。方程式:
与铁: ,与铜:
②能与大多数非金属反应:例如,与氢气等反应,方程式:
③能与水反应:Cl2+H2O==HCl+HClO 离子方程式: 注意:a.次氯酸具有强氧化性,能杀死水中的病菌,起消毒作用,也具有漂白作用。b.氯水因含有次氯酸具有漂白作用。c.次氯酸是很弱的酸(比碳酸的酸性还弱),不稳定,见光易分解。方程式: ,d.氯气本身是没有漂白作用的,只有氯气遇水生成次氯酸才有漂白作用。
④跟强碱溶液反应:氯气跟氢氧化钠溶液反应。
注意:a.以次氯酸钠为有效成分的称为,以次氯酸钙为有效成分的称为 ,以次氯酸钙为主要成分的称为漂粉精。b.漂白液、漂白粉和漂白精既可作漂白棉、麻、纸张的漂白剂,又可用作游泳池及环境的消毒剂。
2.氯离子的检验
试剂:硝酸银溶液 + 稀硝酸 现象:有白色沉淀,说明含有氯离子

空气质量报告的各项指标中,肯定有二氧化硫和二氧化氮的指数。
1.二氧化硫
⑴硫(俗称硫黄)的物理性质(黄色粉末,难溶于水,微溶于酒精,易溶于CS2),化学性质(跟氧气反应、跟氢气反应、跟金属反应)
⑵SO2的物理性质(无色、有刺激性气味、有毒、气体、密度比空气的大、容易液化、易溶于水)
⑶化学性质
①跟水反应生成亚硫酸,方程式: (这反应是可逆反应)。 注意:二氧化硫是酸性氧化物,所以具有酸性氧化物的通性(跟水反应、与强溶液反应、跟碱性氧化物反应)。
②具有漂白作用。注意:与过氧化钠、次氯酸、活性炭的漂白作用进行对比。
2.二氧化氮和一氧化氮
9
⑴氮气的性质
通常情况下很稳定,但在高温或放电条件下氮气能与氧气反应,
方程式: (无色、不溶于水的气体,有毒)
⑵一氧化氮的性质
无色的气体,难溶于水,在空气中很容易与氧气反应,
方程式: (红棕色、刺激性气味、有毒)
⑶二氧化氮的性质
红棕色、有刺激性气味的有毒气体,密度比空气的大,易液化,易溶于水。
跟水反应,工业上利用这原理制取硝酸,方程式: ⑷火箭的推动力的来源:偏二甲肼(C2H8N2)+四氧化二氮(N2O4)
3.二氧化硫和二氧化硫对大气的污染
⑴含硫或硫化合物的燃烧会生成二氧化硫;汽车尾气含有NO的原因是内燃机内高温下空气中的氮气参与反应生成的。
⑵正常雨水pH为5.6,酸雨的pH<5.6 。
四、硫酸、硝酸和氨
1.硫酸和硝酸的氧化性
⑴硫酸的性质(稀硫酸、浓硫酸)
①稀硫酸具有酸的通性
②浓硫酸的特性
吸水性:将物质中含有的水分子夺去(可用作气体的干燥剂);
脱水性:将别的物质中的H、O按原子个数比2:1脱出生成水;
强氧化性:a.跟铜反应的方程式:
(注意与金属反应产生的气体是什么?)
b.跟炭反应的方程式:
c.冷的浓硫酸使Fe、Al等金属表面生成一层致密的氧化物薄膜而钝化。
⑵硝酸的性质
①具有酸的通性
②强氧化性
稀硝酸与铜反应的方程式:
离子方程式:
浓硝酸与铜反应的方程式:
离子方程式: ③王水:浓硝酸和浓盐酸体积比=1:3,可以溶解Pt、Au等难溶于硝酸的金属。
2.氨
⑴氨气的物理性质
没有颜色、有刺激性气味,极易溶于水(水溶液称为氨水),易液化(常用作制冷剂)
⑵化学性质
①与水反应:方程式:NH3+H2O = NH3·H2O = NH4++OH-,所以氨水溶液显碱性
注意:氨水的成分:NH3、H2O、NH3·H2O、NH4+、OH-、H+。
②与酸反应:氨气与氯化氢反应,NH3+HCl==NH4Cl,现象:产生白烟
⑶制法
10
氯化铵与消石灰加热,方程式:
用向下排空气法来收集氨气(注意:收集试管口有一团棉花,防止空气对流,减缓排气速度,收集较纯净氨气)。验证氨气是否收集满:用湿润的红色石蕊试纸靠近试管口,若试纸变蓝说明收集满。 干燥: (CaO和NaOH的混合物)
3.铵盐的性质 △ △ 易溶于水,受热易分解(NH4Cl===NH3↑+HCl↑,NH4HCO3===NH3↑+CO2↑+H2O),与碱反应放出氨气(例如,NH4NO3+NaOH===NH3↑+H2O+NaCl)
NH4+的检验:NH4++OH-===NH3↑+H2O。操作:向溶液中加入氢氧化钠溶液并加热,用湿润的红色石蕊试纸靠近试管口,观察是否变蓝,如若变蓝则说明有铵根离子的存在。
4.氮在自然界的循环
⑴存在:单质化合物均有。⑵氮的固定:把氮单质转化为氮的化合物,叫做氮的固定。
11
