医用骨科牵引床 临床评价报告
目 录
1、产品简介
2、预期用途
3、产品分类
4、临床资料评估
5、临床对比分析
6、临床资料评估结论
7、风险分析
8、相关文件
9、附件
一次性使用内窥镜手术冲吸导管临床评价报告
1、 产品简介
1.1本公司生产的一次性使用内窥镜手术冲吸导管是依据国食药监械【2009】835号《医疗器械生产质量管理规范无菌医疗器械实施细则》及YY 0489-2004 《 一次性使用无菌引流导管及辅助器械》,并结合国内外产品的优点而开发的产品。目前该产品已通过江苏省医疗器械检验所检测。
1.2一次性使用内窥镜手术冲吸导管主要用于主要用于内窥镜手术。
1.3一次性使用内窥镜手术冲吸导管由穿刺头、接头、截流夹、导管、阀体、阀门和不锈钢接管组成
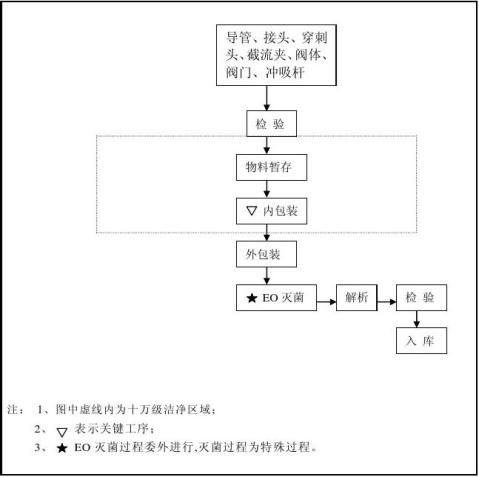
对以上关键过程和特殊过程,公司设置了质量控制点,做好各工序的检验记录进行控制。
1.5 产品在使用前已经灭菌,灭菌有效期为两年。
2、 预期用途
供临床冲洗引流用。
3、 产品分类
根据国家食品药品监督管理局《医疗器械分类管理目录》规定,一次性使用内窥镜手术冲吸导管属Ⅱ类医疗器械。
4、 临床资料评估
临床文献一:
a) 临床文献资料来源
因本公司生产的内窥镜手术冲吸导管可免于临床试验,所以临床资料是通过文献途径获得。临床文献资料一来源于发表在《骨科》20xx年第3期的临床信息。
b) 文献资料提供的临床信息
骨科 20xx年第3期《便携式创伤脉冲冲洗装置清创效果的实验研究》。
目的:评估便携式创伤脉冲冲洗装置对颗粒物污染和细菌污染的清除率。方法建立兔肢体污染外伤动物模型(颗粒污染物污染及细菌污染物污染),用便携式创伤脉冲冲洗装置法(低频、高频)、橡皮球冲洗法分别冲洗伤口,然后计算颗粒污物清除率,并于受伤后和冲洗后即刻取局部组织细菌定量,计算伤口细菌残留数。
结果:高频组和低频组污染物清除率分别为92.50%和80.67%,橡皮球冲洗组为39.67%。在清除伤口表面颗粒污物方面,低频、高频脉冲冲洗法与橡皮球法相比有统计学意义(P0.01);在减少伤口表面细菌数量方面,低频、高频脉冲冲洗法与橡皮球法相比有统计学意义(P0.01)。另外,携式创伤脉冲冲洗装置并不增加冲洗创口处的损伤。
结论:便携式创伤脉冲冲洗装置在清除颗粒污染物和细菌污染方面优于传统冲洗方法且操作简单,携带方便,值得进一步临床推广。
临床文献二:
a) 临床文献资料来源
因本公司生产的内窥镜手术冲吸导管可免于临床试验,所以临床资料是通过文献途径获得。临床文献资料一来源于发表在《中外医疗》20xx年第19期的临床信息。
c) 文献资料提供的临床信息
中外医疗20xx年第19期《一次性电动脉冲冲洗吸引器的临床对照研究》。
目的:研究一次性电动脉冲冲洗器在外伤开放性伤口中的使用效果。
方法:随机选取开放性伤口需要进行外科清创术治疗的患者进行一次性电脉冲冲洗吸引器(试验组)冲洗和常规冲洗(对照组),评价术后2周创面炎症反应情况和冲洗前、后取伤口分泌物的菌落计数情况,以及安全性指标。结果 2组渗液改变程度比较,差异有统计学意义。完成选择观察阶段和试验观察阶段的全部病例,均没发现任何安全性问题。
结论:一次性电动脉冲冲洗吸引器可以有效的清除残留在创伤部位的组织碎屑和外来沾染物碎屑,促进伤口愈合。并且使用一次性电脉冲冲洗吸引器和使用常规冲洗方法的安全性相同。
5、 临床对比分析
一次性使用内窥镜手术冲吸导管其市场销售和用户使用情况良好,产品的安全性和可靠性均符合相关的国家、行业技术质量标准和法律法规要求,已是较为成熟、使用广泛的临床外科医疗器械产品。
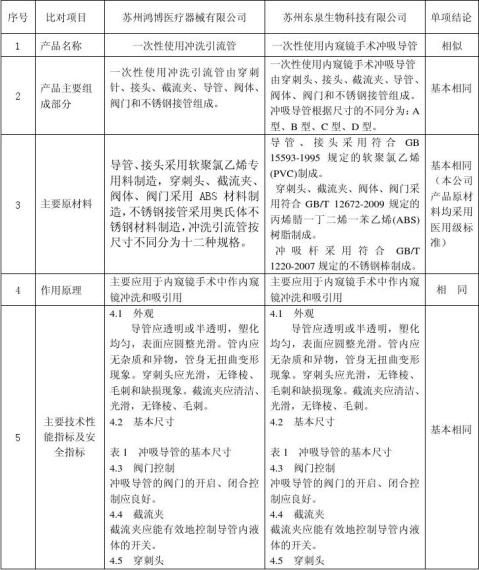
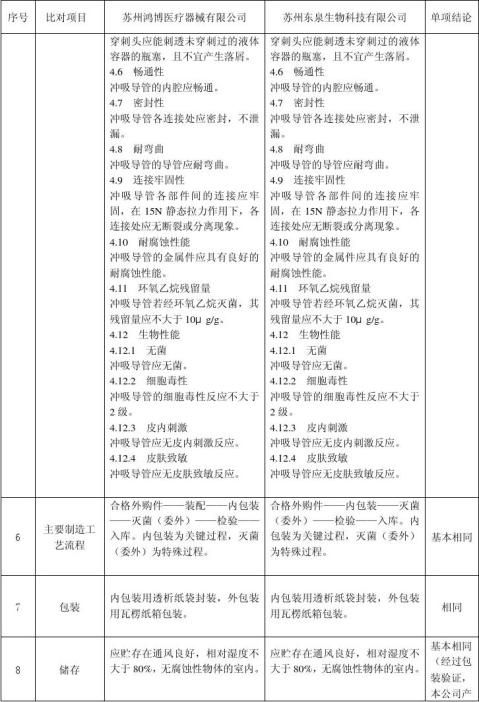
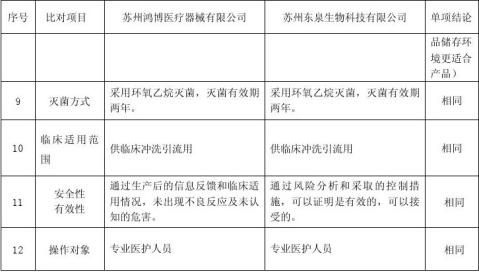
此次苏州东泉生物科技有限公司申请注册的一次性使用内窥镜手术冲吸导管是在参照苏州鸿博医疗器械有限公司生产的一次性使用冲洗引流管基础上,进行研制而成,该产品作用原理、性能结构和安全性方面与苏州鸿博医疗器械有限公司产品基本相同,现将我公司开发研制的一次性使用内窥镜手术冲吸导管与苏州鸿博医疗器械有限公司的一次性使用冲洗引流管在作用原理、性能结构组成及安全性等方面作等同对比如下:
苏州鸿博医疗器械有限公司的一次性使用冲洗引流管 与本公司一次性使用内窥镜手术冲吸导管的
7、 临床资料评估结论
通过以上等同对比,本公司此次申请注册的一次性使用内窥镜手术冲吸导管主要作用机理,结构组成,主要技术性能指标,主要制造工艺流程,包装、储存、灭菌方式、方法,临床适用范围、操作对象和使用中的安全性、有效性等内容与 苏州鸿博医疗器械有限公司生产的一次性使用冲洗引流管基本相似。根据以上的临床资料评估,本公司的一次性使用内窥镜手术冲吸导管产品是安全的、可靠的,可以达到所期望的与 苏州鸿博医疗器械有限公司生产的一次性使用冲洗引流管 产品同样的临床预期用途。本公司此次拟申请注册的一次性使用内窥镜手术冲吸导管与 苏州鸿博医疗器械有限公司生产的一次性使用冲洗引流管 一样,在国家食品药品监督管理局公布的《医疗器械分类目录》中该产品分类号为6866、管理类别为Ⅱ类,符合《江苏省第二类医疗器械注册临床试验豁免目录(2006版)》中准予临床试验豁免产品的原则和条件。故此次注册申请时可免于临床试验。 8、 风险分析
本公司风险分析小组在风险管理报告中,将产品在设计研发,原材料采购、生产、使用过程中可能存在的风险一一作了分析,并对可能存在的风险采取了有效的控制措施,使风险降低到了可接受的范围。 9、 相关文件
① MEDDEV2.7.1 《临床评估指南》
②《一次性使用内窥镜手术冲吸导管风险管理分析报告》 9、附件
9.1苏州鸿博医疗器械有限公司的“一次性使用冲洗引流管”产品注册证复印件 苏食药监械(准)字2010第2660372号;
9.2骨科 20xx年第3期《便携式创伤脉冲冲洗装置清创效果的实验研究》。 9.3中外医疗20xx年第19期《一次性电动脉冲冲洗吸引器的临床对照研究》
第二篇:MEDDEV 2.7.1 ver.3 临床评价报告样本(中文)
临床评价报告
数字X射线摄影系统: Xxxx 系列
编制:
批准:
1. 器械概述
产品名称:
产品型号:
制造商:
2. 器械及预期用途描述
2.1 预期用途: 数字X射线摄影系统,用于生成人体解剖组织的放射线图像。设计本系统的目的是在所有一般用途的诊断程序中替代放射线胶片/ 屏幕系统。本设备不用于乳腺X 射线成像应用。
2.2 器械描述: 按医用电气设备的安全分类属于Ⅰ类B型间歇加载连续运行固定式设备,诊断患者时人体与摄影床和探测器部分接触。
本X射线摄影系统功能组成有以下几部分构成。
3. 预期诊断适应症
本设备需要在隔离室内对需要诊断人体解剖组织的放射线图像的患者进行拍摄。不适用于乳腺X 射线成像应用。孕妇及儿童应遵守医师的诊断并了解放射拍片的危害。
4. 临床评价背景及临床资料类型的选择
4.1 产品研发背景:1895年X射线被发现。20世纪10-20年期间开始有常规X射线机在临床上应用 。70年代末开始,数字化技术在X射线机成像系统上不断得到应用。DR(digital radiography) 成像技术是80年代末实现的X射线直接成像技术,由DR所获得的图像,其每一个像元都来自于相应的数字化探测单元,正是这些排列有致的阵列实现了X射线的数字化成像。
因此,Xxxx系列数字X射线摄影系统的成像技术已经非常成熟,关于数字X射线摄影系统的研究以及评价分析的文献,及器械相关的不良事件等资料应很丰富。足以说明数字X射线摄影系统成像在临床应用中安全性和有效性。
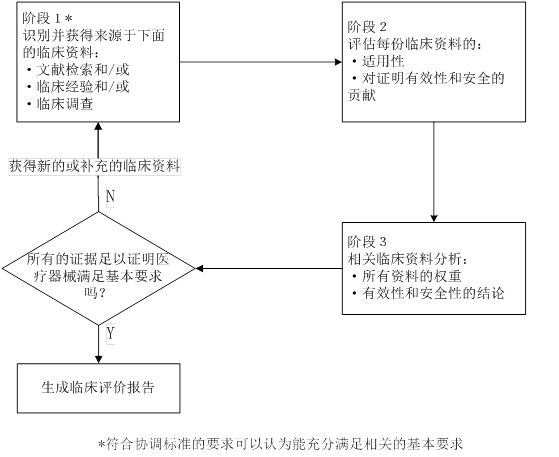
4.2临床评价阶段概述
临床评价阶段按照以下流程图划分并进行临床评价:
基于Xxxx 系列数字X射线成像系统临床评价计划中的拟评价内容及以下检索协议进行文献检索。
4.3文献检索应依据以下协议进行:
a) 文献检索的范围:涵盖数字X射线摄影系统的安全,性能及不良事件等信息的文献。
b) 方法
(i) 文献检索日期:
(ii) 文献检索人员:xxxx
(iii) 检索涵盖的时期范围:近20年关于数字X射线摄影设备的安全、性能及不良事件信息。
(iv) 资料的文献来源:
- 美国FDA网站
- 国家SFDA网站
- 万方数据库
- 不良事件报告资料库(比如 MAUDE, IRIS)
- 本系统的安全及EMC测试报告。
(v) 资料库检索细节:
- 检索关键字:数字X射线摄影系统,性能;数字X射线摄影系统,图像质量;数字X射线摄影系统,不良事件。
注:如以上关键字检索文件效果不好,应以“数字X射线”为主要关键字,并依据临床评价范围对检索到的文献与进行初步筛选。
- 所使用的媒介:电脑网络。
(vi) 资料的选择标准:依据文献的内容与临床评价范围相关性进行初步筛选。
c) 输出
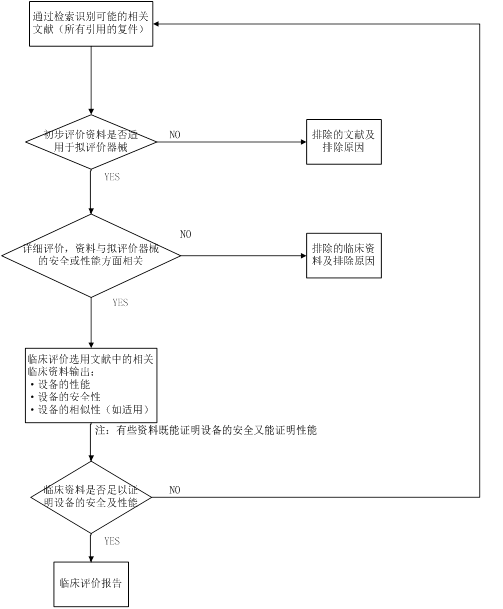
(i) 附上引用检索文献的复件
(ii) 资料选择过程
附上流程图相关表格,以说明引用资料如何被评价并作为临床评价资料
5. 临床资料和评价摘要
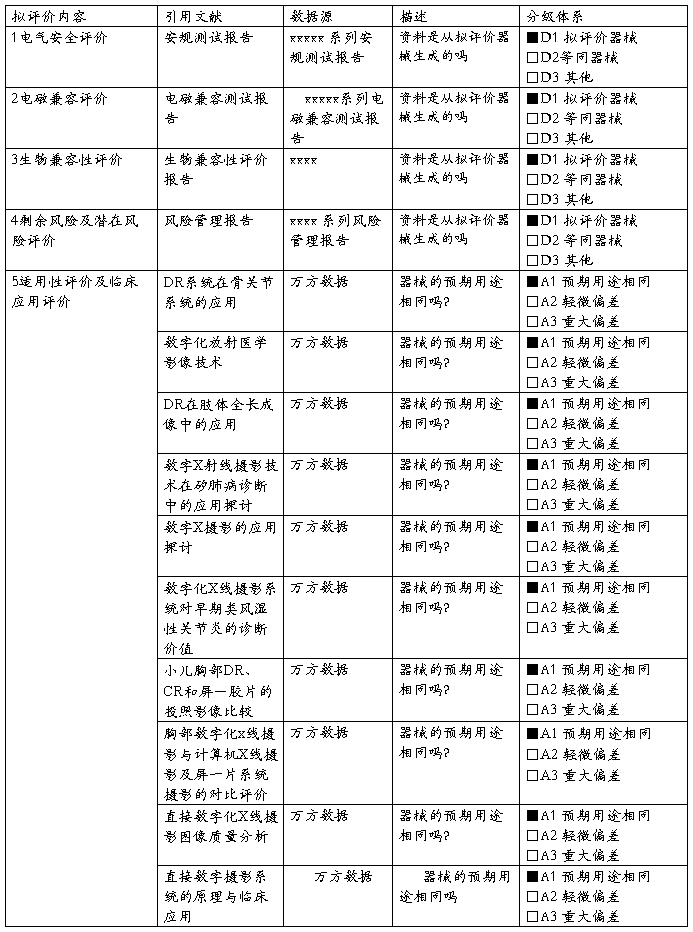
5.1 适用性评价:基于对Xxxx系列数字X射线摄影系拟评价的内容及文献检索协议,通过流程1及表格C1对检索到的文件进行初步适用性识别。
文献检索输出
与拟评价内容相关的检索文献如下:
a) 数字X射线摄影技术在矽肺病诊断中的应用探讨——中国职业医学
b) DR系统在骨关节系统的应用--河北医药文件(标号1002-7386(2009)12-1470-02)
c) 数字化X线摄影系统对早期类风湿性关节炎的诊断价值——山东医药(文件编号1002-266X(2009)27-0067-02)
d) 数字化放射医学影像技术——武警医学
e) 数字X摄像摄影的应用价值--实用发射学杂志
f) 胸部数字化x线摄影与计算机X线摄影及屏一片系统摄影的对比评价——安徽医科大学学报(文件编号1000-1492(2010)04-0565-03)
g) 小儿胸部DR、CR和屏-胶片的投照影像比较——中国辐射卫生(文件编号1004-714X(2008)04-0486-01)
h) 数字X摄影的应用探讨——实用预防医学(文件编号1006-3110(2007)05-1548-02)
i) DR摄影与屏一片系统摄影比较体会——医疗卫生装备
j) DR在肢体全长成像中的应用——中国临床医学影像杂志
(编号:1008-1062(2009)05-0396-01)
k) 直接数字化X线摄影图像质量分析——现代医学
l) 直接数字摄影系统的原理与临床应用——医学设备信息
m) Xxx公司不良事件
器械测试报告
a) Xxxx 系列安规测试报告
b) Xxxx 系列EMC测试报告
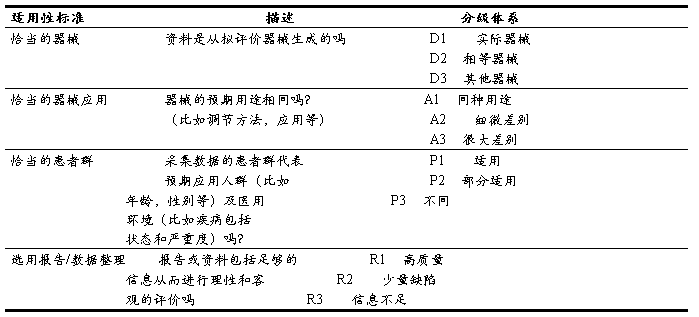
表格C1样本适用性评价标准
流程1
5.2 资料贡献率评价标准:
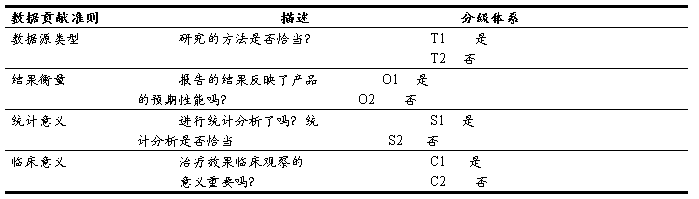
将初步选定的资料依据表格C2对资料进行对证明拟评价内容的贡献率。
6. 资料分析
6.1 资料贡献率评价
6.2 性能
基于上述的临床资料分析,检索的资料分别就DR产品胸部,肺部,及骨骼全长方面的临床应用方面与屏-胶片提供评价性能进行了对比得出了数字X射线身影系统的性能优势及取代传统屏-胶片X射线摄影系统的趋势。
第5条适用性评价及临床应用评价部分的检索文献,显著并一致地证明数字X射线摄影系统的性能识别最能证明器械完整性能,这些资料分别来自医院的临床应用,科学研究及应用分析,因此该文献资料具有统计显著性,临床重要性及结果的一致性。
6.3 安全
Xxxx系列产品通过安规测试,由于本产品没有上市,因此,上市后的安全信息参照等同产品的不良事件分析。
等同器械不良事件:
Xxxx系列与xxxxx的成像原理,系统组成,预期用途都是一样的。因此二者属于等同医疗器械。
不良事件描述:
a)
b)
……
6.4 产品文献和使用说明
以相关标准及法规为基础,并参照了 xxx等公司相关文件的内容及其相关的不良事件,对Xxxx系列产品的使用说明书,标签标识等文件的编制,并在风险管理中加以分析评估。
7. 结论
基础上述的分析及评价,Xxxx 系列X射线摄影系统的安全和性能已经满足了本公司宣称的产品的预期用途。并经过风险评价和临床评价,权衡器械患者的收益时,与器械使用有关的风险是可接受的。
