青 岛 大 学 实 验 报 告
年 月 日
姓 名 系年级 组 别 同组者
科 目有机化学 题 目乙酸乙酯的制备 仪器编号
一.实验目的
1.掌握酯化反应原理以及由乙酸和乙醇制备乙酸乙酯的方法。
2.学会回流反应装置的搭制方法。
3.复习蒸馏、分液漏斗的使用、液体的洗涤与干燥等基本操作。
二.实验原理
本实验用冰醋酸和乙醇为原料,采用乙醇过量、利用浓硫酸的吸水作用使反应顺利进行。除生成乙酸乙酯的主反应外,还有生成乙醚的副反应。
主反应:

副反应:
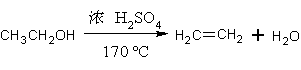
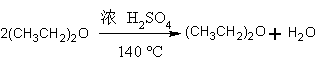
乙酸乙酯的立体结构
三.仪器与试剂
仪器:100ml、50ml圆底烧瓶,冷凝管,温度计,分液漏斗,电热套,维氏分馏柱,接引管,铁架台,胶管等。
试剂:

四.实验装置图
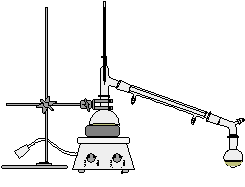
反应装置 蒸馏装置
五.实验步骤流程图
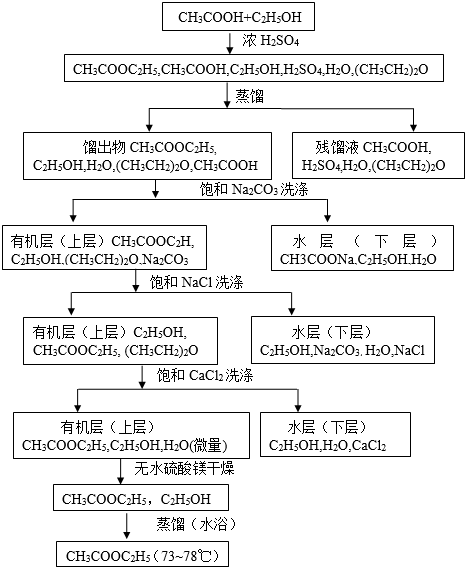
六.实验记录
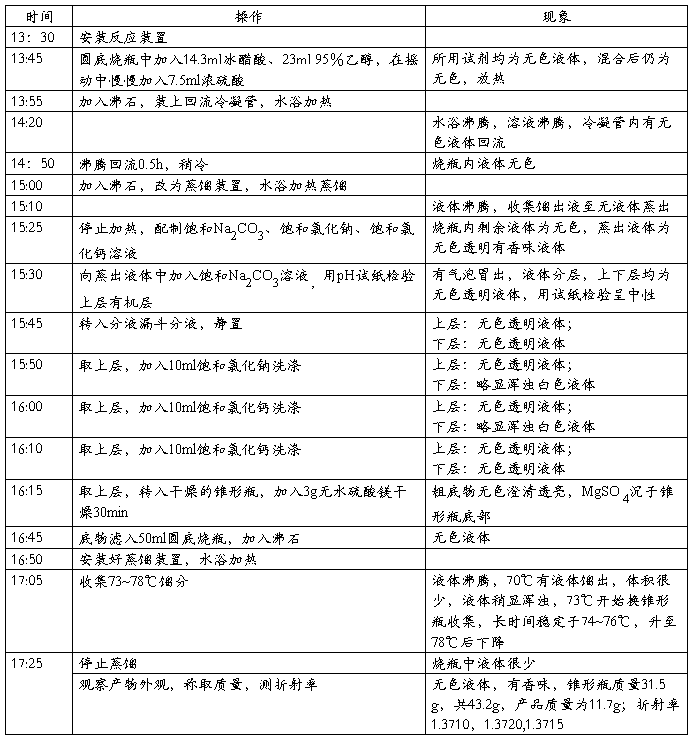
七.数据处理
产率=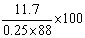 %=53.2%
%=53.2%

八.主要物料及产物的物理常数
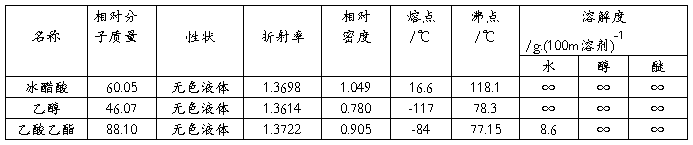
九.讨论
1. 浓硫酸加入时会放热,应在摇动中缓慢加入。
2. 加入饱和NaCO3时,应在摇动后放气,以避免产生CO2而使分液漏斗内压力过大。
3. 若CO32-洗涤不完全,加入CaCl2时会有CaCO3沉淀生成,应加入稀盐酸溶解。
4. 干燥时应塞上瓶塞,并间歇振荡。
5. 蒸馏时,所有仪器均需烘干。
第二篇:乙酸乙酯实验报告
乙酸乙酯皂化反应速率常数测定
实验日期: 提交报告日期:
带实验的老师
一、 引言
1. 实验目的
1.学习测定化学反应动力学参数的一种物理化学分析方法——电导法。
2.了解二级反应的特点,学习反应动力学参数的求解方法,加深理解反应动力学特征。
3.进一步认识电导测定的应用,熟练掌握电导率仪的使用方法。
2. 实验原理
反应速率与反应物浓度的二次方成正比的反应为二级反应,其速率方程式可以表示为
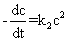 (1)
(1)
将(1)积分可得动力学方程:
 (2)
(2)
 (3)
(3)
式中: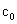 为反应物的初始浓度;
为反应物的初始浓度;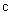 为t时刻反应物的浓度;
为t时刻反应物的浓度;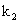 为二级反应的反应速率常数。将1/c对t作图应得到一条直线,直线的斜率即为
为二级反应的反应速率常数。将1/c对t作图应得到一条直线,直线的斜率即为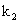 。
。
对于大多数反应,反应速率与温度的关系可以用阿累尼乌斯经验方程式来表示:
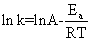 (4)
(4)
式中: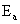 为阿累尼乌斯活化能或反应活化能;
为阿累尼乌斯活化能或反应活化能; 为指前因子;k为速率常数。
为指前因子;k为速率常数。
实验中若测得两个不同温度下的速率常数,就很容易得到
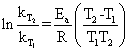 (5)
(5)
由(5)就可以求出活化能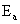 。
。
乙酸乙酯皂化反应是一个典型的二级反应,
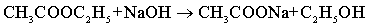
t=0时, 
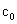 0 0
0 0
t=t时, 



t=∞时, 0 0 

设在时间t内生成物的浓度为x,则反应的动力学方程为
 (6)
(6)
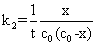 (7)
(7)
本实验使用电导法测量皂化反应进程中电导率随时间的变化。设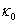 、
、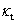 和
和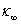 分别代表时间为0、t和∞(反应完毕)时溶液的电导率,则在稀溶液中有:
分别代表时间为0、t和∞(反应完毕)时溶液的电导率,则在稀溶液中有:



式中A1和A2是与温度、溶剂和电解质的性质有关的比例常数,由上面的三式可得
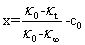 (8)
(8)
将(8)式代入(7)式得:
 (9)
(9)
整理上式得到
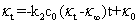 (10)
(10)
以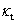 对
对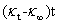 作图可得一直线,直线的斜率为
作图可得一直线,直线的斜率为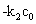 ,由此可以得到反应速率系数
,由此可以得到反应速率系数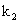 。
。
溶液中的电导(对应于某一电导池)与电导率成正比,因此以电导代替电导率,(10)式也成立。本实验既可采用电导率仪,也可采用电导仪。
3实验操作
3.1 实验用品
计算机及接口一套(或其他电导数据记录设备);DDS-11A型电导率仪一台;恒温槽一套;混合反应器3个;电导管2个;20ml移液管2支;10ml移液管2支;0.2ml移液管1支;100ml容量瓶1个;洗耳球一个。
0.02mol·dm-3NaOH标准溶液(此浓度仅为大概值,具体值需实验前准确滴定);0.01mol·dm-3NaAc溶液(此浓度值为NaOH标准溶液的一半);乙酸乙酯(AR);新鲜去离子水或蒸馏水。
3.2 实验条件
3.3 实验操作步骤及方法要点
1. 乙酸乙酯溶液的配制
配制100ml乙酸乙酯溶液,使其浓度与氢氧化钠标准溶液相同。乙酸乙酯的密度根据下式计算:
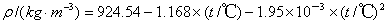
配制方法如下:在100ml容量瓶中装2/3体积的水,用0.2ml刻度移液管吸取所需乙酸乙酯的体积,滴入容量瓶中,加水至刻度,混匀待用。
2. 仪器和药品准备
检查仪器药品,接通电源。设定恒温槽温度为20℃(可根据实际情况调整),用稀释一倍的氢氧化钠溶液调电导率仪指针在大约五分之四满刻度的位置(注意实验过程中不准在调指针位置),并接通相应设备电源,准备数据采集。
3. 测量
将混合反应器(如图1所示)置于恒温槽中,用20ml移液管移取氢氧化钠标准溶液于1池中,再移取20 ml乙酸乙酯溶液于2池中,将电导电极插入2池,恒温约10分钟,用洗耳球使1、2池中溶液混合均匀并立即开始电导数据采集,约20分钟后即可停止实验。
取适量醋酸钠溶液于电导管中,插入电导电极,恒温后测定醋酸钠溶液的电导率К∝。(应多次测量,直到显示数据没有太大变化为止)
升高温度3~5℃,重复以上步骤测定反应电导率的变化,直到30℃左右。

图1:混合反应器示意图
4.结果与讨论
4.1 原始实验数据
4.1.1乙酸乙酯取量:
利用室温为25℃以及乙酸乙酯密度计算公式:
ρ/(g•L-1)= 924.54-1.168×(t/℃)-1.95× ×
×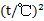
得到乙酸乙酯密度ρ=894.12 g•L-1。配制0.01899 mol/L NaOH标准液相同浓度的乙酸乙酯需要体积为:
V=0.187ml
其中乙酸乙酯式量为M=0.088105 kg/mol。
所以移取0.187mL分析纯乙酸乙酯配制0.01899mol/L乙酸乙酯。
4.1.2不同温度下NaAc溶液的电导率?∞:
在不同温度下NaAc溶液的电导率近似认为是反应完成后的电导率,其值列于表1:

表1: NaAc溶液电导率
4.2 计算的数据、结果

图1 27.8℃时随时间变化拟合图及数据
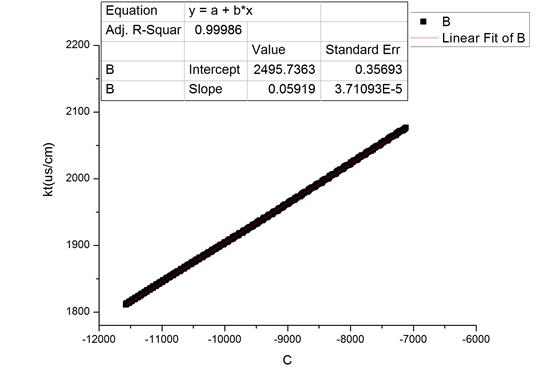
图2 28.7℃时随时间变化拟合图及数据
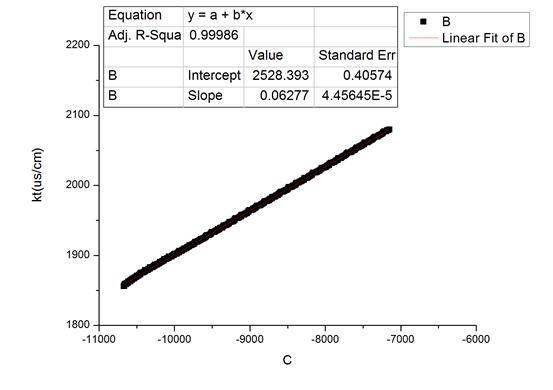
图3 30.1℃时随时间变化拟合图及数据
由上可知,不同温度下的反应速率系数k:

以lnk/[k]对1/T作图.由直线斜率求出活化能Ea。
速率-温度数据表

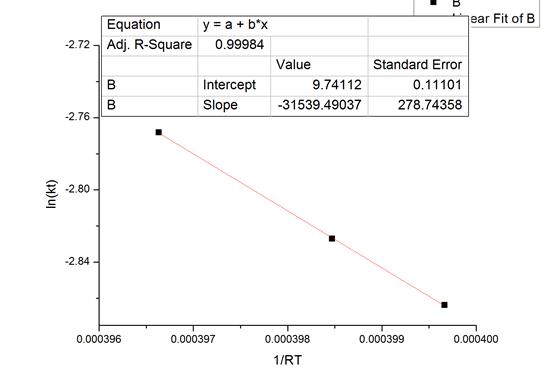
由此可得活化能 =31539.49 J/mol
=31539.49 J/mol
4.3讨论分析
1.实验时用移液管取用乙酸乙酯,NaOH溶液时,吸入液体体积应大于所需体积,用手堵住管口后慢慢释放多余的,因为释放较快,所以接近刻度时,应用手堵住管口慢慢旋转,这样液面会缓缓下降,使凹面最低点与刻度重合,这样使取用准确。
2.使用洗耳球时,操作也不应过大,有一次挤压过猛,使液体上升过猛,有一部分液体进入洗耳球,这样会损坏洗耳球的橡胶。
3.第一次混合操作时,没太注意缓慢,致使液体从管里溢出,使得实验失败重新操作。
4.计算机记录数据较正常,没有出现很大的起伏点。保留数据作图时,只是凭着感觉舍去了前面偏差较大的部分,因而结果与文献值有一定范围的偏差。
5.因软件不同,拟合出的结果有一定差别。
6.为了直观,作图时,选取坐标为1/RT,使得斜率的相反数即是所需的活化能。
5.进一步的讨论
(1)如果恒温槽的温度波动太大,会对皂化反应的速率与作图时的线性产生较大影响。
(2)如果配制溶液时所用的蒸馏水存放已久,其中会溶解一部分的CO2,与溶液中的NaOH发生反应,降低NaOH溶液浓度。实验用的蒸馏水应当煮沸,最好用新生产的去离子水。
(3)冬季进行本实验,可将配制溶液的容量瓶一同置于恒温槽内恒温,并用温度计测量溶液的温度,以判断双管电导池内的溶液温度。
(4)皂化反应曲线随着时间的延长,会出现偏离二级反应的现象。对此,有的研究者认为,“皂化反应是双分子反应”的说法欠妥,此反应是一种“表观二级反应”;随着反应时间的延长,反应的可逆性对总反应的影响逐渐变得明显[1]。有的研究者认为,皂化反应中还存在盐效应,即某些中性盐的存在会降低其速率系数,因此,皂化反应实验的时间以半小时为宜,至多不能超过40min[2]。
(5)数据处理方法比较
电导法测定乙酸乙酯皂化反应速率系数是一种较为通用的方法,但数据处理方法有很多种。除按照上面的方法计算外,还可以对其进行整理变换,得到下式:
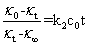 (11)
(11)
以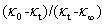 对t作直线,由斜率求得k2。
对t作直线,由斜率求得k2。
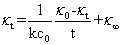 (12)
(12)
以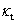 对
对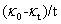 作直线,由斜率求得k2。
作直线,由斜率求得k2。
 (13)
(13)
以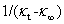 对t作直线,由斜率及
对t作直线,由斜率及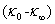 求得k2。
求得k2。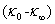 可以不用测量,而由截距求得。
可以不用测量,而由截距求得。
在上述几种计算方法中,有些要用到反应起始时的电导率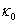 ,这需要将电导率随时间变化曲线外推至起始混合时间而得到。外推过程往往会引入误差,这便是公式(11)、(12)不足之处。公式(12)计算过程不需要
,这需要将电导率随时间变化曲线外推至起始混合时间而得到。外推过程往往会引入误差,这便是公式(11)、(12)不足之处。公式(12)计算过程不需要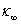 ,省略了NaAc溶液的配制及其电导率的测量,但公式中有
,省略了NaAc溶液的配制及其电导率的测量,但公式中有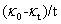 ,由于反应初期阶段,t值较小,电导率测量的误差将会给
,由于反应初期阶段,t值较小,电导率测量的误差将会给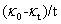 带来较大的误差,从而影响到k值的计算。
带来较大的误差,从而影响到k值的计算。
6.参考文献
[1] 李德忠,化学通报,1992,(9) :53-55。
[2] 金家骏,化学通报,1974,(3):1981,(11)。
[3] 清华大学化学系物理化学实验编写组,物理化学实验.北京:清华大学出版社,1991:201-209.
[4] 淮阴师范学院化学系,物理化学实验.2版.北京:高等教育出版社,2002:141-148.
7. 思考题
1、配制乙酸乙酯溶液时,为什么在容量瓶中要先加入部分蒸馏水?
答:本次实验取用的乙酸乙酯量很少且纯度高,先加入部分蒸馏水,可以立即稀释原乙酸乙酯溶液,防止乙酸乙酯挥发造成损失。
2、为什么乙酸乙酯和NaOH溶液浓度必须足够稀?请推导出公式?0=A1c0中A1的表达式,从而说明其为常数的条件。
答:CH3COOC2H5+NaOH→CH3COONa+C2H5OH ,当初始浓度足够稀时,可保证反应过程中的电导率为NaOH与NaAc(稀溶液)的电导率与分解率成线性。
3、若配制乙酸乙酯溶液时用的不是去离子水,电导管和混合器未洗干净,对实验结果有什么影响?
答:可能导致测得的电导率偏大。若杂质参与反应,则对实验结果可能造成较大影响;若不参与反应,则对最终结果影响不大。
4.预先单独用NaOH溶液来调整电导率仪有何作用?
答:因为NaOH是强电解质,在溶液中完全电离,而且稳定,故它的电导率比较稳定,能够很好地选择电导率的量程。。
5、 混合反应器的设计思想是什么?请提出其它的混合方法。
答:设计思想:通过虹吸管将两容器分隔开,然后等溶液加热到恒温时运用气压差将两溶液混合,从而保证了反应自始至终在恒温下进行。
其他方法:还可以用胶皮管将两锥形瓶连接,当温度恒定后反转其中一瓶,使其液位高于另一瓶中液位,从而将两溶液混合。
6.如何用化学方法来测定该反应的速率常数?
答:PH法
可以使用酸度计,通过对实验中PH的测定间接算出溶液中各物质的含量,然后结合反应时间算出反应的速率常数。
